トップページ > 研究組織一覧 > 基盤的臨床開発研究コアセンター > 薬効試験部門 > 研究プロジェクト > 次世代蛍光免疫染色技術を活用した腫瘍組織イメージング
次世代蛍光免疫染色技術を活用した腫瘍組織イメージング
更新日 : 2021年08月27日
1. 免疫組織化学 (immunohistochemistry; IHC)
免疫組織化学 (以下、免疫染色)は特異抗体を用いることで検出を目的とする成分 (標的抗原)の存在や局在を可視化する手法で、病理診断や創薬研究において広く使用されています。免疫染色は酵素標識抗体と特定の基質を用いる酵素標識法 (例. ペルオキシダーゼ標識抗体とDAB)と蛍光標識抗体を用いる蛍光標識法に分類されます。酵素標識法は一般的な光学顕微鏡で観察でき、標本の取扱いが容易なため最も広く用いられていますが、蛍光標識法と比較して非特異反応注釈1が多い、多重染色に向かないといったデメリットがあります。蛍光標識法は酵素標識法のデメリットを克服する方法として注目されていますが、組織の自家蛍光注釈2が標的抗原の検出を妨害することがしばしば問題になります。
注釈1. 特異抗体が標的抗原以外と結合する反応
注釈2. 生体組織自体、容器等が発する蛍光のことで、蛍光標識抗体の観察の妨げになる
2. 腫瘍微小環境と薬物動態イメージング
腫瘍組織はがん細胞だけでなく、免疫細胞、線維芽細胞、血管内皮細胞などの多様な細胞で構成されています (腫瘍微小環境)。腫瘍微小環境ではこれらの構成成分が複雑に作用し合うことで腫瘍の増殖・浸潤を制御し、抗がん剤の作用にも影響することが知られています。そのため、抗がん剤の腫瘍組織における動態を知るためには、従来用いられているホモジナイズ腫瘍における薬物濃度解析ではなく、腫瘍微小環境が維持された組織を用いたイメージング解析が理想とされます。当ラボでは、従来の蛍光標識免疫染色の課題であった自家蛍光による標的抗原の検出阻害を克服する複数の画期的な蛍光イメージングプローブを活用することで、腫瘍微小環境と投与された抗がん剤を同時に評価する技術の開発を進めています。
3. 高輝度蛍光ナノ粒子 (Phosphor integrated dots)を用いたイメージング
高輝度蛍光ナノ粒子 (Phosphor integrated dots; PID)は東北大学とコニカミノルタ株式会社により共同開発された一般的な蛍光色素よりも約3万倍の高輝度を有するナノ粒子です (Gonda K, et al. Sci Rep. 2017) 。PIDを免疫染色の標識体として利用するPIDイメージングは、自家蛍光とは一線を画する明るさで標的抗原の検出を可能にします。さらに、一般的な蛍光標識免疫染色では顕微鏡観察時の強い光で蛍光強度が容易に減衰しますが、PID粒子は低褪色性であることから、PIDイメージングを施した標本は長期保管が可能です。加えて、免疫染色による解析は通常、定性的ですが、PID粒子の高輝度で増感を必要としない性質や均質な性質を活かすことで、PIDイメージングでは専用ソフトウェアを用いた定量的な解析が可能です。
当ラボでは、PIDイメージングを活用した腫瘍組織上のバイオマーカーや薬物のイメージング解析を行っています。
解析事例1. PDXにおけるHER2たんぱく質の検出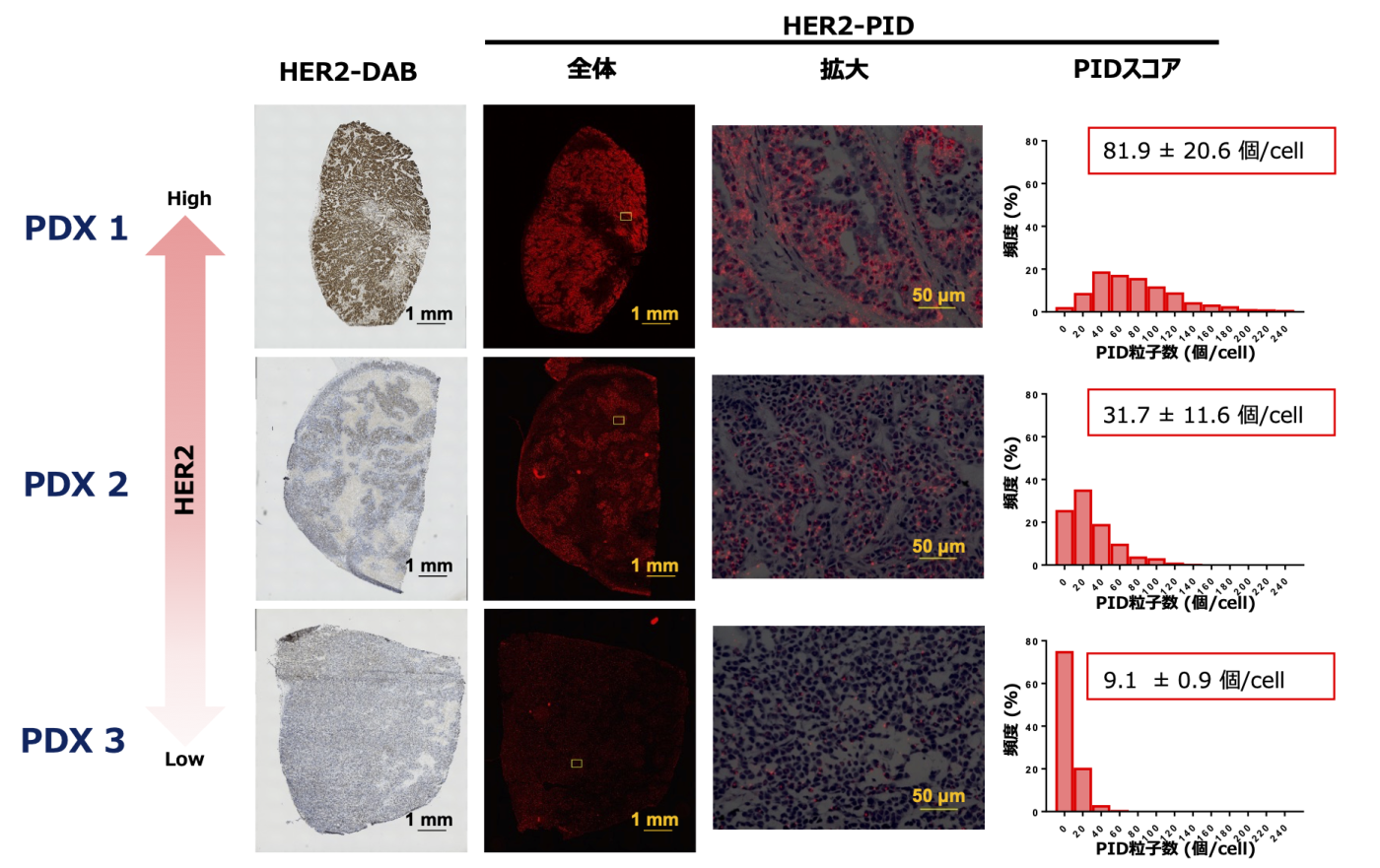
◎ HER2発現量の異なる乳がんPDX組織に対して抗HER2抗体を用いたPIDイメージングを行うことで、1細胞あたりのPID結合数を数値化し、HER2発現を連続変数で評価することに成功しました。(鈴木, 他. 第40回日本臨床薬理学会学術総会. 2019)
解析事例2. HER2不均一モデルにおける抗HER2抗体薬物複合体の検出
トラスツズマブデルクステカン (DS-8201a, ENHERTU®)はHER2を標的にした抗体薬物複合体 (Antibody-drug conjugate; ADC)です注釈3。DS-8201aは抗HER2抗体Trastuzumab、ペイロードDXdおよび両者をつなぐリンカーで構成され、HER2陽性がん細胞に対する殺細胞効果が期待されます。加えて、DS-8201aはDXdの高膜透過性ゆえに周囲のHER2陰性がん細胞へも殺細胞作用を有することが報告されています (バイスタンダー効果)。私たちは、臨床でしばしば確認されるHER2陽性がん細胞とHER2陰性がん細胞が混ざり合った腫瘍をマウスモデルで再現し、DS-8201a投与後の組織内薬物動態をTrastuzumabとDXdそれぞれを標的としたPIDイメージングで評価し、バイスタンダー効果の可視化に成功しました。この研究結果はClinical Cancer Researchに掲載されました (Suzuki M, et al. Clin Can Res. 2021)。
注釈3. ADC: 抗体と薬物 (ペイロード)を適切なリンカーを介して結合させた薬剤で、がん細胞に発現している標的抗原に結合する抗体を介して薬物をがん細胞に直接送達することで、薬物の全身暴露を抑えつつがん細胞への高い攻撃力が期待できる。
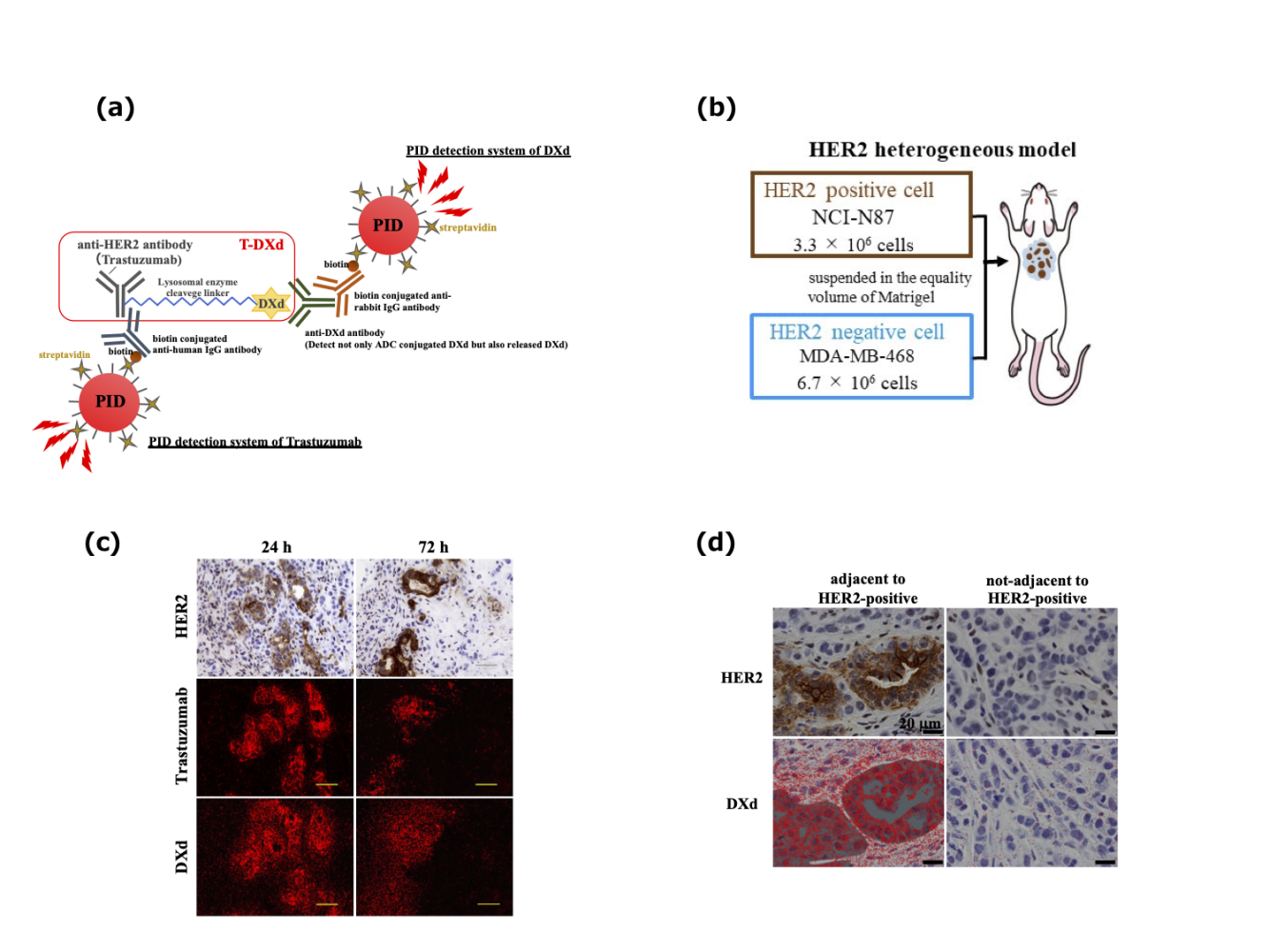
(a) DS-8201aの構造とPID imagingの模式図 (b) HER2発現不均一マウスモデルの作製
(c) DS-8201a投与24時間後と72時間後のHER2発現、Trastuzumab-PID、DXd-PID
の代表画像。Trastuzumabの分布はHER2発現とよく一致していますが、DXdは周囲のHER2
陰性領域にも分布が認められました。
(d) HER2陰性領域へのDXdの分布はHER2陽性領域に隣接する場合にのみ認められました。4. Opal蛍光多重免疫染色システムを用いたイメージング
Opal蛍光多重免疫染色はチラミド増幅 (Tylamide signal amplification; TSA)を活用し、単一標本で最大8抗原を同時に高感度検出することができるシステムです。Opal試薬で染色した標本を組織切片解析イメージングシステムで解析することで、各抗原の発現や空間的相関を1細胞レベルで実施することが可能です。当ラボでは、抗薬物抗体による抗がん剤の検出と腫瘍微小環境の構成成分ならびに腫瘍バイオマーカーの検出にこの手法を活用することで、抗がん剤の薬物動態と腫瘍微小環境の相互作用の解析を進めています。
解析事例1. PDXモデルの腫瘍微小環境解析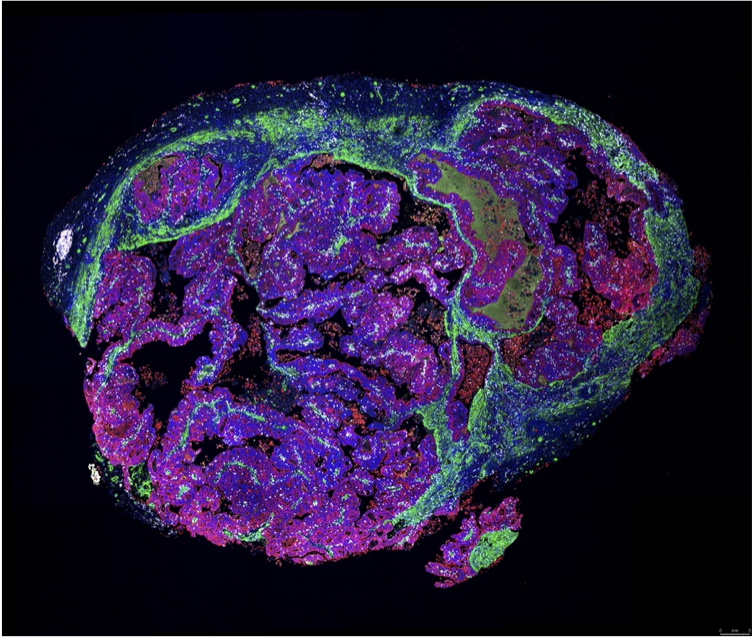
◎ 大腸がん由来PDXのパラフィン包埋切片に対して、3種類の特異抗体と波長の異なるopal試薬で蛍光多重免疫染色を行いました。
赤: COX IV(腫瘍細胞), 緑: a-sma(線維芽細胞), 白: CD45(リンパ球), 青: DAPI(核)
解析事例2. Pembrolizumabの薬物動態解析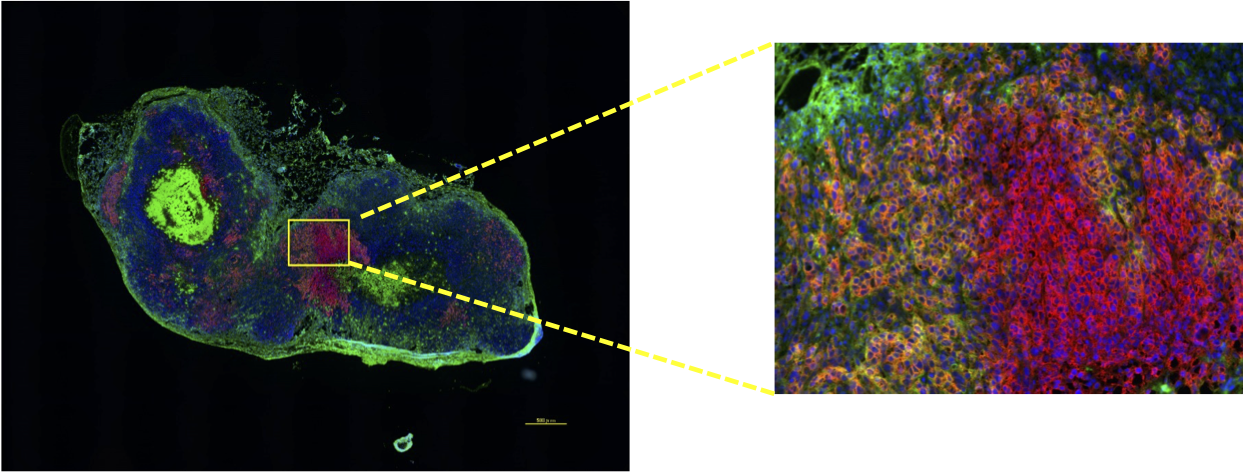
◎ Pembrolizumabを投与したPD-1過剰発現HeLaゼノグラフトモデルの凍結切片に対してPD-1とPembrolizumab注釈4の二重染色を行い、受容体と抗体薬の局在を可視化しました。
赤: PD-1 (受容体), 緑: Pembrolizumab (抗体薬), 青: DAPI (核)
注釈4. 当ラボで作製した抗Pembrolizumab idiotypic monoclonal antibodyを使用
5. イメージング研究のさらなる発展に向けて
近年のがん研究分野におけるイメージング技術の発展は目覚ましく、今回紹介した組織切片を使用した方法以外にも生体イメージングや3Dイメージングなど様々な方法が登場しています。また、解析技術への人工知能 (AI)の活用も盛んです。私たちは、これらの新規性のある有用な技術を積極的に取り入れると同時に、ラボが有する質量分析技術やPDX作成技術などとのコラボレートによる妥当性検証に支持された質の高いイメージング研究を実現します。腫瘍組織におけるバイオマーカーや薬物動態のイメージング研究に興味がおありで、共同研究を希望される場合には当分野へ連絡をお願いいたします。
文責:鈴木美記子

