目次
- 要 約
- 第1章 大腸がんの病態
- 1.1 大腸の解剖
- 1.2 大腸がんの病態(定義・症状・肉眼型・病理)
- 1.3 大腸がんの発がんメカニズム
- 1.4 大腸がんの病期分類と予後
- 1章 参考文献
- 第2章 日本の大腸がん罹患・死亡の動向
- 2.1 日本の大腸がん罹患・死亡の現状
- 2.2 日本の大腸がん罹患・死亡の推移
- 2.3 諸外国との比較
- 2.4 大腸がんの将来推計
- 2章 参考文献
- 第3章 大腸がんのリスク
- 3.1 生活習慣に関連する要因
- 3.2 その他の要因
- 3.3 予防
- 3章 参考文献
- 第4章 大腸がん検診
- 4.1 大腸がん検診の有効性評価
- 4.2 大腸がん検診プログラムと精度管理
- 4.3 職域における大腸がん検診の現状と課題
- 4章 参考文献
- 第5章 大腸がんの治療
- 5.1 大腸がんに対する治療戦略の概要
- 5.2 大腸がんに対する内視鏡治療とサーベイランス
- 5.3 大腸がんに対する外科治療とサーベイランス
- 5.4 大腸がんに対する薬物療法/放射線療法
- 5章 参考文献
- 第6章 今後の方策
- 今後の方策
- 6章 参考文献
- 大腸がんファクトシート編集者、執筆者、査読者一覧
要約
第1章 大腸がんの病態
- 大腸癌は大腸の粘膜上皮細胞から発生する悪性腫瘍と定義される。
- 大腸癌の進行度においては、癌が大腸の壁のどの層まで浸潤しているかが重要である。
- 進行した大腸癌では、リンパ節転移、他臓器転移、腹膜播種を引き起こすことがある。
- 早期の大腸癌では、自覚症状はほとんどない。
- ある程度進行した大腸癌では、血便、便通変化、腹痛、腹部膨満感などの症状を呈することがある。
- 大腸癌の主な発生経路として、古典的経路(adenoma-carcinoma sequence)、de novo pathway、ならびに鋸歯状経路(serrated pathway)が挙げられる。
- 遺伝性大腸癌が全体の約5%を占める。
- 大腸癌の病期(Stage)は、壁深達度、リンパ節転移、遠隔転移に基づいて分類される。
- 大腸癌の予後は比較的良好で、早期発見例(Stage Ⅰ)での5年生存率は93%である。
第2章 日本の大腸がん罹患・死亡の動向
- 日本では年間15万人以上が大腸がんと診断され(がん罹患全体の15.6%)、最も多いがんである。
- 日本人が一生のうちに大腸がんと診断される確率は、男性10.3%、女性8.1%である。
- 日本では年間5万3千人以上が大腸がんで死亡しており(がん死亡全体の13.8%)、肺がんに次いで2番目に多い。また女性では最も割合が高いがんである。
- 日本人が大腸がんで死亡する確率は、男性3.1%、女性2.7%である。
- 大腸がんの罹患数は、人口の急激な高齢化を背景に、増加を続けているが、2010年までの年齢調整罹患率では横ばいの傾向にあった。
- 全国がん登録が開始された2016年以降を考慮すると、女性において穏やかな増加傾向がみられる。
- 死亡数も同様に増加しているが、年齢調整死亡率は近年、穏やかな減少傾向にある。
- 諸外国と比較して、日本の年齢調整罹患率・死亡率は高い水準にある。
- 将来推計によると、大腸がんの罹患数・死亡数はさらなる増加が見込まれている。
第3章 大腸がんのリスク
- 喫煙は、「科学的根拠に基づくがんリスク評価とがん予防ガイドライン提言に関する研究」においても、大腸がんの「確実」なリスク因子とされている。
- 飲酒も同様に大腸がんの「確実」なリスク因子であり、アルコールの代謝で産生されるアセトアルデヒドや活性酸素に発がん性があることが示唆されている。
- 肥満および高身長による大腸がんのリスク増加は「ほぼ確実」とされている。
- 国際的には、加工肉、赤肉が大腸がんのリスク要因と考えられており、全粒穀類、食物繊維、乳製品、カルシウムサプリメントなどがリスクを下げる食品とされているが、日本人におけるデータは限定的である。
- 中等度から強度の身体活動が、大腸(結腸)がんのリスクを下げることは「ほぼ確実」とされている。
- 生活習慣の改善(たばこを吸わない、飲酒をしない、適度な体重を保つ、運動する)により、結腸がんの約31%、直腸がんの約25%が予防可能だったと推計されている。
第4章 大腸がん検診
- 日本の対策型検診として、40歳以上を対象に年1回の便潜血検査免疫法2日法が用いられている
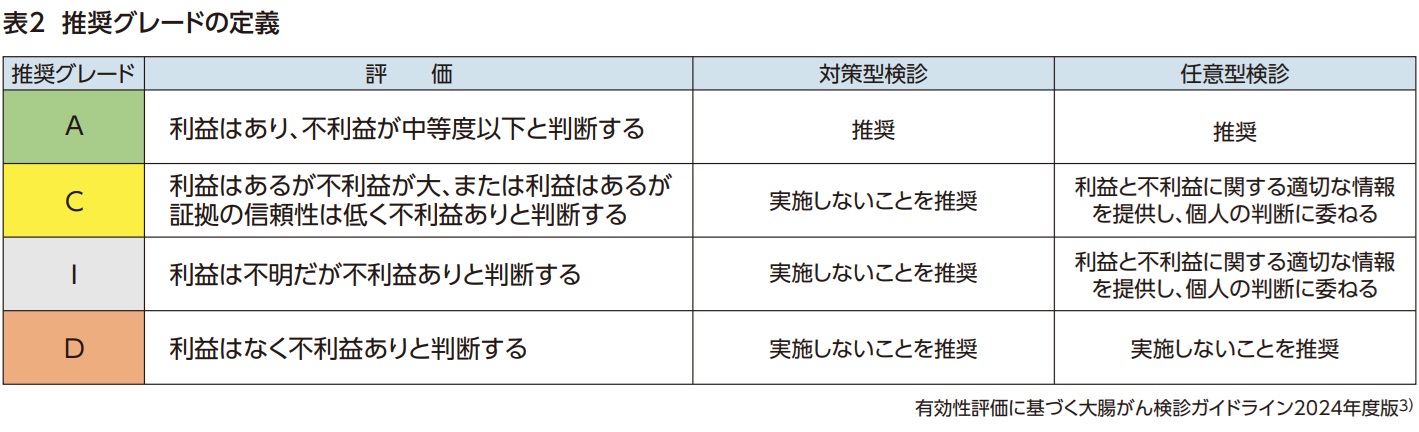
- 「有効性評価に基づく大腸がん検診ガイドライン2024年度版」では、便潜血検査免疫法の対策型・任意型検診での実施を推奨している(グレードA)。
- 全大腸内視鏡検査は、死亡率減少効果はあるが証拠の信頼性が低く不利益も大きいため、対策型検診としての実施は推奨されていない(グレードC)。
- 全大腸内視鏡検査は、大腸がん診療においては最も精度が高い必須の検査であり、前がん病変の予防的切除ができるというメリットもある。
- 日本では検診プログラムが統一されておらず、対策型検診として市区町村が実施主体となる住民検診、健康保険組合や事業主が実施主体となる職域検診、任意型検診として人間ドックがそれぞれ行われている。
- 日本では早くから公的な大腸がん検診プログラムが実施されているが、検診対象者の特定や精度管理に関する課題が多い。
- 組織型検診を導入している英国では、検診開始後に一時的に大腸がん罹患率が増加したが、大腸がん死亡率は一貫して低下している。
- 職域検診には明確な法的根拠はなく、福利厚生の一環と考えられていることも多いため、有効性評価が定まっていない検査法が使用されていたり、精度管理が不十分といった課題がある。
第5章 大腸がんの治療
- 内視鏡治療の原則は、一括切除による正確な組織学的検索であり、それに適した治療法を選択する必要がある。
- 病理診断で①SM浸潤距離1000μm以上、②脈管侵襲陽性、③低分化腺癌・印環細胞癌・粘液癌、、④浸潤先進部の簇出Grade2/3の因子のうち一つでも該当するようであれば、リンパ節郭清を伴う追加外科切除を弱く推奨するとされている
- 内視鏡的粘膜下層剥離術の開発により、従来であれば外科治療が行われていた2cm以上の大型の早期大腸癌や線維化を伴う早期大腸癌などに対しても内視鏡治療の実施が可能となった。
- 遠隔転移を伴わない根治切除可能なStage 0-Ⅲ大腸癌(内視鏡切除可能例を除く)の標準治療は外科切除であり、根治切除の原則は、①原発巣を含む十分な腸管切除と、②原発巣を栄養する血管によって規定される所属リンパ節の系統的郭清である。
- 遠隔転移を伴うStage Ⅳの大腸癌であっても、原発巣・転移巣がともに切除可能である場合や、大腸癌による腸管狭窄や出血などの症状を伴い化学療法が安全に行えない場合は手術の適応である。
- 腹腔鏡手術が83.8%と全国的に普及しているが、近年、ロボット支援手術が保険収載され、急速に件数が増加している。
- 術後再発の87%が術後3年以内、97%が術後5年以内に診断されているため、サーベイランス期間は術後5年間が目安とされている。
- 薬物療法には、術後再発抑制を目的とした補助化学療法と、延命や症状緩和を目的とした切除不能進行・再発大腸癌に対する治療の2種類がある。
- 補助化学療法は主にStage Ⅲ大腸癌が対象で、再発リスクの高いStage II大腸癌に対しても実施されることがある。
- 治療効果判定はCT、MRIなどで行うが、腫瘍縮小効果の判定にはRECISTが用いられる。
- 直腸癌の局所制御目的で放射線療法が用いられることがあるが、生存率の改善に関する明確なエビデンスはない。
第6章 今後の方策
- 1次予防に関しては、日本人は体質や生活習慣が海外諸国とは異なるため、日本独自の研究をより一層発展させることにより、日本人に最適な大腸がん予防法を確立する必要がある。
- 2次予防(検診)の強化・改善には、以下の方策が必要である。
- 受診率・精検受診率の向上
- 実施主体によらない、全国で統一されたプログラムによる検診の実施(組織型検診への移行)
- 有効性の証明された受診勧奨の強化
- 便潜血検査の精度管理(検査キットの統一、カットオフ値の標準化)
- 精密検査として施行する大腸内視鏡検査の精度管理
- 精密検査で異常がなかった場合の、その後の適切な検診受診時期の検証
- がん検診の意義に関する国民、検診従事者、医療者それぞれへの情報提供
- 診療と検診の境界の明確化
- 職域検診に対する精度管理の導入とそのための法整備
- 大腸内視鏡検診の導入を目指すには、以下の検討を進める必要がある。
- 現在進行中のRCTによる有効性の証明
- 大腸内視鏡検査の処理能力の把握
- 検診対象者の条件設定
- 処理能力を考慮した検査後のサーベイランス方法
- 偶発症の頻度
- 診療と検診の明確な棲み分け
- PHRを活用した検査歴、検診受診歴の把握
- 国レベルで正確な検診データを把握する方法の確立が課題であり、組織型検診の導入、あるいはそれに匹敵する全数把握システムの構築が必要である。
第1章 大腸がんの病態
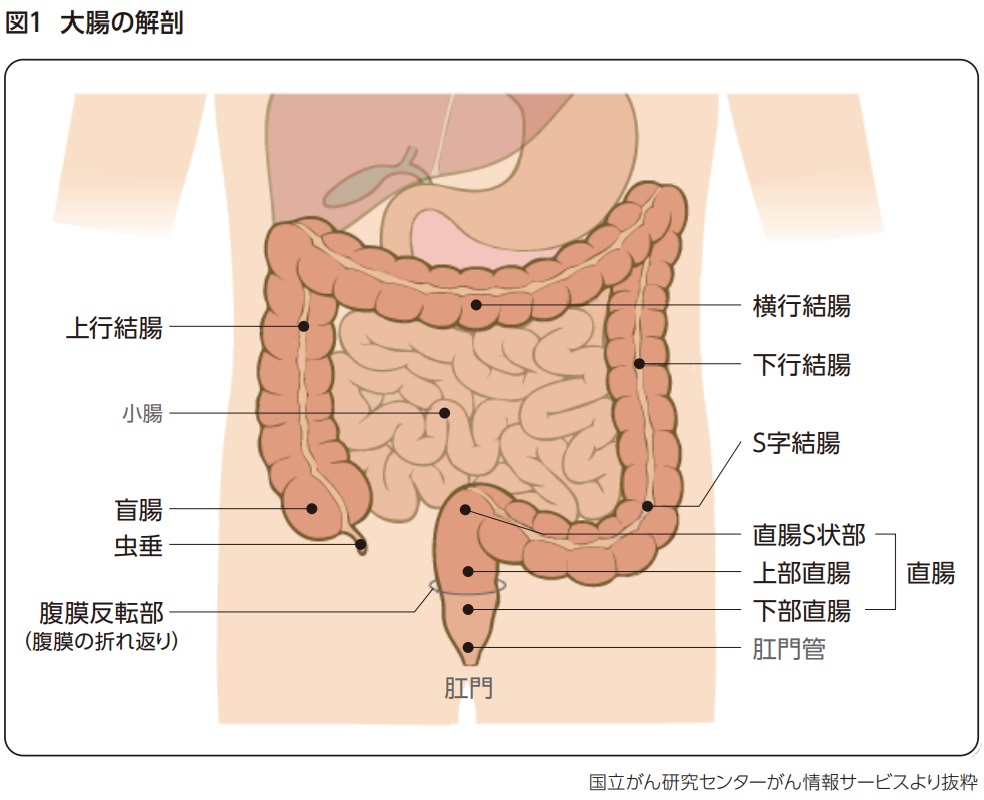
1.1 大腸の解剖
大腸は盲腸から肛門に至る全長1.5~2mほどの管腔臓器で、体内にて主に水分の吸収と便の形成・排泄を行う。腸内細菌叢による内容物の発酵や粘液分泌による便の中和も行われる。
大腸は結腸と直腸に分けられ、結腸と直腸はさらに以下のように分類される(図1)1)。盲腸から横行結腸を「右側結腸」、下行結腸からS状結腸を「左側結腸」と分類することもある。
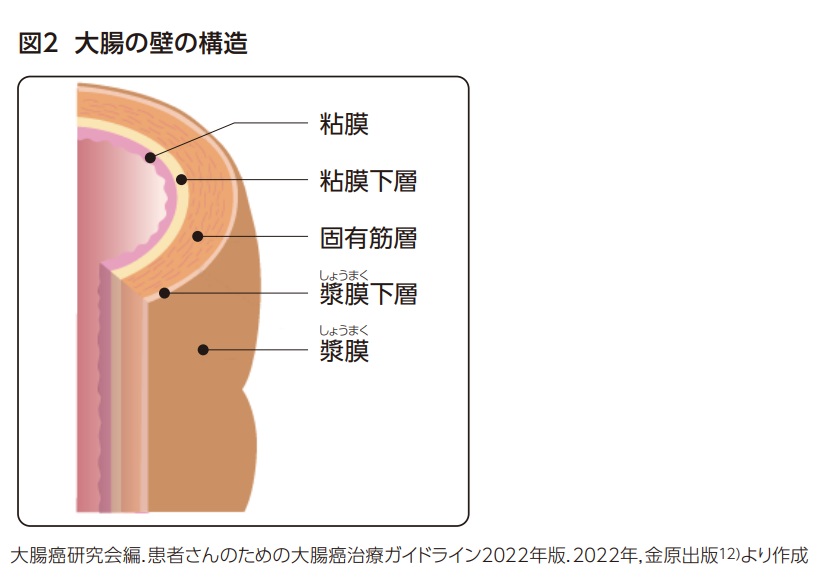
大腸の壁は、内腔側から順に粘膜(粘膜上皮,粘膜固有層,粘膜筋板)、粘膜下層、固有筋層(内輪筋,外縦筋)、漿膜あるいは外膜から成っている(図2)1)。大腸がんの進行度においては、がんがこの層のうちでどこまで浸潤しているかが重要な情報となる。
1.2 大腸がんの病態(定義・症状・肉眼型・病理)
大腸がん(注1)は大腸の粘膜上皮細胞から発生する悪性腫瘍と定義される1)。粘膜上皮細胞から発生した大腸癌は、次第に大腸壁を深く浸潤していく。進行する過程の中で大腸癌は転移をきたす。転移はリンパ行性転移、血行性転移、播種性転移に分けられ、リンパ節転移、他臓器転移、腹膜播種を引き起こす。
早期の段階では無症状のことがほとんどで、進行癌となって初めて症状を呈することが多い。代表的な症状として、血便、便通変化、腹痛、腹部膨満感などが挙げられる。癌が進行し、大腸管腔に狭窄を生じると、便の通過障害や腸閉塞が生じる。右側結腸癌では進行癌でも無症状のことがあり注意を要する。
注1: 大腸癌と大腸がん
大腸がんの表記には2種類あります。「がん」は悪性腫瘍全体を指し、「癌」は粘膜上皮細胞から発生する悪性腫瘍に限って使うとされています。
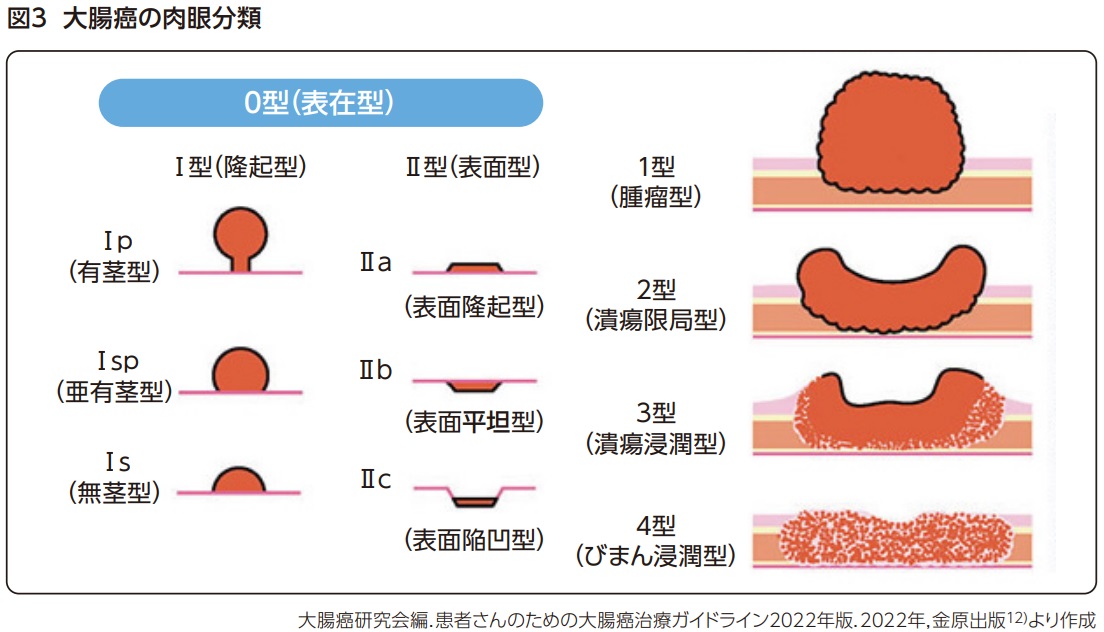
- 表在型(0型)
0-Ⅰ:隆起型
0-Ⅰp:有茎性
0-Ⅰsp:亜有茎性
0-Ⅰs:無茎性 - 表在型(0型)
0-Ⅱ:表面型
0-Ⅱa:表面隆起型
0-Ⅱb:表面平坦型
0-Ⅱc:表面陥凹型 - 腫瘤型(1型)
- 潰瘍限局型(2型)
- 潰瘍浸潤型(3型)
- びまん浸潤型(4型)
- 分類不能(5型)
表在型(0型)は早期大腸癌に対して用いられ、さらに隆起型(0-I:0-Ip, Isp, Is)と表面型(0-II: 0-IIa, IIb, IIc)に分けられる。径10mm以上の、腸管壁に沿うように側方 へ発育する腫瘍に対しては、側方発育型大腸腫瘍(Laterally spreading tumor: LST)という発育進展分類の概念が用いられることもある。LSTは形態からGranular type (顆粒均一型、結節混在型)とNon-granular type(扁平隆起型、偽陥凹型)に区分される。腫瘤型(1型)、潰瘍限局型(2型)、潰瘍浸潤型(3型)、びまん浸潤型(4型)、分類不能(5型)は進行大腸がんに使用されるが、潰瘍限局型(2型)が最も多い。
大腸がんの病理組織型としては、腺癌(乳頭腺癌、管状腺癌、低分化腺癌、粘液癌、印環細胞癌、髄様癌)、腺扁平上皮癌、扁平上皮癌などが存在するが、腺癌、特に高~中分化管状腺癌が最も多い。
1.3 大腸がんの発がんメカニズム
散発性大腸癌の発生経路として、古典的経路(adenoma-carcinoma sequence)とde novopathway、ならびに鋸歯状経路(serrated pathway)が挙げられる3-9)。
古典的経路(adenoma-carcinoma sequence)では、大腸腺腫を前駆病変とし、「腫瘍が遺伝子異常を段階的に獲得して組織像を変えながら発癌に至る」という多段階発癌過程を経て大腸癌が発生する。最初に大腸粘膜の細胞がAPC/CTNNB1変異を獲得して腺腫となり、その後KRAS変異やTP53変異、SMAD4変異などを獲得して大腸癌に至ると考えられている。
de novo pathwayとは、正常組織から前癌病変を介さず直接癌が発生する経路とされているが、その詳細な機序や頻度については明らかになっていない。
鋸歯状経路は、大腸鋸歯状病変を前駆病変とし発癌する経路であり、散発性大腸癌全体の約2~3割を占めると言われている。近年、大腸鋸歯状病変には複数の病変が含まれていることが明らかとなり、現在、主に、過形成性ポリープ(hyperplastic polyp:HP)、sessile serratedlesion(SSL)、鋸歯状腺腫(traditional serratedadenoma:TSA)に分類される。鋸歯状病変に共通する遺伝子異常はBRAF変異またはKRAS変異である。さらに 、WNT経路の活性化、ミスマッチ修復異常、CpGisland methylator phenotype(CIMP)などが関与するとされる。
その他には潰瘍性大腸炎などの炎症性腸疾患を背景に大腸癌(colitis-associated cancer, colitic cancer)が発生する経路がある。
大腸癌のうちの約30%は遺伝性素因のある大腸癌とされる10)。遺伝性大腸癌(生殖細胞系列において原因遺伝子の病的バリアントが検出されていれば、家族集積性に関係なく遺伝性大腸癌と定義される)は全大腸癌の約5%を占める。原因遺伝子が同定されている代表的な遺伝性大腸癌として家族性大腸腺腫症(familialadenomatous polyposis:FAP)やリンチ症候群があげられる。
1.4 大腸がんの病期分類と予後
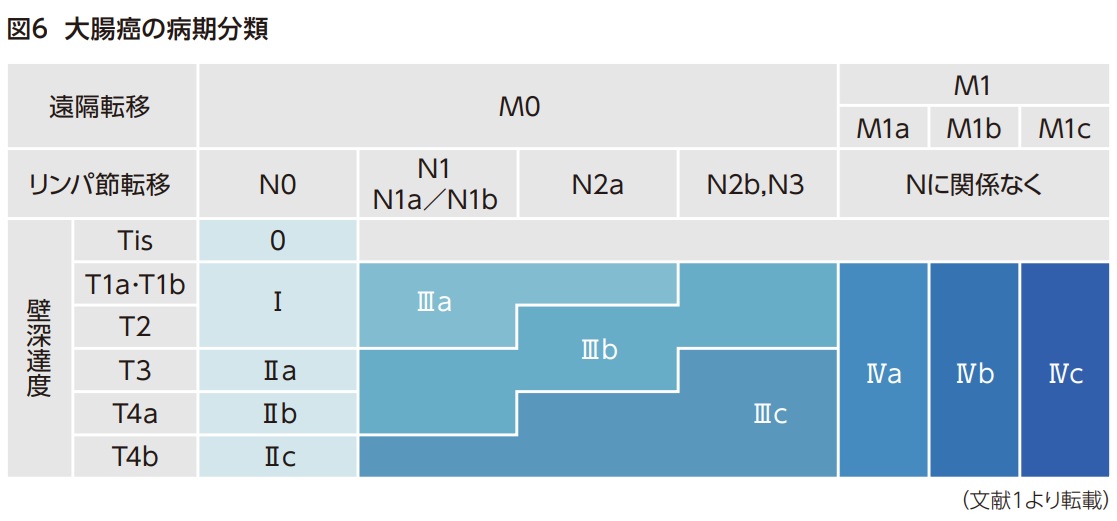
大腸癌の進行度の分類法として、本邦の「大腸癌取扱い規約」による分類と、国際的に用いられる「TNM分類」が存在する。この2つに共通点は多く、ここでは「大腸癌取扱い規約(第9版)」に基づいて病期分類を説明する1)。
大腸癌の病期は、壁深達度(T因子)、リンパ節転移(N因子)、遠隔転移(M因子)に基づいて分類される。
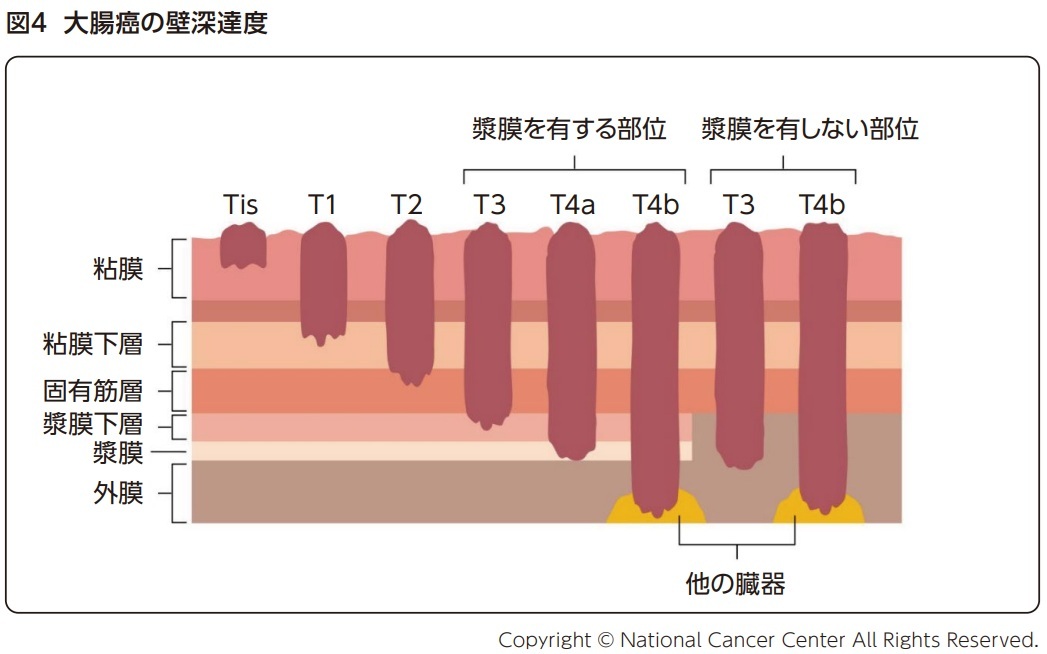
壁深達度(T因子)は癌浸潤の最深部に応じて以下のように分けられる(図4)。T1(粘膜下層)までが早期癌、T2(固有筋層)以深が進行癌と定義される。この定義において転移の有無は問わず、早期癌でも、粘膜下層深部への癌浸潤がみられるT1b癌はリンパ節転移のリスクを有する。
- TX
壁深達度の評価ができない - T0
癌を認めない - Tis
癌が粘膜内にとどまり、粘膜下層に及んでいない - T1
癌が粘膜下層までにとどまり、固有筋層に及んでいない- T1a
癌が粘膜下層までにとどまり、浸潤距離が1000μm 未満である - T1b
癌が粘膜下層までにとどまり、浸潤距離が1000μm以上であるが固有筋層に及んでいない
- T1a
- T2
癌が固有筋層まで浸潤し、これを越えていない - T3
癌が固有筋層を越えて浸潤している
漿膜を有する部位では癌が漿膜下層までにとどまる
漿膜を有しない部位では癌が外膜までにとどまる - T4a
癌が漿膜表面に接しているか、またはこれを破って腹腔に露出している - T4b
癌が直接他臓器に浸潤している
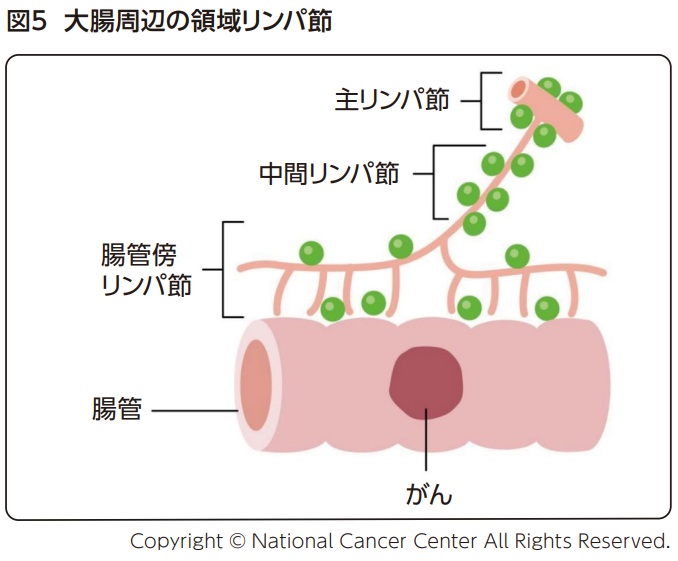
リンパ節転移(N因子)は転移の有無、領域、数により以下のように分類される。領域リンパ節(腸管傍・中間・主リンパ節)(図5)以外のリンパ節への転移は遠隔転移(M1)と診断される。
- NX
リンパ節転移の程度が不明である - N0
リンパ節転移を認めない - N1
腸管傍リンパ節と中間リンパ節の転移総数が 3個以下- N1a
転移個数が1個 - N1b
転移個数が2から3個
- N1a
- N2
腸管傍リンパ節と中間リンパ節の転移総数が 4 個以上- N2a
転移個数が4から6個 - N2b
転移個数が7個以上
- N2a
- N3
主リンパ節に転移を認める。下部直腸癌では主リンパ節および/または側方リンパ節に転移を認める。
遠隔転移(M因子)は以下のように分類される。
- M0
遠隔転移を認めない - M1
遠隔転移を認める- M1a
1臓器に遠隔転移を認める(腹膜転移は除く) - M1b
2臓器以上に遠隔転移を認める(腹膜転移は除く) - M1c
腹膜転移を認める - M1c1
腹膜転移のみを認める - M1c2
腹膜転移およびその他の遠隔転移を認める
- M1a
(文献 1より転載)
以上のT、N、M因子に基づいて大腸癌の病期は図6のように分類される。
ステージ0~IVを簡単にまとめると以下のようになる。
- ステージ0
癌が大腸粘膜内に留まるもの(転移は認めない) - ステージⅠ
癌が固有筋層までに留まるもの(転移は認めない) - ステージⅡ(a,b,c)
癌が固有筋層を超えて浸潤するもの転移は認めない) - ステージⅢ(a,b,c)
癌浸潤の深さに関わらず、リンパ節への転移を認めるもの(他臓器転移は認めない) - ステージⅣ(a,b,c)
癌浸潤の深さやリンパ節転移に関わらず、他臓器への転移を認めるもの
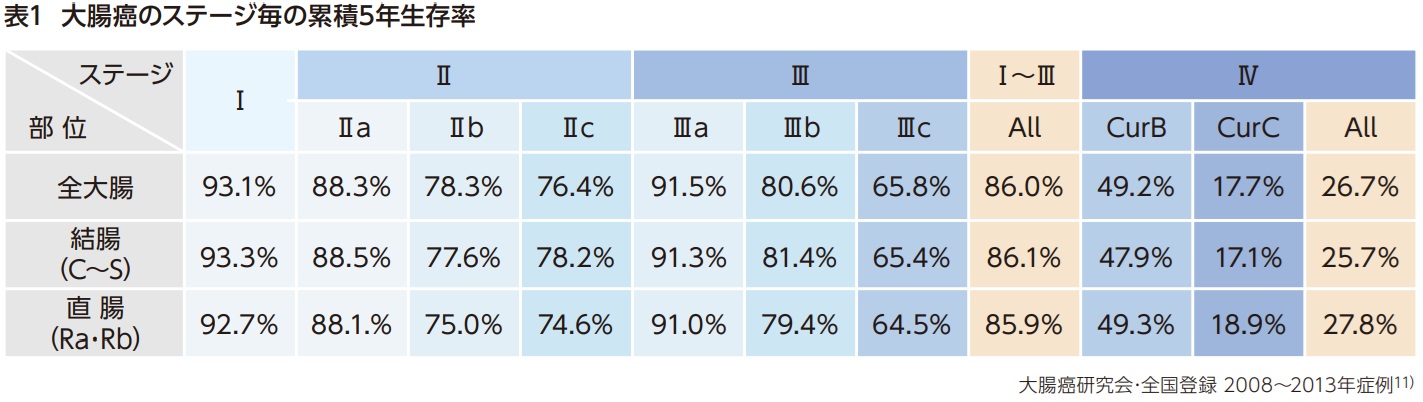
大腸癌の予後について、「大腸癌取扱い規約(第9版)」に基づく病期毎の累積5年生存率は表1の通りである11)。
CurC(根治度C)は明らかな手術後に明らかな癌遺残がある場合、CurB(根治度B)はCurA(根治度A:遠隔転移がなく、かつ切離端・剥離面がいずれも陰性)、CurCに該当しない場合を指す。
参考文献
- 大腸癌研究会編. 大腸癌取扱い規約第9版.金原出版.2018年.
- 日本消化器内視鏡学会編. 消化器内視鏡用語集第5版.医学図書出版.2023年.
- Muto T, Bussey HJ, Morson BC. The evolution of cancer of the colon and rectum. Cancer. 1975;36(6):2251-2270.
- Vogelstein B, Fearon ER, Hamilton SR, et al. Genetic alterations during colorectal-tumor development. N Engl J Med.1988;319(9):525-532.
- Leggett B, Whitehall V. Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology. 2010;138(6):2088-2100.
- IJspeert JE, Vermeulen L, Meijer GA, Dekker E. Serrated neoplasia—role in colorectal carcinogenesis and clinical implications. Nat Rev Gastroenterol Hepatol. 2015;12(7):401-405.
- . East JE, Atkin WS, Bateman AC, et al. British Society ofGastroenterology position statement on serrated polyps in the colon and rectum. Gut 2017;66(7):1181-1196.
- WHO Classification of Tumours Editorial Board. International Agency for Research on Cancer WHO classification of tumours of the digestive system, 5th ed. Lyon: International Agency for Research on Cancer; 2019.
- 橋本大輝,関根茂樹. 大腸鋸歯状病変の分子異常.消化器内視鏡 2022;34(5):893-900.
- 大腸癌研究会編. 遺伝性大腸癌診療ガイドライン2020年版.金原出版.2020年.
- 大腸癌研究会編. 大腸癌治療ガイドライン 医師用 2024年版.金原出版.2024年.
- 大腸癌研究会編. 患者さんのための大腸癌治療ガイドライン2022年版.金原出版, 2022年.
第2章 日本の大腸がん罹患・死亡の動向
2.1 日本の大腸がん罹患・死亡の現状
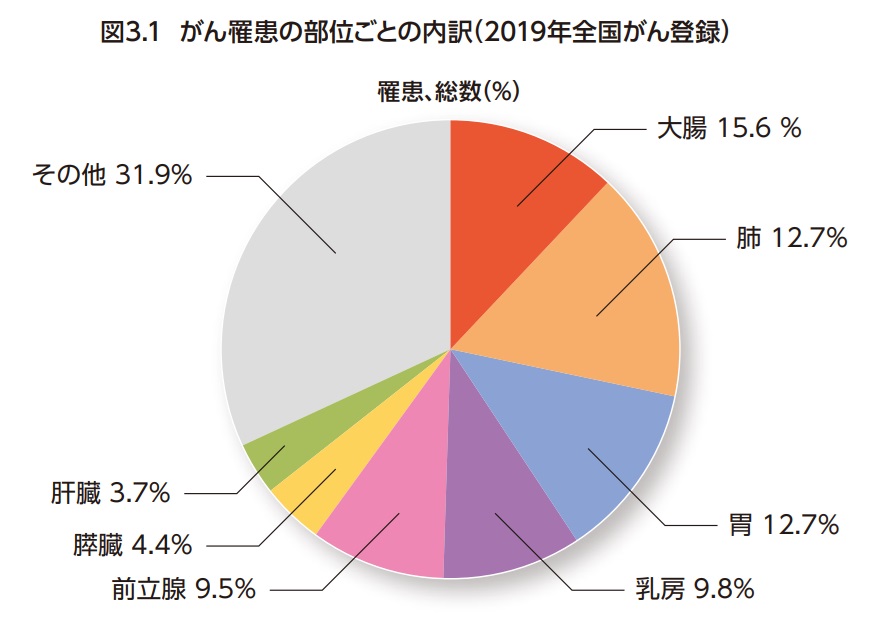
がんは、1981年に脳血管疾患を上回って以来日本人の死因の第一位となっている。2019年に新たに診断されたがん(がん罹患数)は999,075例(男性566,460例、女性432,607例)となっている1,2)。また、2022年にがんで死亡した人は385,797人(男性223,291人、女性162,506人)で、死亡総数の24.6%を占めている3,4)。わが国の大腸がん(ICD−10コード:C18-C20)の罹患数は年間155,625例(男性:87,872 例、女性:67,753例)と報告されている(2019年全国がん登録、上皮内がんを含めた場合199,099例)1,2)。
したがって罹患数の男女比でみると、男性は女性の1.30倍である。大腸がんはがん罹患全体の15.6%(男性:15.8%、女性15.6%)を占め、男女合わせた総数で最も割合が高いがんである(図3.1)。また、大腸(C18-C20)を結腸(C18)と直腸(C19-C20)に分けた場合、結腸3位(がん全体の10.4%)、直腸6位(がん全体の5.2%)となっている5)。日 本人が一生のうちに大腸がんと診断される確率(2019年データに基づく)は男性10.3%(10人に1人)、女性8.1%(12人に1人)と推計されている5)。
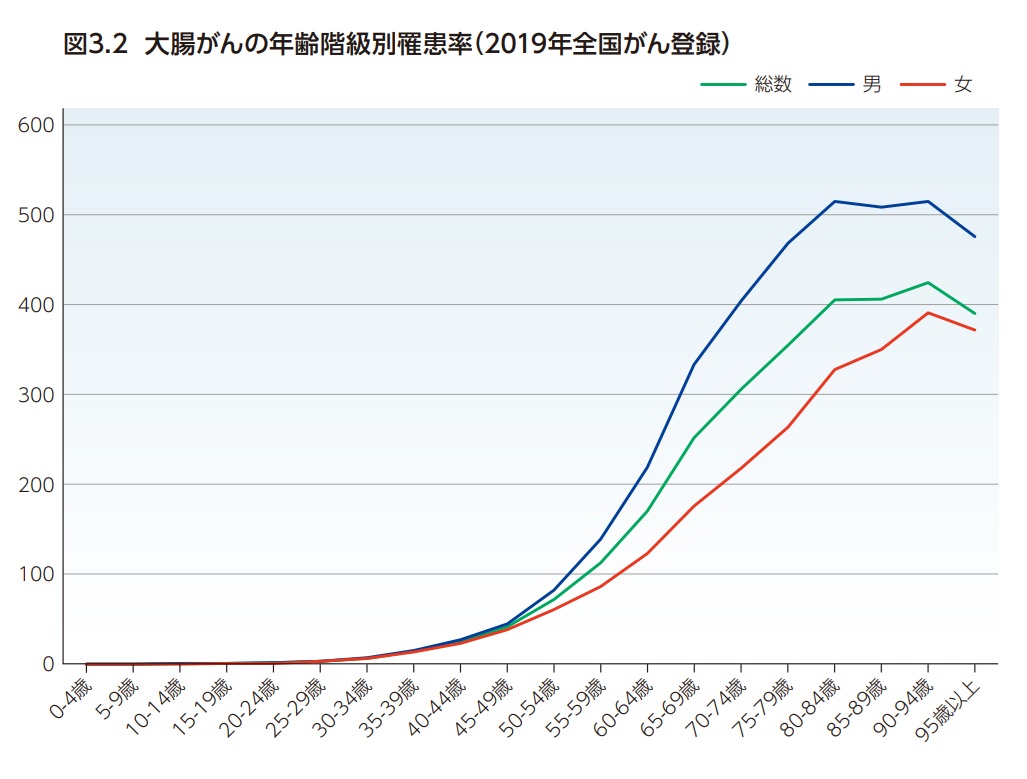
大腸がんの年齢階級別罹患率は、男女とも50歳代から80歳代前半まで大きく増加した後、それより高齢では罹患率がほぼ一定の傾向である(図3.2)。
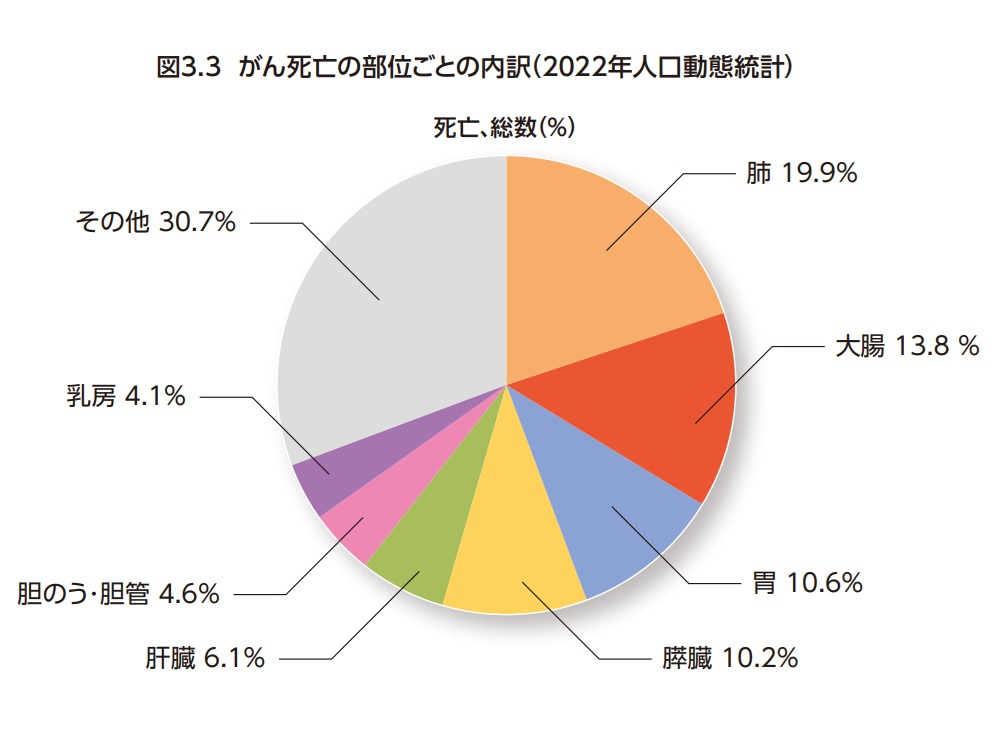
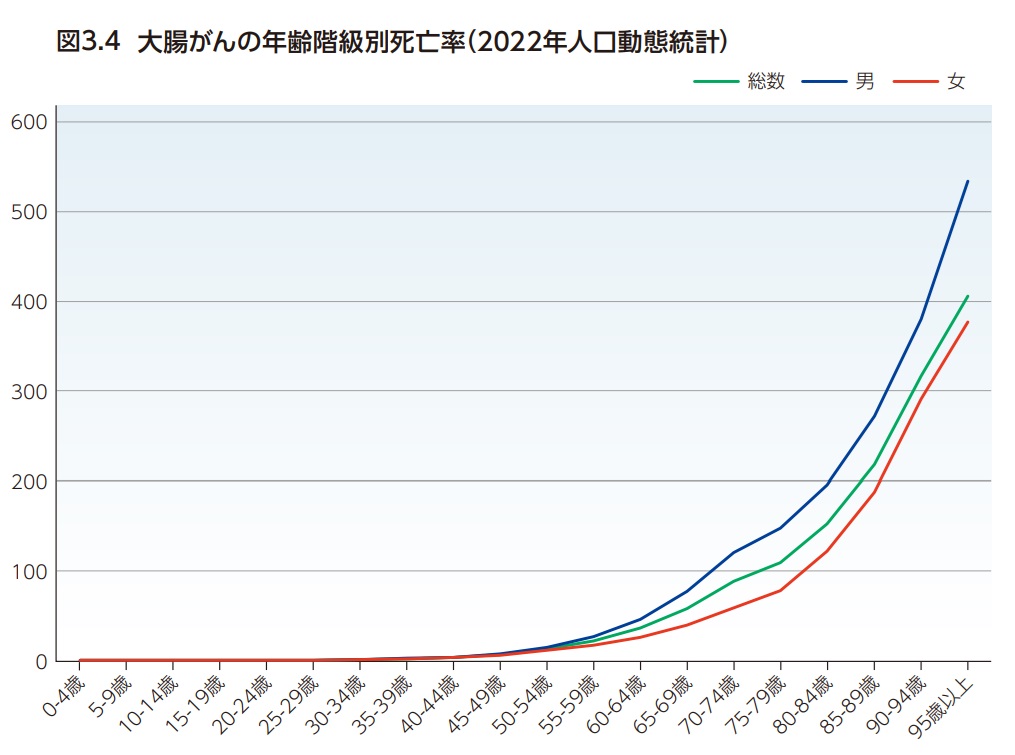
わが国の大腸がん(C18-C20)による死亡数は年間53,088人(男性:28,099 人、女性24,989人)である(2022年人口動態統計)3,4)。大腸がんはがん死亡全体の13.8%(男性:12.6%、女性15.3%)を占め肺がんに次いで2位である(図3.3)。また男性では肺がんに次いで第2位、女性では最も割合が高いがんである。また、大腸(C18-C20)を結腸(C18)と直腸(C19-C20)に分けた場合、結腸4位(がん全体の9.7%)、直腸8位(がん全体の4.1%)となっている5)。日本人が大腸がんで死亡する確率(2022年のデータに基づく)は、男性3.1%(32人に1人)、女性2.7%(38人に1人)と推計されている5)。大腸がんの死亡率は男女とも60歳代くらいから増加し始め、85歳以上で大きく増加する(図3.4)。
2.2 日本の大腸がん罹患・死亡の推移
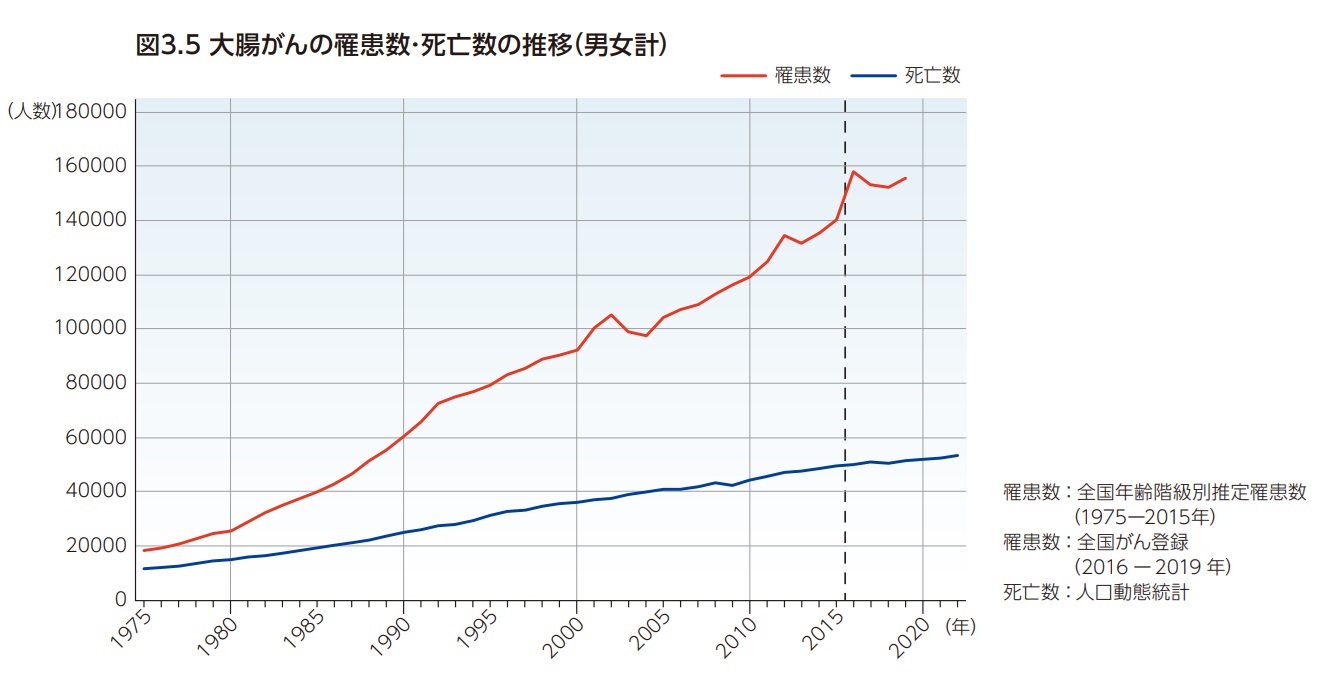
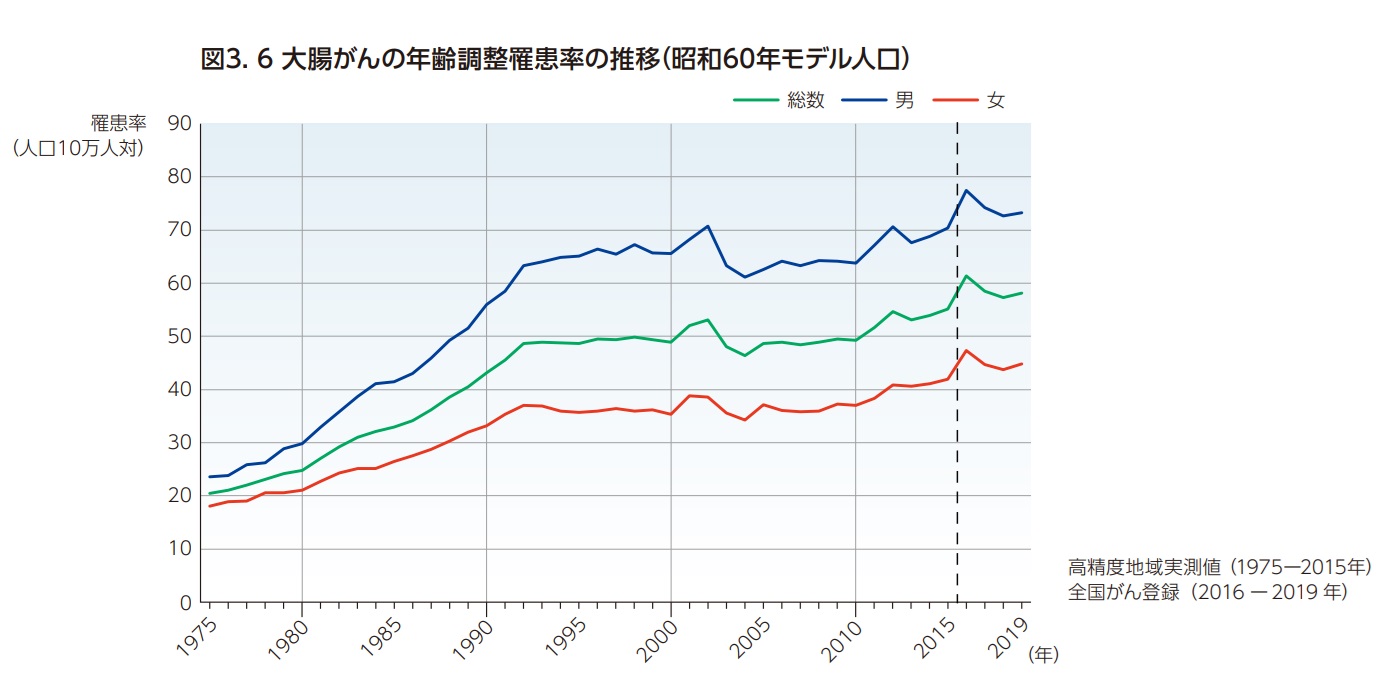
1975年に約1.8万人と推計されていた大腸がんの罹患数(1995~2002年は肛門(C21)を含む)は人口の急速な高齢化を背景に、男女とも長期にわたって増加を続けている(図3.5)。高齢化の影響を除いた年齢調整罹患率(昭和60年モデル人口)では1975年から1994年にかけて男女とも増加が続いたのち、1994年から2010年まで横ばいの傾向となっている2,6,7)(図3.6)。全国がん登録が開始された2016年以降のトレンドも考慮すると、特に女性において2010年以降では緩やかな増加傾向がみられる。
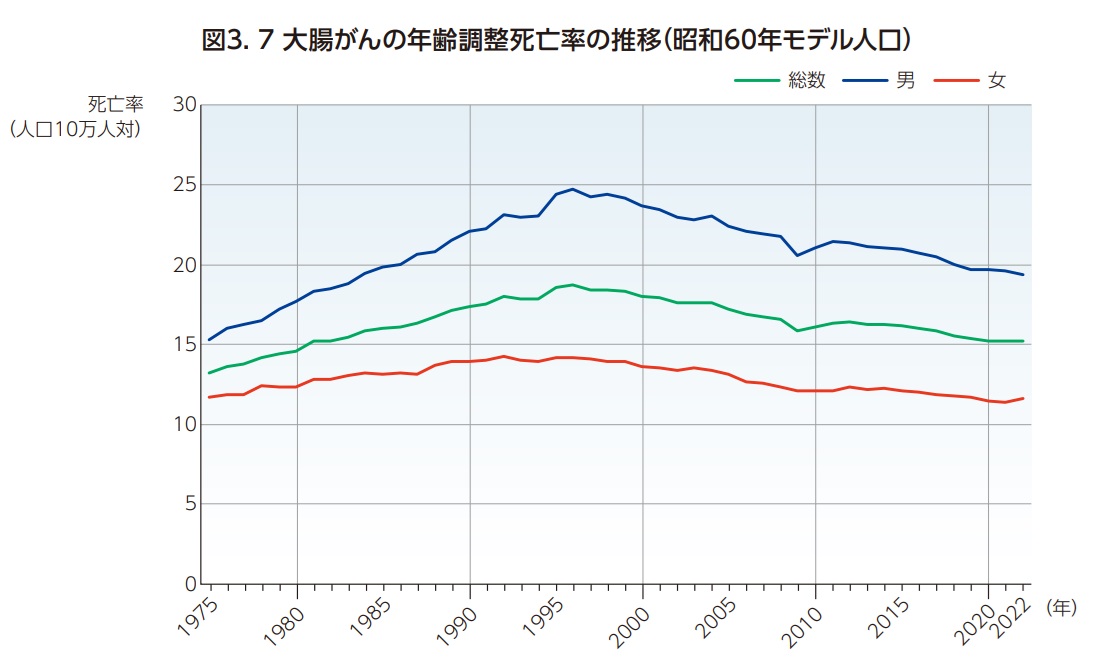
大腸がんの死亡数も罹患数と同様に男女とも長期にわたって増加を続けている(図3.5)。高齢化の影響を除いた年齢調整死亡率(昭和60年モデル人口)では1990年代半ばにかけて男女とも増加傾向が続いたのち、2022年まで緩やかに減少傾向が継続している3,4))(図3.7)。
2.3 諸外国との比較
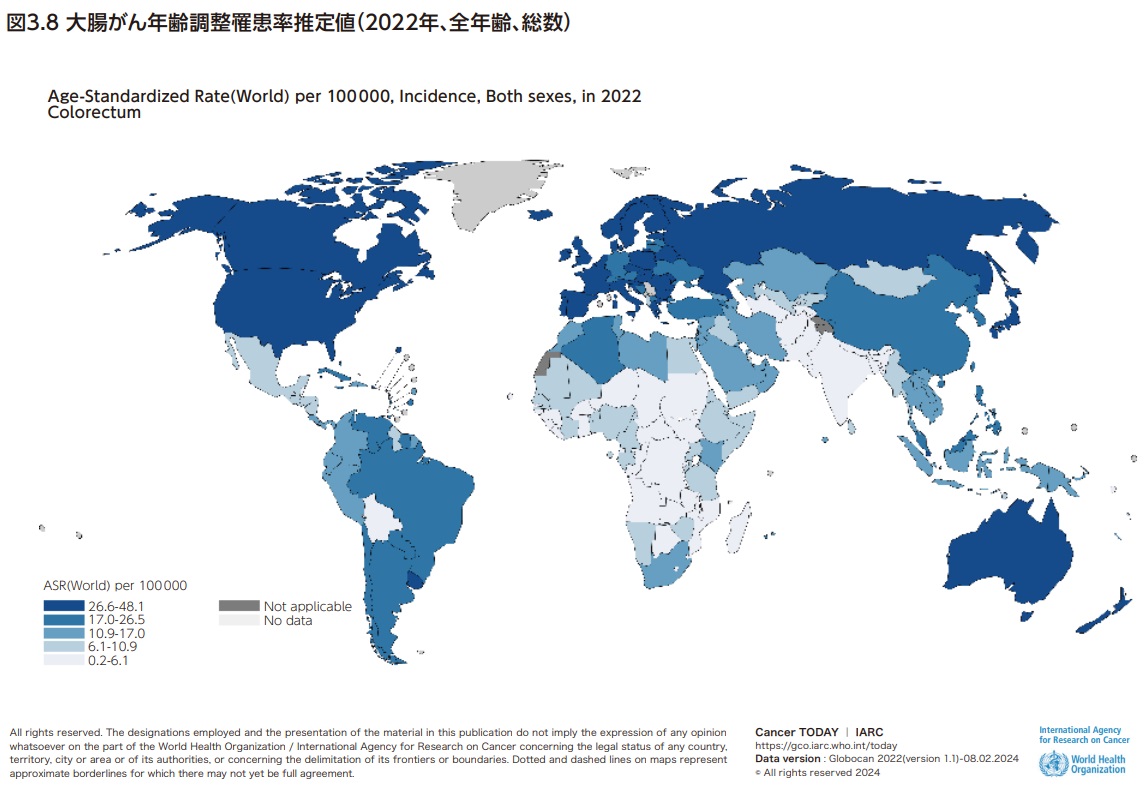
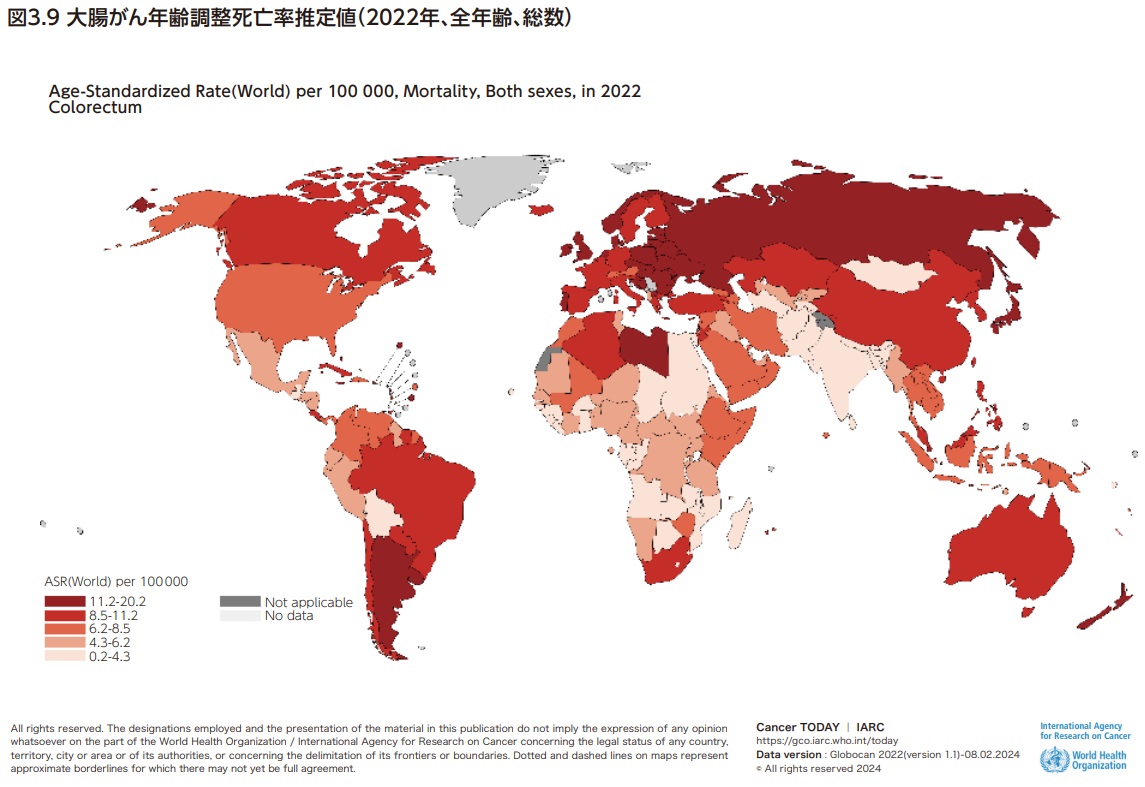
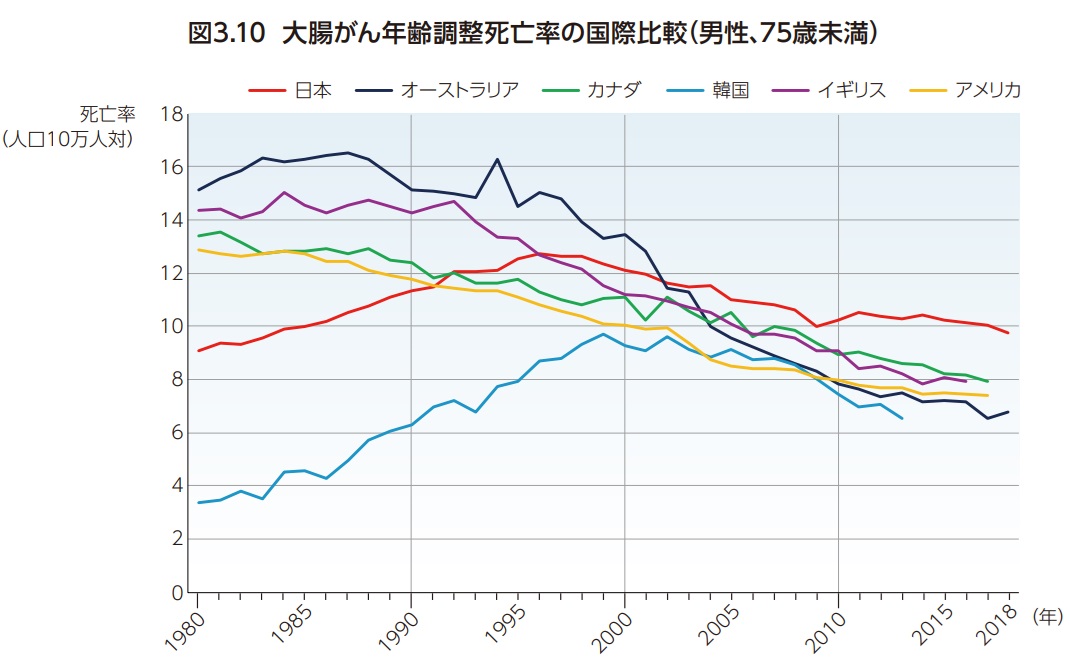
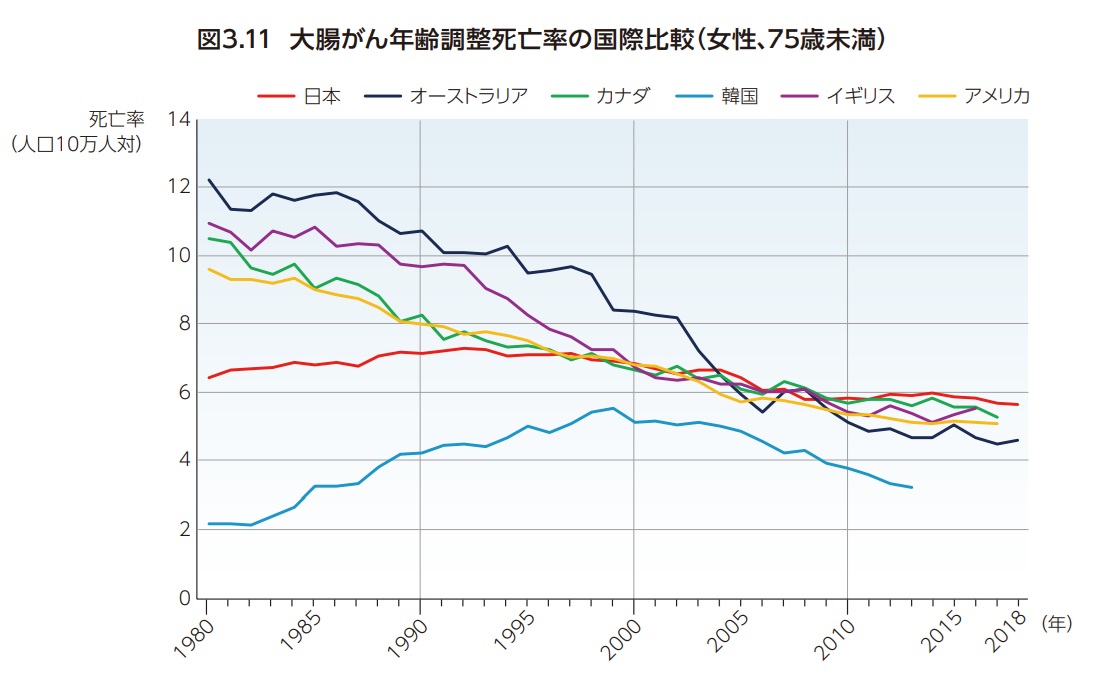
大腸がんは世界で3番目に多いがんであり、がん罹患全体の約10%を占め、がん全体の死亡の第2位となっている。大腸がんの罹患率および死亡率は、ヨーロッパ、ロシア、北米、オセアニアで高い傾向にあり、日本も年齢調整罹患率は36.6例(人口10万人あたり)、年齢調整死亡率は11.3人(人口10万人あたり)で国際的に見ても高い水準である8)(図3.8、図3.9)。罹患率、死亡率とも、日本は世界的に見ると高いのが現状である。大腸がん死亡率の経年変化の国際比較をみると、日本では1980年代はアメリカなどと比べて死亡率が低かったものの上昇傾向で1990年代には諸外国と同じ水準に達し、その後男女とも減少しているが諸外国より減少が鈍いため、直近では最も高い水準となっている9,10)(図3.10、図3.11)。
2.4 大腸がんの将来推計
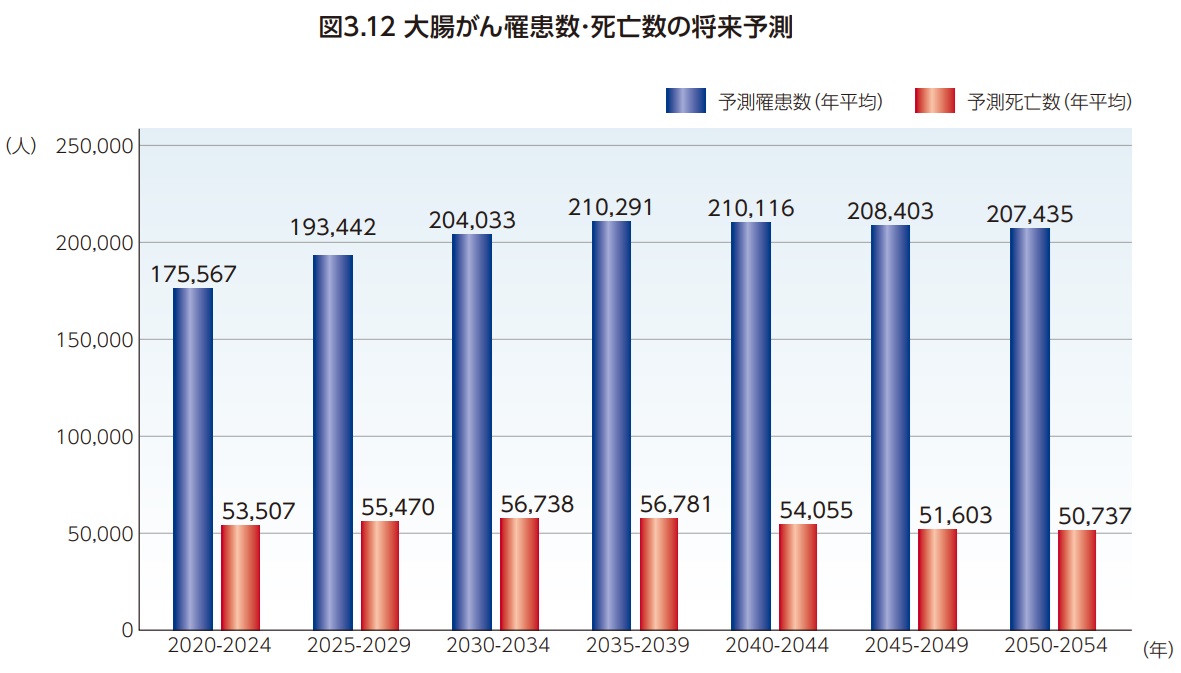
数理モデルを用いた将来推計によると大腸がんの罹患数・死亡数ともにさらなる増加が見込まれており、2035-2039年には年間の罹患数は約21万人(2019年の約1.35倍)、死亡数は約5.7万人(2022年の約1.08倍)に達すると予測されている11)(図3. 12)。さらに、2050年には大腸がんの有病者数(がんと診断されて生存している人)は672,976人(全がんでは3,690,023人)となり、有病者割合は全人口の0.67%(全がんでは3.69%)で、女性乳がん(1.14%)前立腺がん(1.03%)に次いで最も有病者割合の高いがんになると推計されている11,12)。
参考文献
- 国立がん研究センターがん情報サービス. 「がん統計(全国がん登録)」.
https://ganjoho.jp/reg_stat/statistics/data/dl/index.html#anchor2
(2024年4月4日アクセス) - 厚生労働省. 「全国がん登録」.
https://www.e-stat.go.jp/stat-search/files?page=1&toukei=00450173&tstat=000001133323
(2024年4月4日アクセス) - 国立がん研究センターがん情報サービス. 「がん統計(厚生労働省人口動態統計)」.
https://ganjoho.jp/reg_stat/statistics/data/dl/index.html#anchor1
(2024年4月4日アクセス) - 厚生労働省. 「人口動態統計」.
https://www.e-stat.go.jp/stat-search/database?page=1&toukei=00450011&tstat=000001028897
(2024年4月4日アクセス) - 国立がん研究センターがん情報サービス. 「最新がん統計」.
https://ganjoho.jp/reg_stat/statistics/stat/summary.html
(2024年4月4日アクセス) - 国立がん研究センターがん情報サービス. 「がん統計(全国がん罹患モニタリング集計(MCIJ))」.
https://ganjoho.jp/reg_stat/statistics/data/dl/index.html#anchor2
(2024年4月4日アクセス) - Katanoda K, Hori M, Saito E, et al. Updated Trends in Cancer in Japan:Incidence in 1985-2015 and Mortality in 1958-2018-A Sign of Decrease inCancer Incidence. J Epidemiol. 2021;31(4):426-450.
- World Health Organization. CANCER TODAY.
https://gco.iarc.who.int/today/en
(2024年4月4日アクセス) - World Health Organization. CANCER OVER TIME.
https://gco.iarc.fr/overtime/en
(2024年4月4日アクセス) - Katanoda K, Ito Y, Sobue T. International comparison of trends in cancermortality: Japan has fallen behind in screening-related cancers. Jpn J ClinOncol. 2021;51(11):1680-1686.
- 国立がん研究センターがん情報サービス. 「集計表ダウンロード(4.将来推計)」.
https://ganjoho.jp/reg_stat/statistics/data/dl/index.html#anchor4
(2024年12月6日アクセス) - Nguyen PT, Hori M, Matsuda T, Katanoda K. Cancer PrevalenceProjections in Japan and Decomposition Analysis of Changes in CancerBurden, 2020-2050: A Statistical Modeling Study. Cancer EpidemiolBiomarkers Prev. 2023;32(12):1756-1770.
第3章 大腸がんのリスク
3.1 生活習慣に関連する要因
① 喫 煙
喫煙はがんのリスクを増加させるが、大腸がんもその例外ではない。国際がん研究機関 (InternationalAgency for Research on Cancer, IARC)は、ヒトにおける十分な科学的証拠の裏づけをもって、喫煙は大腸がんの発がん性があると評価している1)。 また、米国の疾病予防管理センター(Centers for Disease Controland Prevention, CDC)は、公衆衛生総監報告書(areport of the Surgeon General)で、喫煙の健康影響を包括的に評価した報告書をまとめ、喫煙と大腸腺腫性ポリープおよび大腸がんとの因果関係を推測するのに十分な科学的証拠がある、と結論づけている2)。
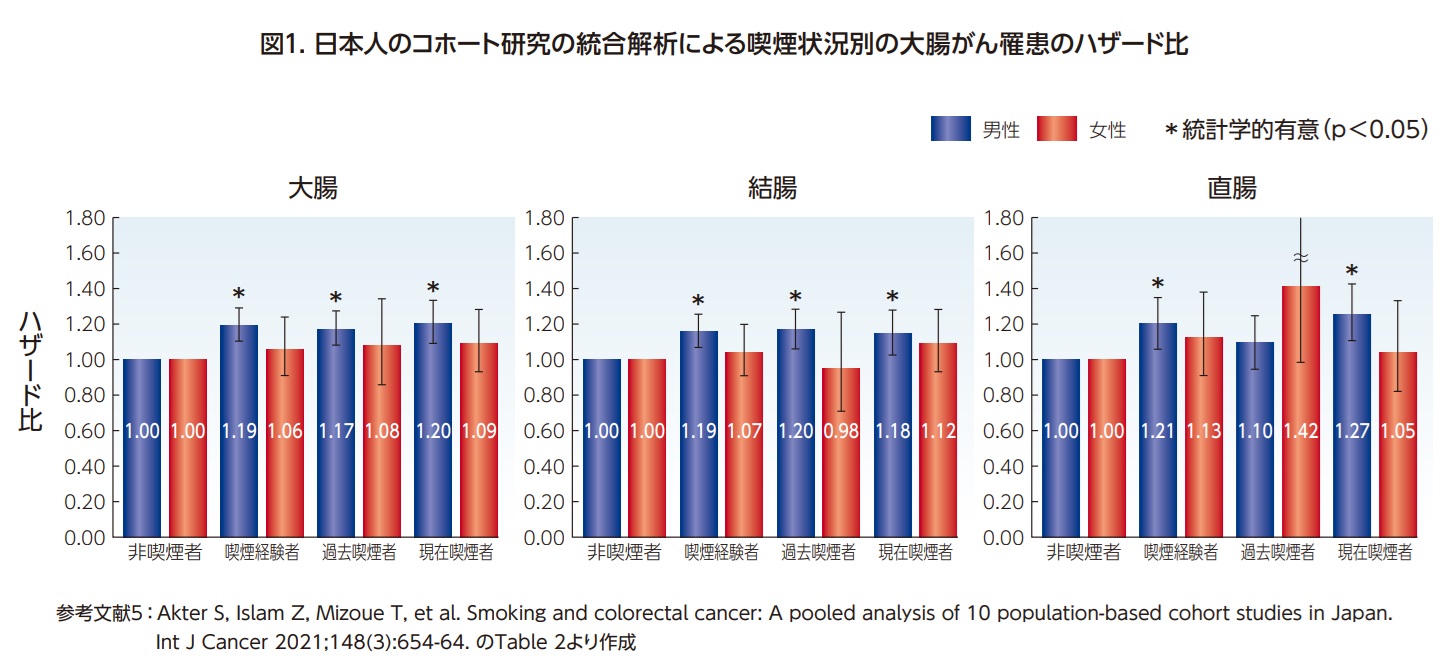
日本人については、厚生労働省の「喫煙と健康 喫煙の健康影響に関する検討会」で、喫煙と大腸がんのリスク増加との関連は、上から2番目の確からしさ(レベル2:科学的証拠は因果関係を示唆しているが十分ではない)であると判定されている3)。さらに、国立がん研究センターがん対策研究所の「科学的根拠に基づくがんリスク評価とがん予防ガイドライン提言に関する研究」(以下、研究班)では、がんのリスク・予防要因を「確実」、「ほぼ確実」、「可能性あり」、「データ不十分」の四段階で評価しており、喫煙により日本人における大腸がんのリスクが上がることは「確実」と評価している4-6) (図1)。
国際的にも、日本人においても、喫煙が大腸がんのリスクを高めることは確実である。11の前向き研究の結果を統合した国際的なメタ・アナリシスでは、1日あたり40本以上喫煙すると大腸がんの罹患リスクが40%近く増加すると報告されている7)。 また、10件の日本のコホート研究を統合した解析では、1日あたり20本以上喫煙すると男性で約20%、女性で約40%大腸がんの罹患リスクが増加するという結果であった5)。一方、受動喫煙に関しては、大腸がん罹患リスクとの関連についてまだ科学的証拠は不十分であるため結論づけられない4)。
② 飲 酒
飲酒も喫煙と同様、がんのリスクを高める生活習慣として知られている。IARCによる発がん性の評価において、飲酒による大腸がんの発がん性は十分な科学的証拠があるとされており、世界がん研究基金(World CancerResearch Fund (WCRF) International)によるリスク評価でも、飲酒は、口腔、咽頭や喉頭、食道、肝臓がんとともに、大腸がん罹患の要因となることが「確実」であるとされている8)。
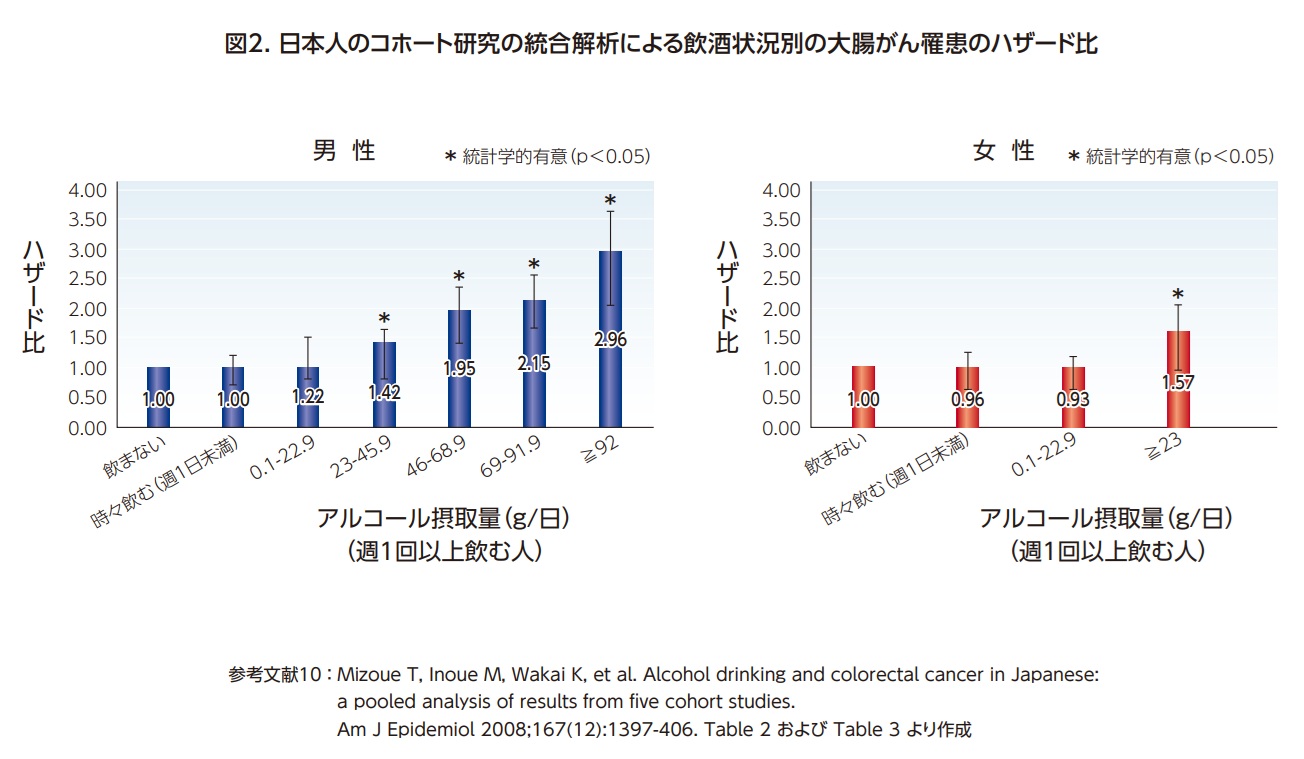
日本でも、厚生労働省の「健康に配慮した飲酒に関するガイドライン」において、飲酒によって大腸がんの罹患リスクが高まると報告されている9)。日本人を対象とした5つのコホート研究を統合した研究では、1日あたりのアルコールの摂取量が23~45.9g、46~68.9g、69~91.9gと増すにつれて、飲まない人と比べたときの大腸がんのリスクが男性でそれぞれ1.4、2.0、2.2倍に増加することが示され10)、研究班においても、日本人において飲酒は「確実」に大腸がんのリスクを上げる、と評価されている4)(図2)。このように、飲酒も大腸がんのリスクを高めることが確実である。アルコール摂取による大腸がんの発がん機序としては、アルコールの代謝で産生されるアセトアルデヒドや活性酸素に発がん性があることが示唆されている11)。
③ 体 格
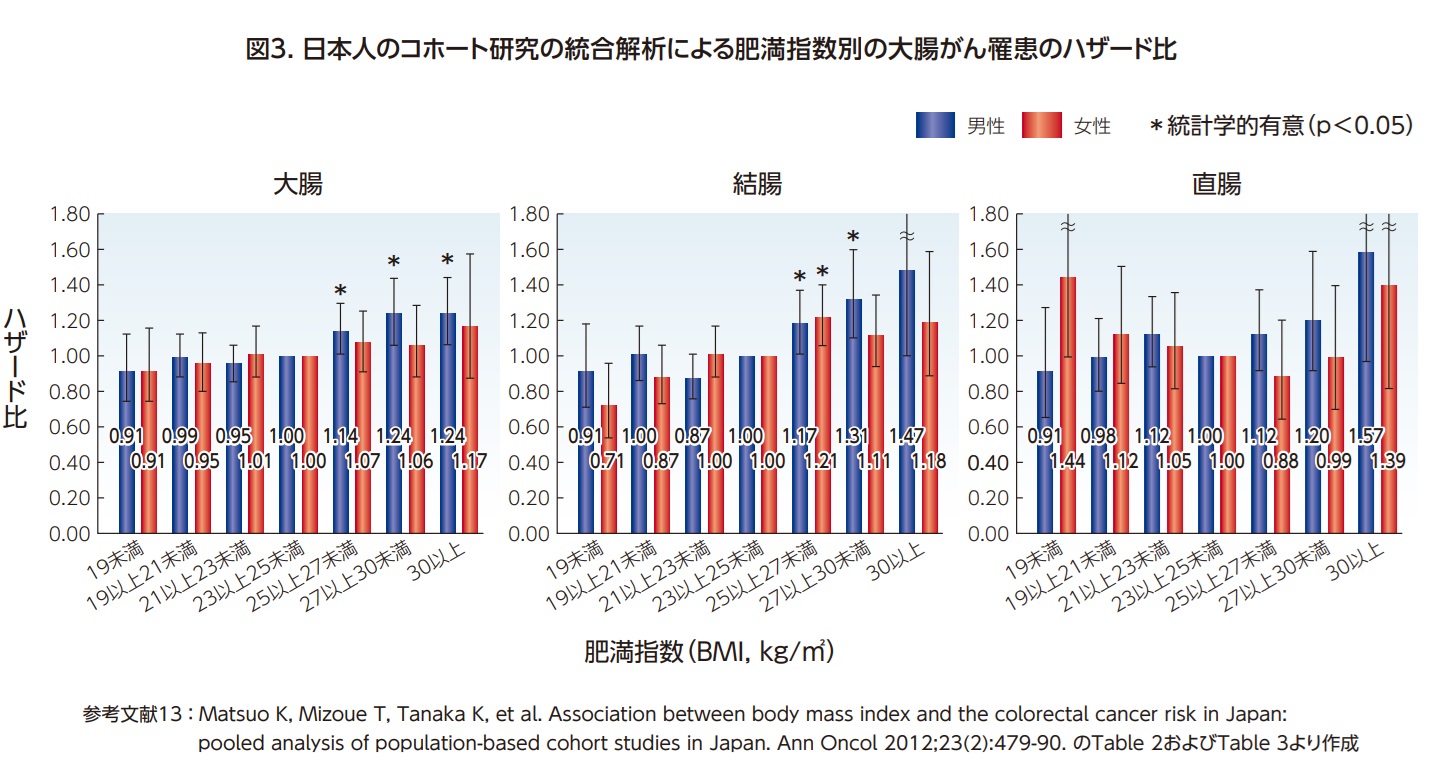
肥満も大腸がんのリスクを増加させることが、国際的にも、日本においても十分な科学的証拠をもって報告されている。WCRF Internationalは、成人期の肥満(体脂肪)は「確実」に大腸がん罹患の要因となるとし、体格指数(Body mass index, BMI)を18.5-24.9kg/㎡の範囲に保つことを推奨している12)。日本人は欧米諸国と比較して過体重・肥満の人は少ないが、日本の8つのコホート研究を統合した研究においても、BMIが上昇するにつれて大腸がんのリスクが増加し、特に男性において、BMIが25kg/㎡以上で顕著であった13)(図3)。研究班でも、日本人の肥満による大腸がん罹患のリスク増加は「ほぼ確実」である、としている4)。
BMI以外にも、ウエスト周囲径やウエストヒップ比でも同様に大腸がんとの正の関連が認められる。機序としては、体脂肪の増加によりインスリンが増加し、このインスリンが細胞の増殖を促しアポトーシスを抑制することで、発がんに関与しているのではないかと考えられている14,15)。さらに体脂肪により炎症反応を刺激することも大腸発がんの促進につながることが考えられる16,17))。
一方で、日本人の中高年においては、痩せによるがんのリスク増加も示唆されている。しかし大腸がんとの関連を検討した研究はまだ少なく、科学的証拠に乏しい。
また、成人期の高身長も大腸がんリスクを増加させるとされている18,19)。これは、身長をはじめとする、成長発達にかかわる要因(成長ホルモン、インスリン様成長因子、幼少期のエネルギー過剰摂取など)が、大腸がんのリスク増加を引き起こしていると考えられる。また、身長が高い人は、細胞数が多く腸が長いため、がんの発生につながる突然変異の機会が多い可能性や、発がん性のある物質への曝露の可能性が高いことも考えられる。。
④ 食 事
喫煙や飲酒、肥満が大腸がんのリスク要因となる一方で、食事については、食品によってがんのリスクを増加させるものと低下させるものがある。
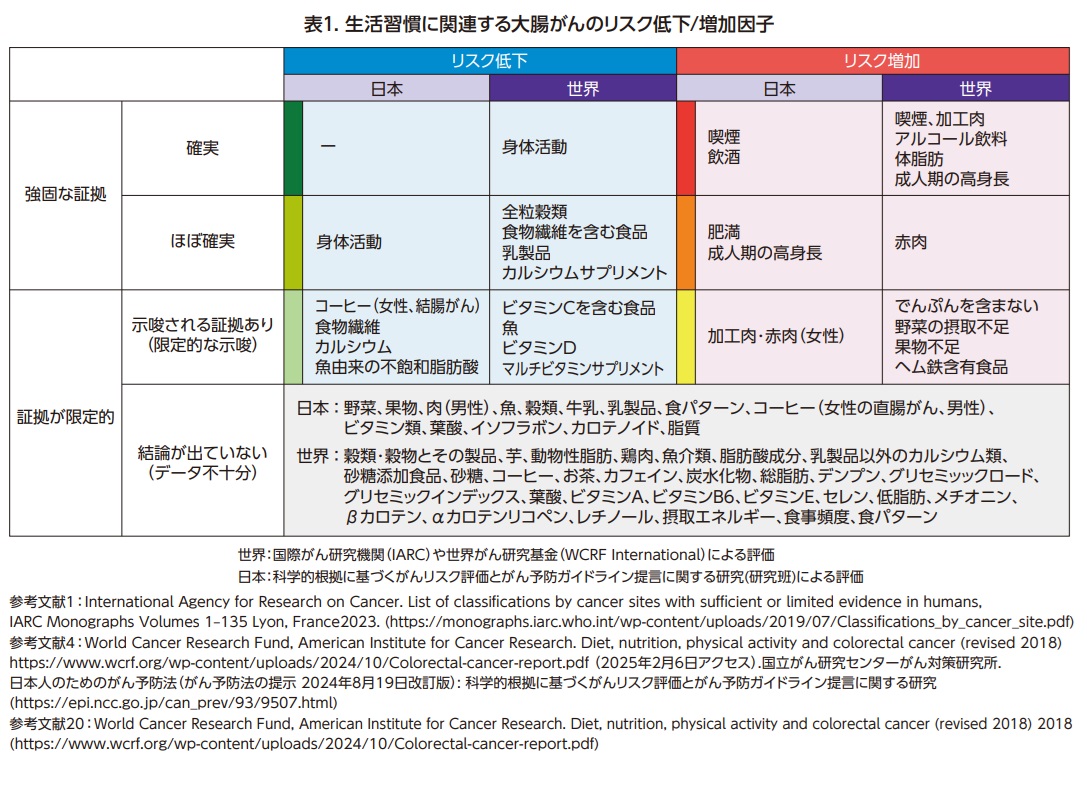
WCRF Internationalは、加工肉は大腸がんの「確実」なリスク要因となる食品であるとし、また、それに準じるレベルの「ほぼ確実」なリスク要因の食品として、赤肉(牛、豚、羊、馬、山羊)を挙げている20)。一方で、予防的な効果がある(大腸がんの罹患リスクを低下させる)食品もあり、全粒穀類、食物繊維を含む食品、乳製品、カルシウムサプリメントは「ほぼ確実」にリスクを下げると報告されている20)。その他、科学的証拠は限定的であるが、関連が示唆される食品として、デンプンの少ない野菜の摂取不足、果物不足、ヘム鉄含有食品多摂取によるリスク増加や、ビタミン C 含有食品多摂取、魚多摂取、ビタミンD多摂取、マルチビタミンサプリメント多摂取によるリスク低下が挙げられている20)。
日本人は体質や生活習慣が海外諸国と異なるため、食事についても、研究班において日本人に特化したがんのリスク評価がなされている。国際的な評価でリスク要因であるとされる加工肉・赤肉について、日本人を対象とした疫学研究結果の系統的レビューでは、赤肉と加工肉の摂取により大腸がんおよび結腸がんのリスクが上昇する可能性がある、と報告された21)。また、その後に行われた、日本人の6つのコホート研究を統合して解析した研究では、牛肉を多く食べる男性、牛肉、豚肉、加工肉を多く食べる女性で結腸がんのリスクが上昇していた22)。研究班では、特に女性で、加工肉・赤肉の過剰摂取による大腸がんのリスク増加の「可能性あり」と評価している4)。そのほか、コーヒー、食物繊維、カルシウム、魚由来の不飽和脂肪酸が、日本人において、大腸がんの予防効果の「可能性がある」食品として評価されている4,23-25)が、結論は得られていない。
⑤ 身体活動
身体活動について、大腸がんでは、特に結腸がんで「確実」にリスクを低下させると評価されている20)。日本人についても同様の評価がなされており、”中等度から強度の身体活動が、大腸(結腸)がんのリスクを下げることは「ほぼ確実」”であると研究班でも評価している4,26)。
身体活動が大腸発がんを予防する機序としては、体脂肪の減少とそれに伴うインスリン抵抗性や炎症の減少、消化が促進されることによる腸通過時間の短縮、などが想定されている27,28)。ただし、体重減少を伴わない身体活動が与えるインパクトは不明である。
3.2 その他の要因
その他の要因としては、クローン病や潰瘍性大腸炎などの炎症性腸疾患はリスクを増加させる一方、非ステロイド性抗炎症薬や閉経後のホルモン治療が大腸がんのリスクを低下させることが知られている29。さらに、閉経後のホルモン療法で、エストロゲン・黄体ホルモンの持続的併用投与によるリスク低下も報告されている30。また、X線・γ線の被ばく、アスベスト、職業として消防士や夜間シフト勤務、日本住血吸虫症の感染なども大腸がんのリスク要因であるとされている1)。
3.3 予防
リスク要因を避け、予防的行動をとるよう生活習慣を改善することで大腸がんの予防が可能である(表1)。具体的には、たばこを吸わない、飲酒をしない、適度な体重を保つ、運動する、である。実際、2015年の日本人の大腸がん罹患について、これらの行動を含む生活習慣の改善によって、結腸がんの約31%、直腸がんの約25%が予防可能だったと推計されている31)。
食事については、国際的には、赤肉・加工肉を食べすぎないこと、全粒穀類や食物繊維を含む食品、乳製品、カルシウムサプリメントを摂ること、が推奨されている20)。しかし、日本人にとって、どのような食事が大腸がんのリスクや予防効果があるのかはまだ可能性の域を出ておらず、日本人を対象とした科学的証拠の蓄積が必要である。
参考文献
- International Agency for Research on Cancer. List of classifications by cancer sites with sufficient or limited evidence in humans, IARC Monographs Volumes 1–135 Lyon, France2023 https://monographs.iarc.who.int/wp-content/uploads/2019/07/Classificat ions_by_cancer_site.pdf (2024年3月14日アクセス)
- National Center for Chronic Disease Prevention and Health Promotion (US) Office on Smoking and Health. The Health Consequences of Smoking—50 Years of Progress: A Report of the Surgeon General. Chapter 6, Cancer. Atlanta (GA): Centers for Disease Control and Prevention (US) 2014.
- 厚生労働省. 「喫煙と健康 喫煙の健康影響に関する検討会報告書について」.
https://www.mhlw.go.jp/stf/shingi2/0000135586.html
(2024年3月12日アク セス) - 国立がん研究センターがん対策研究所. 「日本人のためのがん予防法(がん予防法の提示 2024年8月19日改訂版): 科学的根拠に基づくがんリスク評価とがん予防ガイドライン提言に関する研究」.
https://epi.ncc.go.jp/can_prev/93/9507.html
(2025年2月6日アクセス). - Akter S, Islam Z, Mizoue T, et al. Smoking and colorectal cancer: A pooled analysis of 10 population-based cohort studies in Japan. Int J Cancer 2021;148(3):654-664.
- Mizoue T, Inoue M, Tanaka K, et al. Evaluation of Cancer Prevention Strategies in Japan. Tobacco smoking and colorectal cancer risk: an evaluation based on a systematic review of epidemiologic evidence among the Japanese population. Jpn J Clin Oncol. 2006;36(9):582-597.
- Liang PS, Chen TY, Giovannucci E. Cigarette smoking and colorectal cancer incidence and mortality: systematic review and meta-analysis. Int J Cancer 2009;124(10):2406-2415.
- World Cancer Research Fund International. Limit alcohol consumption
https://www.wcrf.org/research-policy/evidence-for-our-recommendations/limit-alcohol-consumption/
(2024年3月16日アクセス). - 厚生労働省. 「健康に配慮した飲酒に関するガイドライン2024」.
https://www.mhlw.go.jp/content/12200000/001211974.pdf
(2024年3月16日アクセス). - Mizoue T, Inoue M, Wakai K, et al. Alcohol drinking and colorectal cancer in Japanese: a pooled analysis of results from five cohort studies. Am J Epidemiol 2008;167(12):1397-1406.
- Seitz HK, Becker P. Alcohol metabolism and cancer risk. Alcohol Res Health 2007;30(1):38-41, 44-7.
- World Cancer Research Fund International. Be a healthy weight
https://www.wcrf.org/research-policy/evidence-for-our-recommendations/be-a-healthy-weight/
(2024年3月17日アクセス). - Matsuo K, Mizoue T, Tanaka K, et al. Association between body mass index and the colorectal cancer risk in Japan: pooled analysis of population-based cohort studies in Japan. Ann Oncol 2012;23(2):479-490.
- Kaaks R, Lukanova A, Kurzer MS. Obesity, endogenous hormones, and endometrial cancer risk: a synthetic review. Cancer Epidemiol Biomarkers Prev 2002;11(12):1531-1543.
- Pollak M. Insulin and insulin-like growth factor signalling in neoplasia. Nat Rev Cancer 2008;8(12):915-928.
- Lauby-Secretan B, Scoccianti C, Loomis D, et al. Body Fatness and Cancer--Viewpoint of the IARC Working Group. N Engl J Med 2016;375 (8):794-798.
- Renehan AG, Zwahlen M, Egger M. Adiposity and cancer risk: new mechanistic insights from epidemiology. Nat Rev Cancer 2015;15 (8):484-498.
- World Cancer Research Fund International. Bowel cancer
https://www.wcrf.org/preventing-cancer/cancer-types/bowel-cancer/
2025年2月6日アクセス). - Manandhar Shrestha R, Mizoue T, Islam Z, et al. Adult Height and Risk of Colorectal Cancer: A Pooled Analysis of 10 Population-based Cohort Studies in Japan. J Epidemiol 2024;34(2):94-103.
- World Cancer Research Fund, American Institute for Cancer Research. Diet, nutrition, physical activity and colorectal cancer (revised 2018) 2018
https://www.wcrf.org/wp-content/uploads/2024/10/Colorectal-cancer-report.pdf
(2025年2月6日アクセス). - Pham NM, Mizoue T, Tanaka K, et al. Meat consumption and colorectal cancer risk: an evaluation based on a systematic review of epidemiologic evidence among the Japanese population. Jpn J Clin Oncol 2014;44 (7):641-650.
- Islam Z, Akter S, Kashino I, et al. Meat subtypes and colorectal cancer risk: A pooled analysis of 6 cohort studies in Japan. Cancer Sci 2019;110 (11):3603-3614.
- Akter S, Kashino I, Mizoue T, et al. Coffee drinking and colorectal cancer risk: an evaluation based on a systematic review and meta-analysis among the Japanese population. Jpn J Clin Oncol 2016;46(8):781-787.
- Kashino I, Akter S, Mizoue T, et al. Coffee drinking and colorectal cancer and its subsites: A pooled analysis of 8 cohort studies in Japan. Int J Cancer 2018;143(2):307-316.
- 国立がん研究センターがん対策研究所. 「エビデンスの評価: 科学的根拠に基づくがんリ スク評価とがん予防ガイドライン提言に関する研究」.
https://epi.ncc.go.jp/cgi-bin/cms/public/index.cgi/nccepi/can_prev/outcome/index
(2025年2月6日アクセス) - Pham NM, Mizoue T, Tanaka K, et al. Physical activity and colorectal cancer risk: an evaluation based on a systematic review of epidemiologic evidence among the Japanese population. Jpn J Clin Oncol 2012;42 (1):2-13.
- Friedenreich CM, Ryder-Burbidge C, McNeil J. Physical activity, obesity and sedentary behavior in cancer etiology: epidemiologic evidence and biologic mechanisms. Mol Oncol 2021;15(3):790-800.
- Slattery ML. Physical activity and colorectal cancer. Sports Med 2004;34 (4):239-252.
- Rothwell PM, Wilson M, Elwin CE, et al. Long-term effect of aspirin on colorectal cancer incidence and mortality: 20-year follow-up of five randomised trials. Lancet 2010;376(9754):1741-1750.
- Johnson JR, Lacey JV, Jr., Lazovich D, et al. Menopausal hormone therapy and risk of colorectal cancer. Cancer Epidemiol Biomarkers Prev 2009;18 (1):196-203.
- Inoue M, Hirabayashi M, Abe SK, et al. Burden of cancer attributable to modifiable factors in Japan in 2015. Glob Health Med 2022;4(1):26-36.
第4章 大腸がん検診
4.1 大腸がん検診の有効性評価
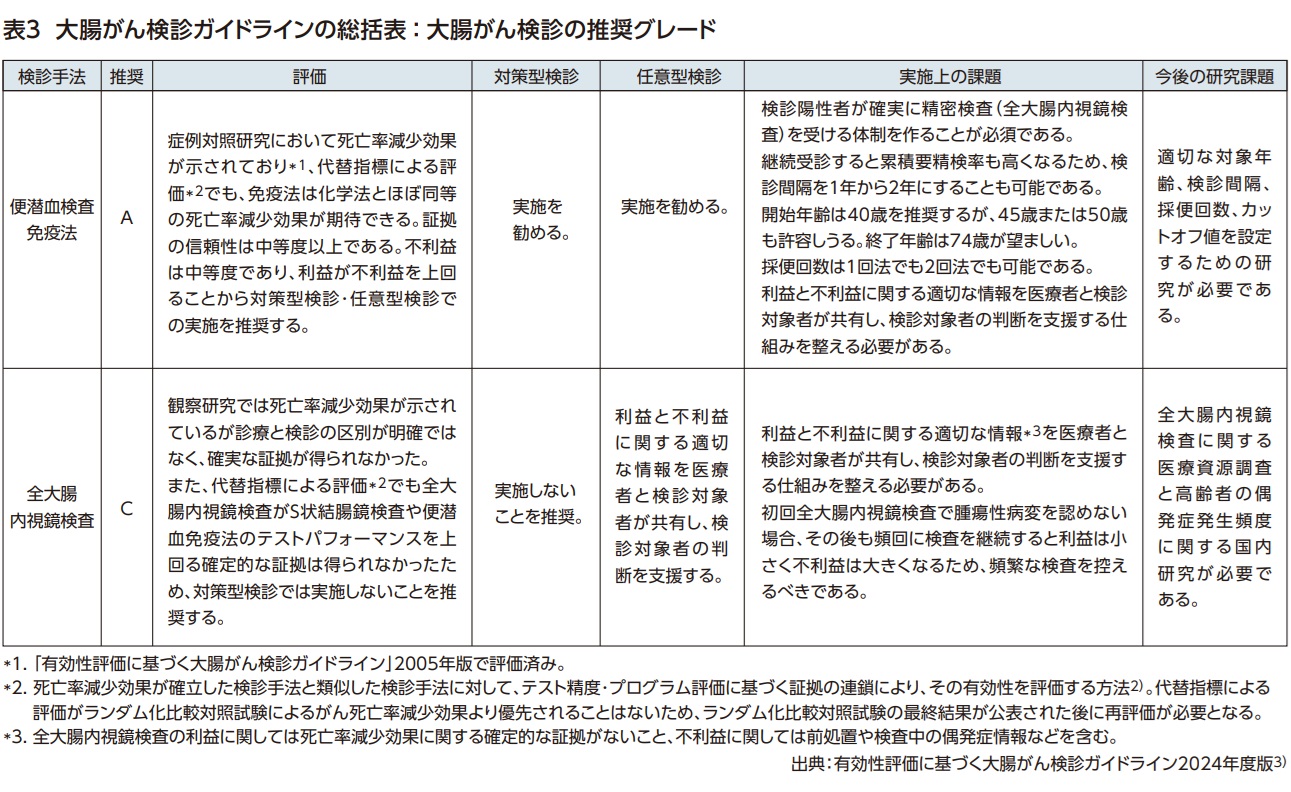
国内における大腸がん検診は1992年に導入され1)、40歳以上を対象に年1回便潜血検査免疫法2日法(正式名称は”免疫便潜血検査”であるが、ここでは広く一般に使用されている”便潜血検査免疫法”を用いた)が用いられている2)。「有効性評価に基づく大腸がん検診ガイドライン2024年度版」では3)、現在国内で実行可能性があり臨床的な評価が求められている便潜血検査免疫法と全大腸内視鏡検査を評価対象とした。
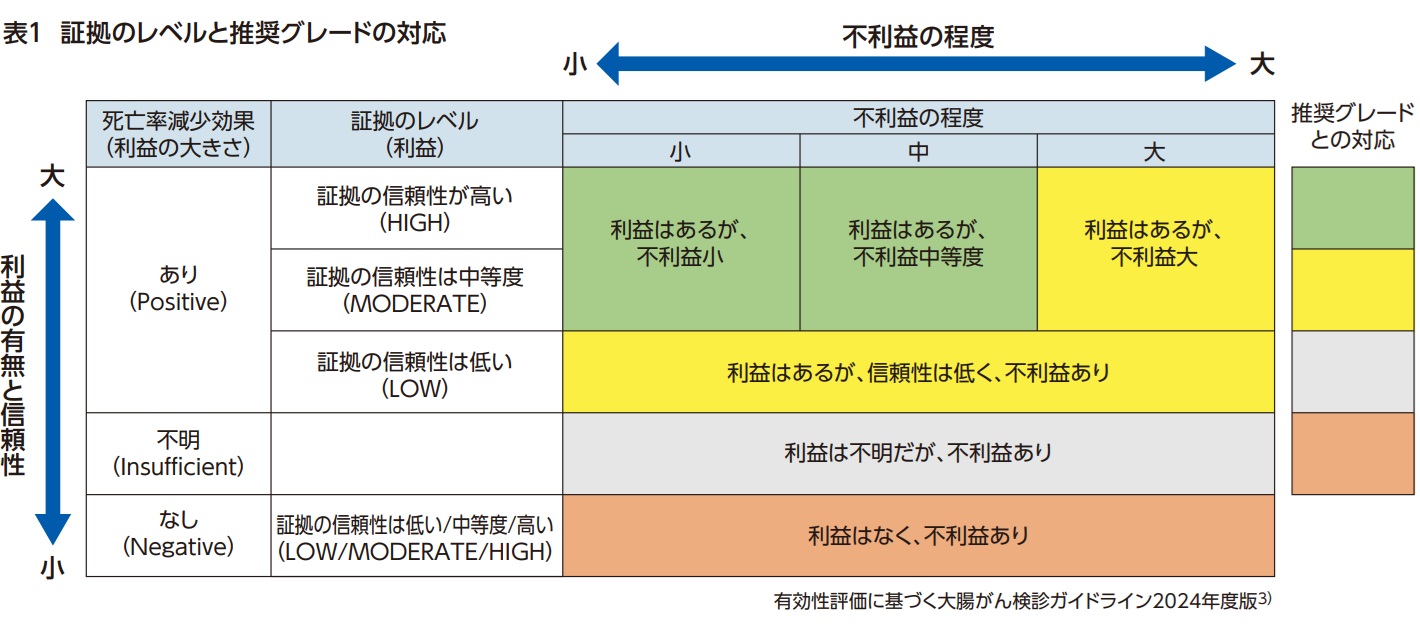
免疫法はこれまでランダム化比較対照試験(RCT)が実施されておらず、全大腸内視鏡はRCTが進行中で最終結果が示されていない3)。このため有効性の評価にあたっては、1)免疫法と全大腸内視鏡の観察研究によって死亡率減少効果を評価した後、 2 ) WEO ( W o r l dEndoscopic Organization)が提唱する代替指標評価4)(注1)を追加で実施した。ガイドライン作成委員会において、文献レビューを基に利益(死亡率減少効果)と証拠のレベル(信頼性)、不利益の程度(Number Needed toScope, NNS: 大腸がん1例を発見するために必要な大腸内視鏡件数や過剰診断、精密検査による偶発症など)が検討され、利益と不利益を対比して推奨グレードが決定された3)。
注1: WEOの代替指標評価
新しい検診手法の導入を評価するにあたっての段階的な評価方法。新しい検診手法に対してRCTで死亡率減少効果が証明されかつ生物学的に類似した参照基準となる検診手法が確立している場合のみ実施可能という厳格な前提をおいている。段階的に感度・特異度、検診参加率、がん発見率、中間期がん発見率を既存の参照基準となる検診手法と比較し統合して評価を行う4)。免疫法の参照基準は化学法、全大腸内視鏡の参照基準はS状結腸鏡を用いて実施した。代替指標評価は複数の研究を各段階の結果として積み重ね、統合した結果に基づく評価であるため、RCTによる証拠の信頼性を上回ることはないことを留意すべきである。
① 便潜血検査免疫法の推奨グレード
免疫法の観察研究による評価は「有効性評価に基づく大腸がん検診ガイドライン2005年版」で実施されているため省略し5)、WEOの代替指標評価を追加で検討した。免疫法は感度・特異度だけでなく参加率、発見率、中間期がん発生率も化学法より有意に優れており、免疫法の証拠の信頼性は中等度と評価した。一方、不利益の指標として化学法と免疫法のNNSはほぼ同等であった。利益と不利益を対比すると、「利益はあるが不利益は中等度」(表1)であり、推奨グレードAと判定された(表2)。免疫法は対策型検診・任意型検診として実施が推奨される(表3)。なお、検診対象は40-74歳を推奨するが、45歳または50歳開始も許容しうる。検診間隔を1年から2年にすることも可能である。
② 全大腸内視鏡検査の推奨グレード
北欧4か国では全大腸内視鏡1回実施群と通常診療群(無検診)の大腸がん死亡率を比較するRCTが実施されている(NordICC研究)。追跡期間10年の中間報告ではITT(Intention-to-treat)解析(注2)において統計学的に有意な大腸がん死亡率減少効果は示されなかった。その原因として介入群の応諾率が42%と低かったことが影響した可能性が挙げられていた6)。
RCTの次に評価された観察研究ではほぼ一貫して有意な死亡率減少効果が示されていた。しかし、観察研究は様々なバイアスの影響を受けやすい上に、特に全大腸内視鏡の観察研究には診療と検診の区別が明確でないという重大な問題があり、証拠の信頼性は低い。そこで、観察研究による評価を補うためにS状結腸鏡を参照基準とした代替指標評価4)が実施された。近位病変の検出増加と中間期がんが少ない点では全大腸内視鏡の優位性が示されたが、検診参加率が有意に劣るため、ITT解析による大腸がん検出率はS状結腸鏡を上回らなかった。観察研究と代替指標による評価をもとに全大腸内視鏡は「死亡率減少効果はあるが、証拠の信頼性が低い」と判断された。さらに、プログラム全体で実施される内視鏡検査件数が多くなるため、免疫法やS状結腸鏡による検診プログラムよりも全大腸内視鏡のNNSは大きく、不利益が大きい。この結果をもとに実施された利益と不利益の対比では「利益はあるが、証拠の信頼性は低く、不利益あり」となり、推奨グレードCと判定された(表2)。即ち、対策型検診としての実施は勧められない(表3)。
今回の評価はあくまで大腸がん検診のスクリーニング検査としての評価であり、大腸がん診断における全大腸内視鏡の性能を評価したものではない。全大腸内視鏡は大腸がん診断において最も精度が高い必須の検査であり、他の検査で代用できるものではない。また、前がん病変である腺腫の予防的切除ができるという大きな利点もある。
しかし、検診のスクリーニング検査として評価を行う場合、侵襲性の問題から便潜血検査に比べて対象者の受診率が低くなり、ITT解析で有意な死亡率減少効果を示しにくいと考えられる。将来的には進行中のRCTの最終報告が公開された後、全大腸内視鏡の再評価が予定されている。その間にがん検診目的の全大腸内視鏡による偶発症全国調査や医療資源調査が期待される。
注2:Intention-to-treat解析(ITT解析)とper-protocol解析(PP解析)
RCTでは無作為化して割付けられた介入群と対照群の間で交絡因子は均等である。この状態で解析を行うのが、ITT解析である。臨床試験の場合は介入群に割付られた患者のほとんどが治療を受けるが、検診研究の場合、割付日と検診実施日の間にタイムラグが生じ、割付けられても検診を受けない人が多く発生する場合がある。特に全大腸内視鏡検査のように前処置を要する検査では、検査を受けない人が多いため、ITT解析では効果を過小評価する傾向にある。一方、検査を受けた人だけで比較を行うPP解析では、介入群と対照群の交絡因子の均等性が欠如してしまっていることから研究の質は低下する。
4.2 大腸がん検診プログラムと精度管理
① 検診プログラムの種類~対策型検診と組織型検診
がん検診は本来1国1プログラムで行われるべきものであるが、日本では対策型検診として市区町村が実施主体となる住民検診、健康保険組合や事業主が実施主体となる職域検診、任意型検診として人間ドックがある7)。対策型検診とは集団全体の死亡率減少を目的として実施するものを指し、公共的な予防対策として行われる。対策型検診の理想型が組織型検診であり、英国や北欧諸国などで実施されている。Hakamaらは組織型検診の基本条件として、
① 対象集団の明確化
② 対象となる個人が特定されている
③ 高い受診率を確保できる体制
④ 精度管理体制の整備
⑤ 診断・治療体制の整備
⑥ 検診受診者のモニタリング
⑦ 評価体制の確立
を挙げ8)、精度管理の重要性を示している。
② がん検診の精度管理
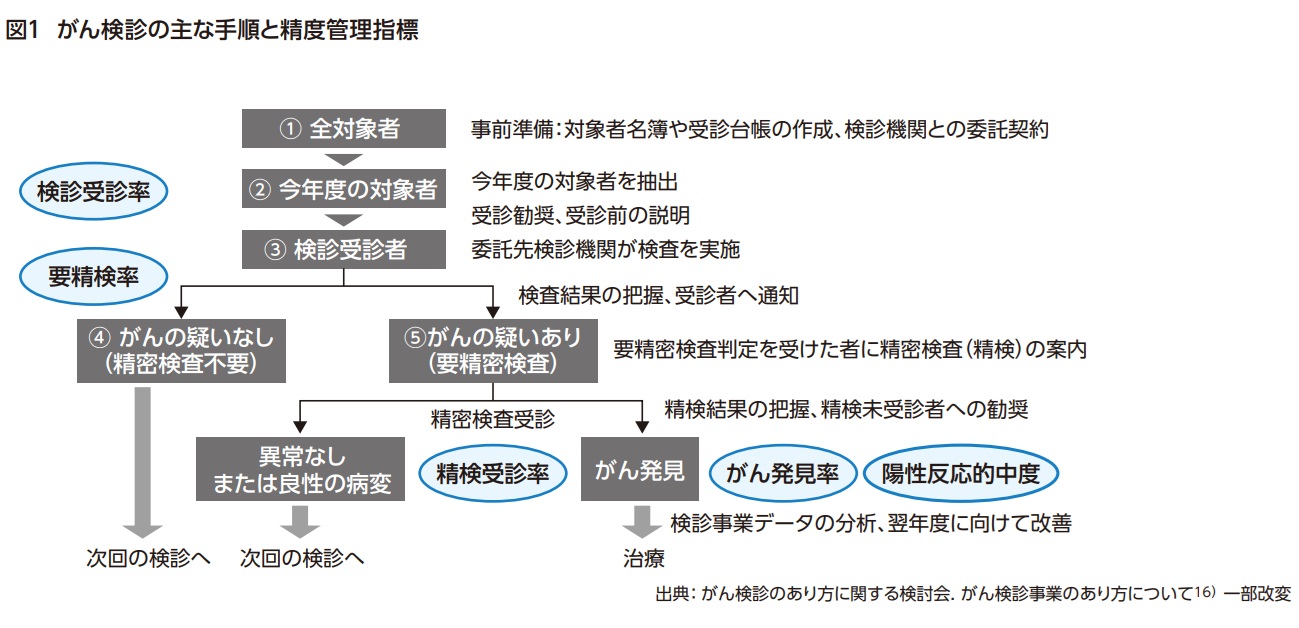
がん検診の精度管理とは検診が正しく行われているか評価し、不備な点を改善することである9)。がん検診には事前準備から検診終了後のデータ分析までの一連のプロセス(図1) があり1)、検診の質を測る精度管理指標として検診受診率、要精検率、精検受診率、がん発見率、陽性反応的中度が用いられている9)。これらのデータを分析し改善に向けた取組みを行うまでががん検診の手順となる。
③ 日英の大腸がん検診プログラムと大腸がん罹患率・死亡率の推移の比較
ここではすでに組織型検診を実施している英国と日本のがん検診実施体制を比較し、大腸がん罹患率・死亡率の推移を検討する。
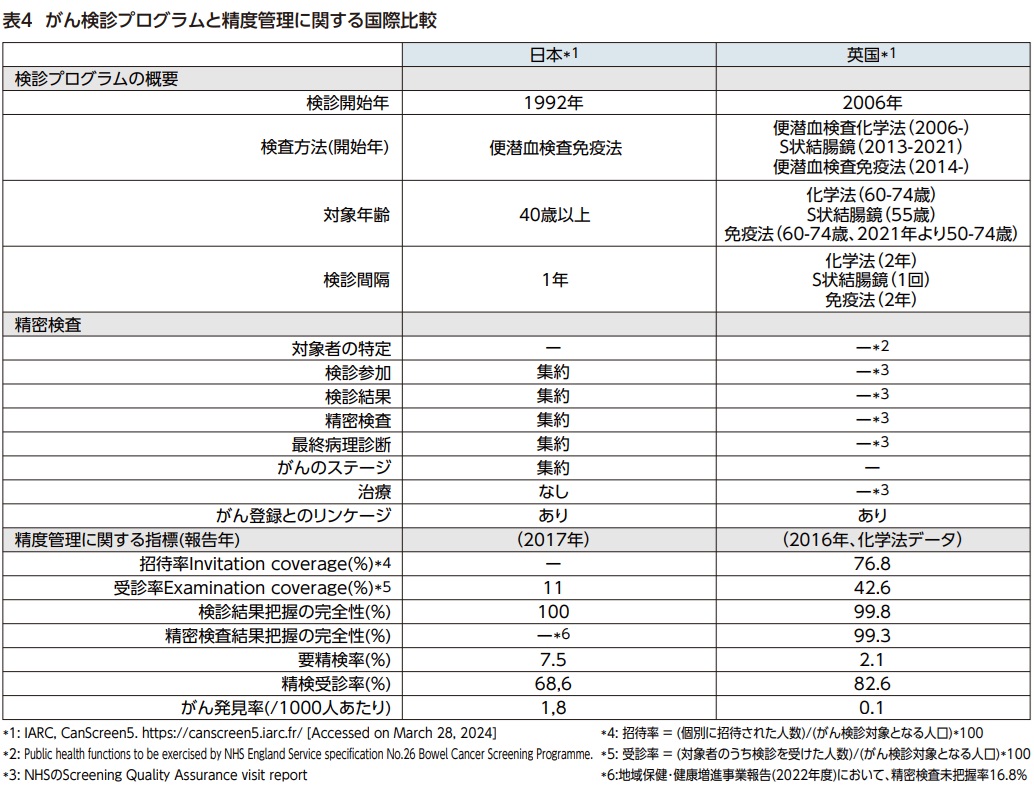
表4では、国際がん研究機関(IARC)の「5大陸のがん検診(CanScreen5)」10)を参照し、両国の大腸がん検診プログラムと精度管理に関する情報を示した。
日本の検診開始年は1992年と早く、当初より便潜血検査免疫法を用いていた。一方、英国では便潜血検査化学法のRCTで有意な死亡率減少効果が示された後、国内でパイロット研究を行った上で化学法の導入を決定した11)。免疫法もパイロット研究を行った上で12)切り替えを進めた。検診対象年齢は日本では40歳以上、英国では50-74歳である。また、検診間隔は日本が1年毎に対して英国では2年毎である。
精度管理に関しては、英国では検診間隔に基づいて検診対象者が特定され検診への招待ハガキが郵送され、招待率が算出できるのに対して、日本では検診対象者が完全に特定されているわけではなく招待ハガキを郵送しているのは一部にすぎない。検診受診率は、日本が11%に対して英国は42.6%と大きな差がある。精検受診率は日本が68.6%、英国82.6%である。日本の精密検査未把握率は16.8%であるが13)、英国の精密検査結果把握の完全性はほぼ100%である。このように、日本では早くから公的な大腸がん検診プログラムが実施されているが、精度管理に関する課題が多い。
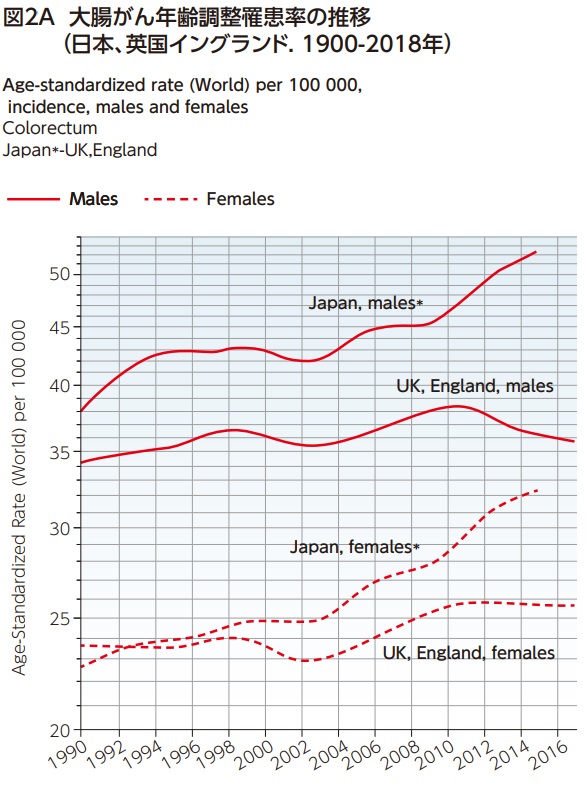
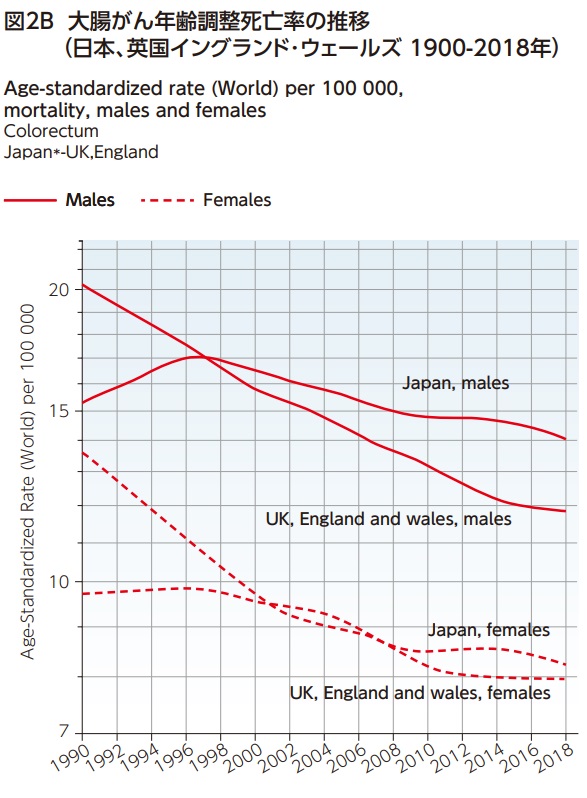
図2A/2Bにおいて、1990-2018年までの日本と英国(イングランドとウェールズ)の大腸がん年齢調整罹患率と年齢調整死亡率の推移を男女別に比較した14)。日本男性の大腸がん罹患率は1995年以降横ばいが続いていたが、2004年頃より増加傾向である。英国では2010年頃まで罹患率が増加した後に減少に転じている。日本人女性の大腸がん罹患率は一貫して増加傾向であるのに対して、英国では2012年頃より減少に転じている(図2A)。また、日本人男性の大腸がん死亡率は1996年をピークに減少に転じた。英国人男性はがん検診開始前より一貫して死亡率減少傾向である。1996年には日本が英国の死亡率を上回り、近年は死亡率の差が拡大している。女性の死亡率の推移も男性と類似しており、日本人女性の大腸がん死亡率減少は緩やかで、2001年には英国人女性を上回った。英国女性の大腸がん死亡率は検診開始後2007年と2008年に日本を上回ったが、その後は日本人女性の大腸がん死亡率を下回っている(図2B)。
組織型検診を実施している英国では検診開始後に一時的な大腸がん罹患率が増加したが、大腸がん死亡率は一貫して低下している。罹患率や死亡率の推移にはがん検診やがん登録などのがん対策と医療システムや治療方針の違いが大きく影響するため、両国の大腸がん罹患率や死亡率の推移がすべてがん検診の影響であるとは言えない。しかし、日本では早くから検診プログラムを導入しているにもかかわらず、検診受診率や精検受診率が低いため、がん検診の死亡率減少効果が十分現れてない可能性がある。
4.3 職域における大腸がん検診の現状と課題
職域検診は保険者や事業主が実施主体となり被用者とその家族を対象として実施されている。令和4年度国民生活基礎調査によると大腸がん検診を受けた者の49.7%が「勤め先等」で受診しており15)、職域検診は日本のがん対策において重要な役割を担っている。しかし、職域検診には明確な法的根拠はなく、福利厚生の一環と考えられていることも多いため、有効性評価が定まっていない検査法が使用されていたり、精度管理上の課題もある16)。ここでは、職域における大腸がん検診の現状と課題を明らかにする。
① 職域検診で実施されている大腸がん検診プログラム
平成30年に厚生労働省は「職域におけるがん検診に関するマニュアル」17)を公開し、職域検診における各がん検診の運用方法をまとめた。大腸がん検診の検査項目は問診と便潜血検査、対象年齢は40歳以上、受診間隔は原則として1年に1回とされているが、職域検診における大腸がん検診の実施状況については以下の2つの報告がある。
厚生労働省の「被用者保険におけるがん検診の実施状況について」によると令和3年度に全被用者保険者(健康保健組合・共済組合・全国健康保健協会)の97.9%が便潜血検査、14.9%が全大腸内視鏡検査、3.5%がS状結腸鏡検査を実施していた。検診対象年齢や検診間隔は報告されていなかった(有効回答率96.3-100%)18)。また、東京都に所在地がある事業所及び本部を有する 健康保険組合を対象に実施された東京都がん予防・検診等実態調査報告書(令和4年度)の事業所調査によると、便潜血検査は93.6%、全大腸内視鏡は3.8%の事業所で実施されていた。また、対象年齢は「40歳以上」が38.4%、その他には年齢設定なし(全年齢)と35歳以上が多く挙げられていた。また、受診機会は「毎年」が97.9%であった(有効回収率20.5%)19)。
職域検診において、最も多く実施されている検査法は便潜血検査であるが、全大腸内視鏡も一定数導入されている。また、40歳未満に便潜血検査が実施されている事例もあり、科学的根拠に基づく大腸がんガイドライン05)において推奨されなかった検査法や運用が行われている。なお、被保険者と比べて被扶養者は検診の受診機会が少なく18)、被保険者であっても正社員と正社員以外では受診機会に大きな差があることも19)留意しておく必要がある。
② 職域検診における精度管理の実施状況
「職域におけるがん検診に関するマニュアル」17)では、保険者・事業主ががん検診の精度管理を行う際に同マニュアル内の「精度管理のためのチェックリスト」等によりがん検診受診率、要精検率、精検受診率、がん発見率等のがん検診の精度管理指標に基づく評価を行うことが望ましいと記載されている。しかし、職域検診における保険者と事業主の精度管理上の役割分担や連携方法が示されておらず、チェックリストが殆ど活用されていない16)。また、がん検診の結果情報は個人情報保護法の要配慮個人情報に該当するため、保険者や事業主には情報取得にあたっての同意や適切な取扱いが求められる20)。そのため、精検受診率を継続的に把握している保険者・事業主は少数に留まっている。
職域検診における検診受診率や精検受診率については以下の2つの報告がある。前述した「被用者保険におけるがん検診の実施状況について」によると令和3年度大腸がん検診受診率は被保険者72.4%、被扶養者58.0%であった。
また、全被用者保険者のうち要精密検査対象者を把握していたのは31.6%、そのうちで受診勧奨したのは75.8%(全体では24.1%)、さらに精密検査結果を把握したのは84.7%(全体では20.4%)に過ぎなかった18)。また、厚生労働省が健康保険組合対象に実施した「がん検診に関する実施状況等調査結果概要」(有効回答率88.1%) によると、平成26年度の大腸がん検診受診率は被用者60.8%・被扶養者30.5%と報告されている。精検受診率は被用者45.2%・被扶養者56.6%とあり21)、住民検診における精検受診率よりも低い (表1参照)。
職域検診の精度管理の改善には、関係者との協議のうえ、具体的な運用方法(モニタリングおよび評価・改善・指導)を構築する必要がある。また、精度管理にかかるインセンティブや、労働者の健康情報等の取扱い等に関する法的な支援も重要であろう。
有効性が確立した検診を正しく実施し、多くの人が受診した場合にのみがん死亡率が減少すること、検診にはがん死亡や治療のための離職・長期休職を防ぐという点で事業主にとっても大きな意義があることを職域検診に関わるすべての人々に広めていくことが重要である。
参考文献
- Saito H. Colorectal cancer screening using immunochemical faecal occult blood testing in Japan. J Med Screen. 2006:13 Suppl 1:S6-7.
- 厚生労働省. 「がん予防重点健康教育及びがん検診実施のための指針」.
https://www.mhlw.go.jp/content/10900000/001266917.pdf
(2025年1月26日アクセス) - 国立がん研究センターがん対策研究所. 「有効性評価に基づく大腸がん検診ガイドライン2024年度版」.
https://canscreen.ncc.go.jp/guideline/colon_guideline2024.pdf
(2025年1月26日アクセス) - Young GP, Senore C, Mandel JS, Allison JE, Atkin WS, Benamouzig R, Bossuyt PMM, De Silva M, Guittet L, Halloran SP, Haug U, Hoff G, Itzkowitz SH, Leja M, Levin B, Meijer GA, O’Morain CA, Parry S, Rabeneck L, Rozen P, Saito H, Schoen RE, Seaman HE, Steele RJC, Sung JJY, Winawer SJ (2016). Recommendations for a step-wise comparative approach to the evaluation of new screening tests for colorectal cancer. Cancer. 2016;122 (6):826-839.
- がん検診の適切な方法とその評価法の確立に関する研究班. 「有効性評価に基づく大腸がん検診ガイドライン2005年版」.
https://canscreen.ncc.go.jp/guideline/daicyougan.html
(2025年1月26日アクセス) - Bretthauer M, Løberg M, Wieszczy P, Kalager M, Emilsson L, Garborg K, Rupinski M, Dekker E, Spaander M, Bugajski M, Holme Ø, Zauber AG, Pilonis ND, Mroz A, Kuipers EJ, Shi J, Hernán MA, Adami HO, Regula J, Hoff G, Kaminski MF; NordICC Study Group. Bretthauer2022. Effect of Colonoscopy Screening on Risks of Colorectal Cancer and Related Death. N Engl J Med. 2022;387(17):1547-1556.
- 国立がん研究センターがん情報サービス. 「がん検診ついて」.
https://ganjoho.jp/med_pro/cancer_control/screening/screening.html
(2025年1月26日アクセス) - Hakama M, Chamberlain J, Day NE, Miller AB, Prorok PC. Evaluation of screening programmes for gynaecological cancer. Br J Cancer. 1985;52 (4):669-673.
- 国立がん研究センターがん対策情報センター. 「自治体担当者のためのがん検診精度管理マニュアル」.
https://ganjoho.jp/med_pro/cancer_control/screening/pdf/canscrqa_manual2018_zentai.pdf
(2025年1月26日アクセス) - International Agency for Research on Cancer. CanScreen5.
https://canscreen5.iarc.fr
(2025年1月26日アクセス) - Rees CJ, Bevan R. The National Health Service Bowel Cancer Screening Program: the early years. Expert Rev Gastroenterol Hepatol. 2013;7 (5):421-437.
- Moss S, Mathews C, Day TJ, Smith S, Seaman HE, Snowball J, Halloran SP. Increased uptake and improved outcomes of bowel cancer screening with a faecal immunochemical test: results from a pilot study within the national screening programme in England. Gut. 2017;66(9):1631-1644.
- 厚生労働省. 「令和4年度地域保健・健康増進事業報告」.
https://www.mhlw.go.jp/toukei/saikin/hw/c-hoken/22/index.html
(2025年1月26日アクセス) - International Agency for Research on Cancer. Global Cancer Observatory Cancer Over Time.
https://gco.iarc.fr/en
(2025年1月26日アクセス) - 厚生労働省. 「令和4年度国民生活基礎調査」.
https://www.mhlw.go.jp/toukei/saikin/hw/k-tyosa/k-tyosa22/index.html
(2025年1月26日アクセス) - 厚生労働行政推進調査事業費補助金(がん対策推進総合研究事業)がん検診事業の評価に関する研究班. 「がん検診事業のあり方について」.
https://www.mhlw.go.jp/content/10901000/001046970.pdf
(2025年1月26日アクセス) - 厚生労働省. 「職域におけるがん検診に関するマニュアル」.
https://www.mhlw.go.jp/file/05-Shingikai-10901000-Kenkoukyoku-Soumuka/0000204422.pdf
(2025年1月26日アクセス) - 厚生労働省. 「被用者保険におけるがん検診の実施状況について」.
https://www.mhlw.go.jp/content/10901000/001046965.pdf
(2025年1月26日アクセス) - 東京都福祉保健局. 「令和4年度 東京都がん予防・検診等実態調査」.
https://www.hokeniryo.metro.tokyo.lg.jp/kensui/gan/toukei/pdf/2023/2022survey_whole.pdf
(2025年1月26日アクセス) - 泉 陽子, 菰口 高志, 立道 昌幸, 三柴 丈典. 職場におけるがん検診推進の背景と課題 法定外健康情報の取扱いの適正化へ向けた序論. 産業保健法学会誌. 2023; 2(2):21-32.
- 厚生労働省. 「がん検診に関する実施状況等調査結果概要」.
https://www.mhlw.go.jp/file/05-Shingikai-10901000-Kenkoukyoku-Soumuka/0000124098.pdf
(2025年1月26日アクセス)
第5章 大腸がんの治療
5.1 大腸がんに対する治療戦略の概要
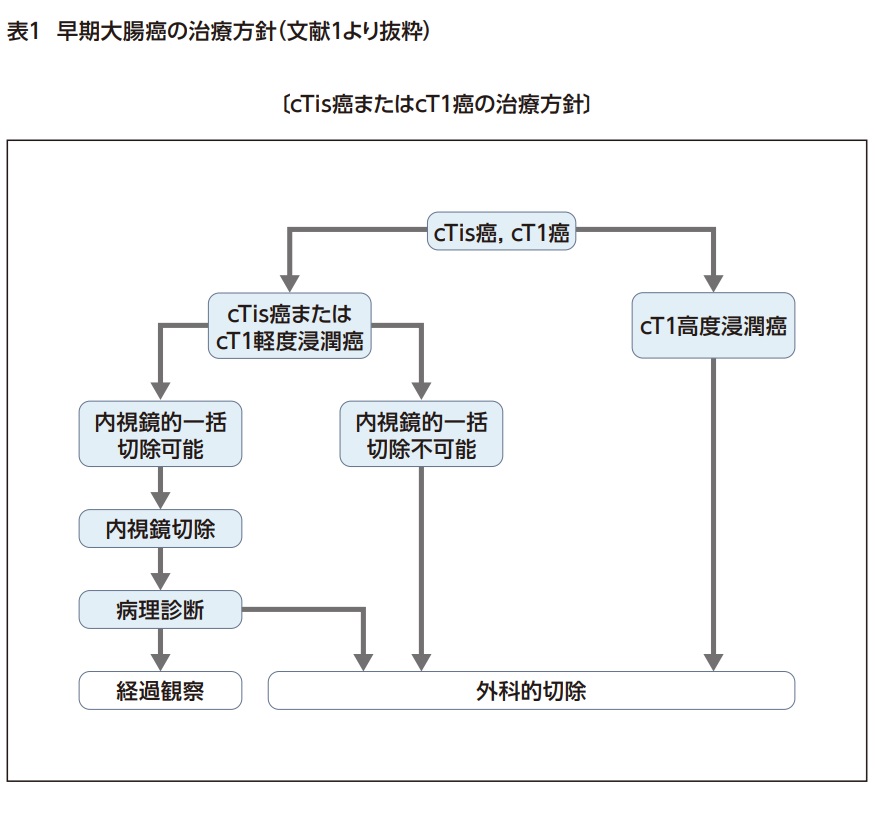
大腸癌を疑う病変を認めたら、内視鏡による深達度診断を行い、粘膜内癌もしくは粘膜下層への軽度浸潤癌であれば内視鏡的一括切除を行う。切除後の病理診断にて追加外科切除が必要であるかを判断する1)(表1)。必要に応じてCT、MRIなどの画像検査を行い、転移の有無を評価する。
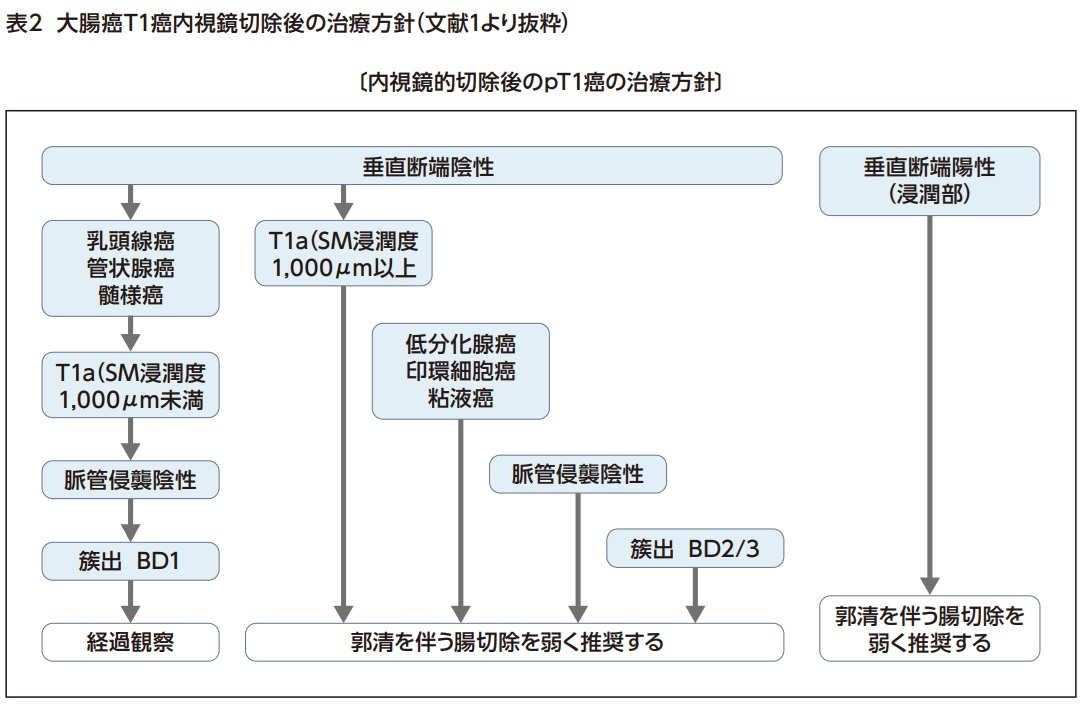
遺残のないよう完全(R0)切除され、病理結果が粘膜内癌(pTis癌)であれば転移再発のリスクはないが、粘膜下層浸潤癌(pT1癌)であった場合はリンパ節転移のリスクを伴うため、病理診断で①SM浸潤距離1000μm以上、②脈管侵襲陽性、③低分化腺癌・印環細胞癌・粘液癌、④浸潤先進部の簇出Grade2/3の因子のうち一つでも該当するようであればリンパ節郭清を伴う追加外科切除を弱く推奨するとされている(表2)。またT1癌で垂直断端が陽性であった場合には、外科切除を追加することが強く推奨されている1)。
内視鏡切除の適応とならないcStage 0-Ⅲ大腸癌は外科切除適応となるが、術前検査・術中所見によるリンパ節転移の有無と腫瘍の壁深達度からリンパ節郭清度を決定する1)。
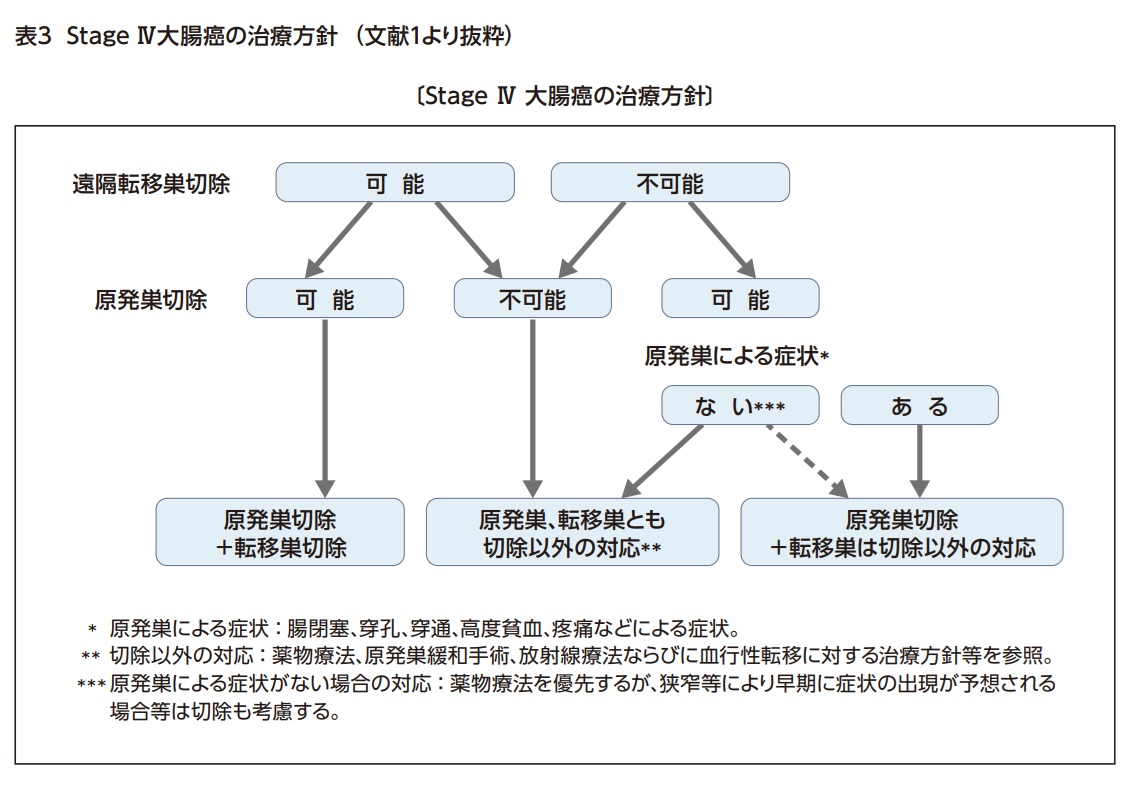
遠隔転移を伴うStage Ⅳ大腸癌は、原発巣および遠隔転移巣切除が可能であるか評価したうえで、治療方針を決定する1)(表3)。
5.2 大腸がんに対する内視鏡治療とサーベイランス
① 内視鏡治療の適応
内視鏡治療適応に大きさや肉眼型の制限はないが、深達度診断のためには画像強調観察、色素内視鏡観察、拡大内視鏡観察を用いた精密検査を行う2-4)。病理診断結果がその後の治療方針決定には必要であるため、一括切除可能な治療法を選択し、切除標本の正確な組織学的検索によって根治性と追加腸切除を検討する1)。
治療法には代表的なものとしてスネアポリペクトミー5)、内視鏡的粘膜切除術6)、内視鏡的粘膜下層剥離術7)などがあげられるが、予測深達度、腫瘍の大きさ、肉眼型を加味して適した治療法を選択する必要がある。
従来から主流であった内視鏡的粘膜切除術は、生理食塩水などで病変を挙上させた上でスネア(円形のワイヤ)で病変を絞扼して切除する方法で、安全かつ簡便な方法である反面、大きな病変を一括で切除することはできず、対象病変に制約があった。2012年より保険収載された内視鏡的粘膜下層剥離術はスネアではなく高周波ナイフを使用することにより、2cm以上の大型の早期大腸癌や2㎝以下でも線維化を伴う早期大腸癌など、従来であれば外科治療が行われていた病変に対しても内視鏡治療の実施を可能とした。この技術は国立がん研究センター中央病院を中心とした多施設共同前向き研究(CREATE-J)で有効性が証明され8)、5年生存率93.6%,疾患特異的5年生存率99.6%,5年腸管温存率88.6%と、良好な長期成績が示された。
② 内視鏡治療後サーベイランス
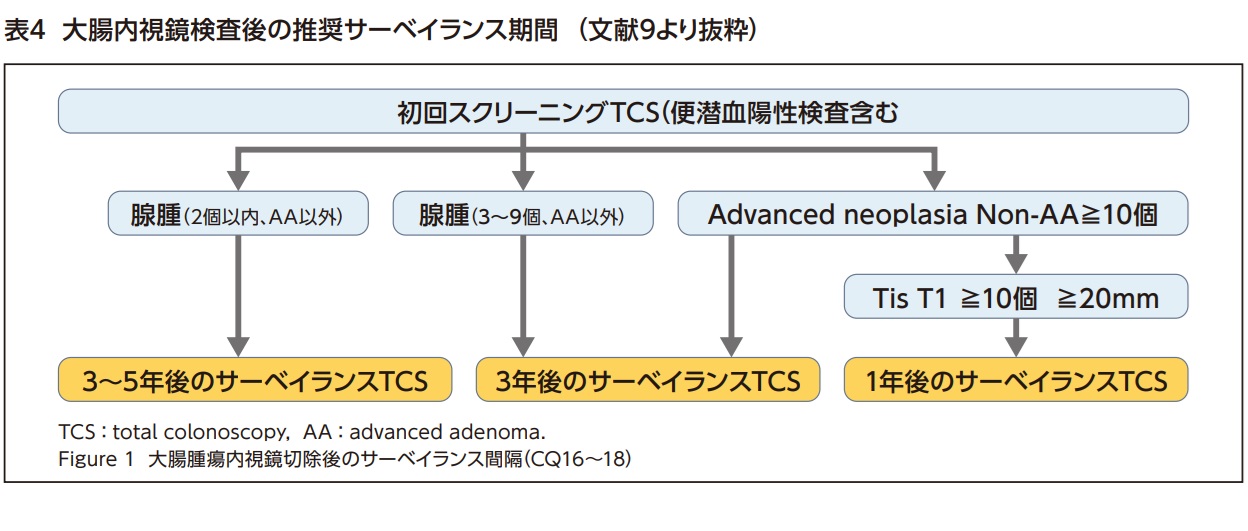
日本消化器内視鏡学会が2020年に作成した「大腸内視鏡スクリーニングとサーベイランスガイドライン」9)では、初回スクリーニング大腸内視鏡検査で切除された病変の個数や病理診断結果によりリスク層別化し、その後のサーベイランス期間を推奨している9,10)(表4)。
pTis癌治療後の場合、R0切除されていれば再発リスクはないが、分割切除、水平断端陽性の場合には、6か月後前後に大腸内視鏡検査で局所再発の有無を調べることが推奨されており、内視鏡治療されたpT1癌に対しては、サーベイランスとして腫瘍マーカー測定、胸腹部CT、大腸内視鏡検査を行う必要がある1)。リンパ節再発や遠隔転移再発のリスクがあるため、最低3年間、可能であれば5年間の慎重な経過観察が必要とされている11)。
5.3 大腸がんに対する外科治療とサーベイランス
① 外科治療
遠隔転移を伴わない根治切除可能なStage 0-Ⅲ大腸癌(内視鏡切除可能例を除く)の標準治療は外科切除であり、根治切除の原則は、原発巣を含む十分な腸管切除と、原発巣を栄養する血管によって規定される所属リンパ節の系統的郭清である。遠隔転移を伴うStage Ⅳの大腸癌であっても、原発巣・転移巣がともに切除可能である場合や、大腸癌による腸管狭窄や出血などの症状を伴い化学療法が安全に行えない場合も手術の適応である1)。
本邦の大腸癌症例における手術方法は、腹腔鏡手術が83.8%と全国的に普及している12)。腹腔鏡手術は傷が小さく、術後疼痛が少ないだけでなく術後在院日数の短縮が可能であり、術者も微細構造の視認性の向上や、助手と同一視野を共有できるといった利点が挙げられるが、鉗子の可動域制限や術者や助手の手ぶれによる不安定さも指摘されている。腹腔鏡手術の技術的課題を克服することを目的に、消化器外科領域でもロボット支援手術が保険収載され、急速に件数が増加している。2018年にまず直腸癌に対しては保険収載となり、良好な短期成績が示されている13)。さらに2022年には結腸癌に対しても保険適応となり、開腹移行率や合併症発生率が腹腔鏡手術よりも低いことが報告されているが、手術時間の長さやコストの高さなどが課題となっている。
② 外科治療後のサーベイランス
外科治療後の本邦における再発率はStageⅠ: 5%、Stage Ⅱ: 14%、Stage Ⅲ: 29%と報告されている1)。再発臓器は、結腸癌では肝、肺、腹膜の順に多く、直腸癌では肺、肝、局所に多い1)。再発巣の治癒切除ができれば、その時点から5年生存が期待できる症例もある14)。
再発の87%が術後3年以内、97%が術後5年以内に診断されているため14,15)、サーベイランス期間は術後5年間が目安とされており、再発の多い術後3年以内はサーベイランス間隔が短めに設定されている1)。経過観察法として『大腸癌治療ガイドライン2024』では、問診・診察、腫瘍マーカー、胸部CT,腹部CT,大腸内視鏡検査、直腸指診を組み合わせた検査を推奨している1)。American Societyof Clinical Oncology (ASCO) 16), European Societyfor Medical Oncology (ESMO) 17)も同様の検査でサーベイランスを推奨しているが、本邦のガイドラインのほうがより厳密に設定されている。
大腸癌外科治療症例のうち、2-7%に同時性大腸多発癌を認めることが報告されていることから、前処置不良や狭窄で術前に全大腸を十分に検索できなかった場合、術後6か月以内をめどに残存大腸の検査を行うことが推奨される1)。また、大腸癌治療後には異時性大腸癌が1.5-3%発生すると報告されており、一般集団と比較し高率である1)。
5.4 大腸がんに対する薬物療法/放射線療法
① 薬物療法
大腸癌に対する薬物療法には、術後再発抑制を目的とした補助化学療法と、延命や症状緩和を目的とした切除不能進行・再発大腸癌に対する緩和的化学療法の2種類がある。補助化学療法は、手術によって肉眼的・顕微鏡的に病変を完全に取り切れた症例に対して、再発を抑制し予後を改善する目的で、術後に実施される薬物療法である。主にStageⅢ大腸癌が対象で、再発リスクの高いStageⅡ大腸癌に対しても実施されることがある。術後8週頃までに開始することが望ましく、投与期間は原則6か月間である1)。切除不能進行・再発大腸癌は、薬物療法を実施しない場合、生存期間中央値は約8か月と報告されているが18)、薬物療法を行うことで生存期間中央値を30か月以上に延長することが可能と報告されている19-21)。薬物療法単独で治癒を望むことは難しいが、薬物療法が奏効し転移巣が治癒切除された場合には、治癒が得られる場合もある。
薬物療法を行う前にRAS(KRAS/NRAS)遺伝子検査、BRAFV600E遺伝子検査、MSI検査を実施し、その結果や腫瘍占居部位を考慮して一次治療の方針を決定することが推奨されている1)。全身状態が不良、主要臓器機能が保たれていない、重篤な併存疾患を有する、といった症例は原則的に薬物療法の適応はないため、治療前には身体所見や血液・尿検査結果を確認し投与可能かを判断する1)。治療開始後は治療関連有害事象などを確認しつつ、治療の継続、薬剤の減量などを適宜判断する。治療効果判定はCT,MRIなどで行うが、腫瘍縮小効果の判定にはRECIST(Response Evaluation CriteriaIn Solid Tumors;https://jcog.jp/assets/RECISTv11J_20100810.pdf)を用いる1)。RECIST上もしくは臨床的に治療効果が認められなくなった場合や有害事象により治療継続が困難と判断される場合には治療を中止し、可能であれば次治療への移行を検討する1)。
② 放射線療法
直腸癌に対しては薬物療法と同時併用で補助放射線療法が行うことがある。局所制御率の向上を目的とし行われ、術前照射では肛門括約筋温存率と切除率の向上が得られることが示唆されているが22)、生存率の改善に関する明確なエビデンスは、現時点では存在しない1)。
参考文献
- 大腸癌研究会. 大腸癌治療ガイドライン : 医師用: 金原出版, 2024.
- Iwate M, Sano Y, Tanaka Set al: Validation study for development of the Japan NBI Expert Team classification of colorectal lesions. Dig Endosc 2018; 30(5): 642-651
- Kudo S, Hirota S, Nakajima T, et al. Colorectal tumours and pit pattern. J Clin Pathol 1994;47:880-885.
- Matsuda T, et al:Efficacy of the invasive/ non-invasive pattern by magnifying chromoendoscopy to estimate the depth of invasion of early colorectal neoplasms. Am J Gastroenterol 2008;103(11):2700-2706.
- Kudo S: Endoscopiv mucosal resection of flat and depressed early colorectal cancer. Endosocopy 1993; 25(7): 455-461
- Tanaka S, Oka, Chayama K: Colorectal endoscopic submucosal dissection (ESD): the present status and future perspective including its differentiation from endoscopic mucosal resection (EMR). J Gastroenterol 2008; 43(9): 641-651
- Tanaka S, Kashida H, Saito Y, et al: JGES guidelines for colorectal endoscopic submucosal dissection/ endoscopic mucosal resection. Dig Endosc 2015; 27(4): 417-434
- Ohata K, Kobayashi N, Sakai E, et al. Long-term Outcomes After Endoscopic Submucosal Dissection for Large Colorectal Epithelial Neoplasms: A Prospective, Multicenter, Cohort Trial From Japan. Gastroenterology 2022;163(5):1423-1434.e2.
- 斎藤 豊、他: 大腸内視鏡スクリーニングとサーベイランスガイドライン. Gastroenterol Endosc 2020; 62(8): 1519-1560
- Saito Y, et al: Colonoscopy screening and surveillance guidelines. Dig Endosc 2021; 33: 486-519
- Oka S, Tanaka S, Kanao H, et al: Mid-term prognosis after endoscopic resection for submucosal colorectal carcinoma: summary of a multicenter questionnaire survey conducted by the colorectal endoscopic resection standardization implementation working group in Japanese Society for Cancer of the Colon and Rectum. Dig Endosc 2011; 23(2): 190-194
- 日本内視鏡外科学会学術委員会 著. 内視鏡外科手術に関するアンケート調査 : 第16回集計結果報告, 日本内視鏡外科学会, 2022.11.
https://ndlsearch.ndl.go.jp/books/R100000002-I032498681 - Mastuyama T, Endo H, Yamamoto H, et al: Outcomes of robot-assisted versus conventional laparoscopic low anterior resection in patients with rectal cancer: propensity-matched analysis of the National Clinical Database in Japan. BJS Open. 2022;5(5):202.
- Kobayashi H, et al: Characteristics of recurrence and surveillance tools after curative resection for colorectal cancer: a multicenter study. Surgery 2007; 141(1):67-75
- Okamura R, et al: Proposal of a stage-specific surveillance strategy for colorectal cancer patients: A retrospective analysis of Japanese large cohort. Eur J Surg Oncol 2018;44(4): 449-455
- Ainhoa C, Govind N, Sarah T, et al: Treatment of Patients With Early-Stage colorectal Cancer: ASCO Resource-Stratified Guideline. J Glob Oncol 2019;5:1-19.
- Argiles G, Tabernero J, Labianca R:Localised colon cancer; ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020;31(10):1291-1305.
- Simmonds PC: Palliative chemotherapy for advanced colorectal cancer: systematic review and meta-analysis. Colorectal Cancer Collaborative Group. BMJ 2000; 321(7260): 531-535
- Yamada Y, Takahari D, Mastumoto H, et al: Leucovorin, fluorouracil, and oxaliplatin plus bevacizumab versus S-1 and oxaliplatin plus bevacizumab in patients with metastatic colorectal cancer (SOFT): an open-label, non-inferiority, randomised phase 3 trial. Lancet Oncol 2013; 14(13): 1278-1286
- Loupakis F, Cremolini C, Masi G, et al: Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014; 371 (17): 1609-1618
- Yamazaki K, Nagase M, Tamagawa H, et al: Randomized phase III study of bevacizumab plus FOLFIRI and bevacizumab plus mFOLFOX6 as first-line treatment for patients with metastatic colorectal cancer (WJOG4407G). Ann Oncol 2016; 27(8): 1539-1546
- Skibber JM, Hoff PM, Minsky BD, et al: Cancer of the rectum. In: Devita VT, Hellman S, Rosenberg SA (eds) . Cancer: principles and practice of oncology (6th ed). Philadelphia, Lippincott, Williams and Wilkins 2001; 1271-1318
第6章 今後の方策
今後の方策
日本では、1992年より便潜血検査による大腸がん検診を導入したにもかかわらず、男女ともに年齢調整罹患率はいまだに減少がみられず、死亡率はわずかに減少しているものの、諸外国と比較しても十分な効果が得られていない1)。日本でもっとも患者数の多いがんである大腸がんへの対策をどのように講じていくべきか、その方策について述べる。
① 大腸がんの1次予防
日本人を対象としたがん全般の予防として、「禁煙」、「節酒」、「食生活」、「身体活動」、「適正体重の維持」の5つが挙げられており(がん腫によっては「感染」も要因となる)、この5つの生活習慣を実践することにより、最大4割程度のがん罹患リスクの減少が期待できる2)。これは大腸がん予防にも当てはまるが、食事に関しては日本人におけるエビデンスが不十分であり、更なる科学的根拠の蓄積が期待される。日本人は体質や生活習慣が海外諸国とは異なるため、海外からのエビデンスだけでなく、日本独自の研究をより一層発展させることにより、日本人に最適な大腸がん予防法を確立する必要がある。
② 検診による大腸がんの2次予防
1次予防や治療の進歩以上に、大腸がん死亡抑制にもっとも寄与するのは2次予防(がん検診)と言われており、米国においては1975年から2000年までの25年間に大腸がん死亡が26%減少しているが、生活習慣の改善等による1次予防の貢献は9%程度であり、半分以上(14%相当)は検診の効果であると分析されている3)。
しかし我が国では、1992年より便潜血検査免疫法による大腸がん検診が開始されたが、効果は十分とは言えない。それを改善するためには、1)受診率対策、2)検診提供体制、3)精度管理、4)情報提供体制、などを見直し、整備する必要がある。
1) 受診率対策
日本においてはがん検診受診率を正確に把握する方法がなく、がん検診の実態把握、精度管理の上で大きな障害となっている。国によって統一された検診プログラムがないため、住民検診、職域検診、任意型検診(人間ドック)の3つの検診のいずれかを受けることになるが、このうち正確なデータが公表されているのは住民検診のみであり、職域検診や人間ドックの実態は、結果を集計・公開する法的根拠がないため把握できていない。そのために、3年に1回行われる国民生活基礎調査にがん検診受診の有無に関する質問が組み込まれており、この数字ががん検診受診率として公表されているが、自己記入式のため検診と診療が混同されている可能性、対象期間よりも古い受診歴を記載してしまう可能性など、過大評価となる傾向が指摘されている。
大腸がん検診の受診率対策として米国疾病予防管理センター(Centers for Disease Control and Prevention:CDC)が推奨しているのは、手紙や電話などによる勧奨・再勧奨(コール・リコール)、費用以外の障害の軽減(アクセスの向上など)、費用の軽減、1対1あるいはグループでの教育とされている4)。また行動経済学の「ナッジ理論」を取り入れた受診案内5)、かかりつけ医による受診勧奨も有効とされており、個々の受診者の健康状態を把握した医師が検診を勧めることにより、受診者も正しい知識に基づいて受診を決定できるメリットがある(Shared DecisionMaking)。これらの取り組みは各自治体の判断によって行われているが、費用やマンパワーの問題もあり、取り組み内容にばらつきがある。
検体の提出法に関しては、検診/医療機関への持ち込みが主流であるが、郵送法を採用している自治体もあり、受診率の向上が期待される。また高温下でヘモグロビン活性が低下して偽陰性につながることが郵送法の障害となっていたが、温度変化に安定な緩衝液も開発され、今後の活用が期待される6)。
2) 検診提供体制
便潜血検査免疫法による大腸がん検診は、その簡便さもあり、ほとんどすべての市区町村において住民検診として実施されている7)。一方で職域検診においては、事業主の66%、保険者の76%でしか大腸がん検診が実施されていないとする報告もあり8)、職域で受診機会が無い被保険者が住民検診など別の機会にがん検診を受診しているのかなど、実態は十分には把握できていない。また特に職域検診では、有効性が証明されていない検診方法が採用されていたり、推奨年齢から外れた若年者に検診を提供している場合もあり、受診者の不利益につながっている可能性がある。
国によって統一された検診プログラムを全国民に実施しその結果を把握する「組織型検診」を導入することにより、正確な受診率の把握、受診機会の均てん化が期待される。第4期がん対策推進基本計画でもその必要性が明記されているが、平成10年に一般財源化された際に、市区町村独自の事業として整理された経緯もあり、その実現は容易ではない。
3) 精度管理
便潜血検査には定性法と定量法がある。定性法では凝集反応を目視することにより判定を行うが、ある程度の経験が必要であり、また処理能力にも限界がある。定量法では、自動測定装置により大量の検体を処理できるだけでなく、カットオフ値の調整により実施者が望む要精検率を設定することができる。測定機器は様々なメーカーから提供されており、それぞれの推奨カットオフ値が設定されているが、実際には各実施者によって独自に決められていることが多く、精度管理の均てん化を図るためにも、検査キットの統一や精検キャパシティを考慮したカットオフ値の標準化が望まれる9)。
検診プログラムの一部として行われる精密検査としての大腸内視鏡検査は、日本では精度管理の対象とはされていない。大腸内視鏡検査の精度管理指標として、病変の発見率(Adenoma detection rateなど)、前処置、盲腸到達率、観察時間などが提唱されている10,11)。これらの指標は見逃し等の理由によって内視鏡検査後に発生する大腸がん(Post-colonoscopy colorectal cancer: PCCRC)の頻度と相関していることが報告されており、検診プログラム全体の効果に与える影響も大きいことから、後述する台湾の事例のように精度管理の対象に含めるほうが望ましい。便潜血陽性者の大腸内視鏡検査では、通常の診療と比べて病変の発見数が多く、また処置に伴って合併症の頻度が高いことも報告されており12)、より質の高い検査を提供できる体制づくりを目指す必要がある。
4) 情報提供体制
がん検診の意義については、国民に十分に理解されているとは言い難い。内閣府の調査でも、がん検診を受けない理由として、「心配なときはいつでも医療機関を受診できるから」、「費用がかかり経済的にも負担になるから」、「受ける時間がないから」、「健康状態に自信があり、必要性を感じないから」といった回答が上位を占め13)、がん検診が診療とは異なる制度であること、早期発見によりQOLの改善だけでなく費用の削減にもつながること、無症状者を対象としていることなどが正しく理解されていない。また、職域では特定検診と併せて十分な説明がないままがん検診を行うことが多く、検査の意義を理解しないまま受診していることが、精密検査受診率の低さにつながっている可能性がある。
学習指導要綱の改正により学校でのがん教育が開始され、その効果が期待されるが、検診対象年代におけるがん検診の認知度は十分とは言えず、各自治体、あるいは職域検診実施者によるより一層の情報提供が望まれる。同時に、検診に関して適切な情報発信ができる医師、検診従事者などの育成にも取り組む必要がある。
③ 海外での大腸がん検診の現状
大腸がん検診は国際的にも有効性が確立しており、多くの国で対策型検診として実施されている。第4章で紹介した英国をはじめ、日本より遅れて導入した国々でもすでに成果が上がっており、我々が学ぶべき点が多い。そのいくつかを紹介する。
1) 台湾の事例
台湾では、2004年に便潜血検査免疫法による大腸がん検診を導入した。導入時の対象年齢は50-69歳(2013年に50-74歳、2025年からは45-74歳に変更)で、1日法での隔年検査となる。日本よりも少ない検査回数にも関わらず、40%の大腸がん死亡抑制が達成されたことが、2021年に報告された14)。日本との大きな違いは実施体制、特にデータ管理の質であり、検診情報と住民登録情報を統合した中央データベースによって受診状況を管理し、必要な受診勧奨を行うだけでなく、内視鏡検査の質についてもモニタリングを行い、また最終的には、がん登録や死亡登録などとのリンケージを行って、検診の効果を検証している。国レベルでの検診データが把握できていない日本とは対照的で、精度管理に必要なデータを収集し利活用することの重要性がわかる事例である。
2) 欧州の現状
欧州でも大腸がん検診の主流は便潜血検査であるが、大腸内視鏡検査を対策型検診として導入している国もある。ドイツでは、便潜血検査化学法による検診を1970年代より導入していたが(2017年より免疫法へ切り替え)、2019年からは大腸内視鏡検診も選択できるようになった15)。男性は50歳、女性は55歳以上が対象で、10年間あければ最大で2回まで受診することができる。新規の受診率は毎年2%程度にとどまるが、1度の受診で10年分の検診は完了したことになるため、10年で20%以上の受診率上昇につながっている。ポーランドでも、2000年から一部の地域で任意型の内視鏡検診を導入し、検査体制やデータベースの整備を行ったうえで、2012年より対策型検診へと舵を切った16)。55-64歳の対象者に1度だけ検査を提供するもので、検査医や病理医へのトレーニング体制も確立し、精度管理に力を入れている。しかし、ポーランドでは便潜血検査は提供されておらず、また対象年齢も欧州での推奨(50-74歳)より限定的なため受診機会に限りがあり、肝心の内視鏡検診受診者も18%程度に留まっていることから、十分な効果は得られていない17)。現在進行中の大規模臨床試験の結果によっては日本でも対策型内視鏡検診の導入が議論されることとなるが、対象者をどのように選別するのか、検査の質をどうやって担保するのか、そもそもどのくらいの受診者が見込めるのかなど、課題は山積されている。
3) 米国の現状
米国の医療制度は日本とは異なり、公的医療保険の対象者が高齢者、障害者、低所得者などに限定されており、多くは民間医療保険に加入している。そのサービスの内容は格差が大きいが、検診に関しては、2010年に医療保険制度改革法(通称オバマケア)が成立し、すべての医療保険に対して無料もしくは少額の負担での検診提供を義務づけている。大腸がん検診としては、①10年ごとの大腸内視鏡検査、②5年ごとの大腸CT検査、③5年ごとのS状結腸鏡検査、④逐年の便潜血検査、⑤3年ごとの便DNA検査、から選ぶことができ、受診率は検診開始年齢を2021年より50歳から45歳に下げたことによって低下したものの、59%に達する18)。また10年以内の内視鏡検査受診者が54%に上り、便検査(④と⑤の合計)の10%と比べても、内視鏡検査が圧倒的に支持されていることがわかる(重複受診等により合算は59%を超える)。診療での内視鏡検査が高価でありアクセスが難しいことなど日本とは異なった要因があるものの、米国の年齢調整大腸がん罹患・死亡率は減少を続けており、その主たる要因として高い大腸内視鏡検査受診率が挙げられている。
④ 日本の大腸がん対策における課題
日本の医療制度は欧米とは異なる点も多く、その実情に合った対策が求められる。特に、検診と診療の境界が曖昧なうえに過剰な医療に対する規制が弱いこと、検診データを集積して次の改善へとつなげる仕組み(PDCAサイクル)が実装されていないことなどが、組織的な検診・診療の実施を困難にしていることを理解し、新たな枠組みの構築を目指す必要がある。政府が推進する医療DXがその追い風となることを期待しつつ、これから取り組むべき課題について考察する。
1) 大腸がん診療における課題
日本では、国民皆保険制度により医療機関へのアクセスが容易で、希望に応じていつでも安価で高度な医療を受けることができる反面、医療資源が一部の受診者に集中し、効果的に配分されないという側面もある。大腸内視鏡検査は限られた医療資源であり、必要な患者に幅広く実施されることによってもっとも効果的に大腸がんを抑制できると考えられているが、実際には特定の患者に高頻度で実施されている実態も報告されており、有効に活用されていない可能性がある。また、心配な時にいつでも医療機関にアクセスできることが、がん検診を受診する意欲を低下させている可能性もある13)。検診と診療の区別を明確にすることも重要な課題であり、PHR(PersonalHealth Record)を活用して検診受診歴や内視鏡検査歴を把握することにより、受診に関する一定のルールを定め、過剰な検査を抑制する仕組み作りも必要となる。
また精密検査として大腸内視鏡検査を行った際、現行のガイドラインでは、異常所見がなかった場合には検診へ戻ることが提案されているが、その時期についても検証すべきである11)。このような患者では検査後数年間は大腸がんのリスクが低下した状態にあり、検診の早期再開が偽陽性などの不利益につながる可能性もある一方で、特に便潜血検査で高い定量値を示した患者では、精密検査で異常を認めなくてもその後の大腸がん発生リスクが高いとする報告もあり19)、さらなる検討が必要である。
逆に、精密検査によりポリープが発見され切除された場合、その後の診療でのサーベイランス間隔はガイドラインに明記されており11)、切除したポリープの大きさや個数などによって1-5年後の検査が提案されている。これらの患者がサーベイランスをいつまで続ける必要があるのかについてのエビデンスは乏しいが、適切な時期に検診へ戻すことができれば内視鏡検査の効果的な分配にもつながるため、さらなる検証が求められる。
2) 大腸がん検診実施体制の課題
がん検診が期待された効果を上げるためには、有効性の確立した方法を、徹底した精度管理の下で実施し、そのうえで受診率を高める必要がある。大腸がん検診においては、他のがん検診のように指針外の方法が採用されることは少ないため、精度の高い便潜血検査の実施と受診率の向上が目標となる。
住民検診における精度管理は、「技術・体制指標」や「プロセス指標」をモニタリングすることにより行われているが、職域検診には規定がなく、2018年に「職域におけるがん検診に関するマニュアル」が策定されたものの、当該マニュアルが十分に活用されているとはいいがたい20,21)。精度管理が不十分な検診は、死亡率減少効果を得られないだけでなく、受診者の不利益につながる可能性もある。職域検診に関する法的な位置づけも含めて、がん検診全体の制度設計の検討が必要な状況にある。
現在広く用いられている便潜血検査は、右側結腸において病変の検出能が低く、死亡率減少効果も減弱することが報告されている。その弱点を克服すべく、便中DNA検査や血液検体を用いた検査法などが開発されているが、国内では実用化に至っていない。さらには、血液検体から同時に多数の癌を検出するMCED(Multicancer early detection)検査という手法も開発され、検診への導入に向けた研究が進んでいる。しかし現時点では、特に検診として用いた場合の不利益(偽陽性、過剰診断)に関する検証が不十分であり、またそのための研究デザインも複雑であり、実用化までに克服しなければならない課題が山積している。
大腸内視鏡検診への期待も高まっているが、現在進行中の大規模試験で有効性が証明される必要があるのはもちろんのこと、限られた医療資源である大腸内視鏡検査の処理能力を把握しておくことも導入に向けて重要であり、それに応じた検診対象者の条件、精密検査後のサーベイランス方針などを検討しておく必要がある。また前処置や検査による偶発症も大きな不利益と考えられるため、その実態を正確に把握しておく必要がある。日本消化器内視鏡学会が主導するデータベース(Japan Endoscopy Database: JED)等を活用して、悉皆性の高いデータを収集する体制構築が求められる。
受診率に関しても、第4期がん対策推進基本計画で明記された60%を目標に、より一層引き上げる必要性があるが、それに加えて不十分な精検受診率が検診の効率低下につながっている可能性もあり、より強力な取り組みが求められる。
そのためにも、国レベルで正確な検診データを把握する方法を確立することは急務であるが、検診対象者の半数程度が受診している職域検診の実態が把握できなければ、日本のがん検診の現状把握とそれに続く改善のプロセスは滞ったままとなる。組織型検診の導入、あるいはそれに匹敵する全数把握システムを構築することが、日本の大腸がん検診をより効果的なものにする上で、重要な課題である。
参考文献
- 国立がん研究センターがん情報サービス「がん統計(年次推移)」.
https://ganjoho.jp/reg_stat/statistics/stat/annual.html
(2025年1月7日アクセス) - 国立がん研究センターがん情報サービス「がんの予防・検診(科学的根拠に基づくがん予防)」.
https://ganjoho.jp/public/pre_scr/cause_prevention/evidence_based.html
(2025年1月7日アクセス) - Edwards BK, Ward E, Kohler BA, et al. Annual report to the nation on the status of cancer, 1975-2006, featuring colorectal cancer trends and impact of interventions (risk factors, screening, and treatment) to reduce future rates. Cancer. 2010;116(3):544-573.
- The Community Guide. Cancer Screening: Patient Navigation Services to Increase Colorectal Cancer Screening and Advance Health Equity.
https://www.thecommunityguide.org/findings/cancer-screening-patientnavigation-services-to-increase-colorectal-cancer-screening.html
(2025年1月7日アクセス) - 厚生労働省. 「明日から使えるナッジ理論」.
https://www.mhlw.go.jp/content/10901000/000500406.pdf
(2025年1月7日アクセス) - 東塚伸一、篠原弘珠、神野勉、他. 新採便緩衝液のヘモグロビン保存安定性の検証―通年での大腸がん検診郵送方式の可能性を求めて―.日消がん検診誌 2024; 62(4):389-398.
- 厚生労働省. 「第40回がん検診のあり方に関する検討会資料 令和5年度市区町村におけるがん検診の実施状況調査全国集計」.
https://www.mhlw.go.jp/content/10901000/001179392.pdf
(2025年1月7日アクセス) - 厚生労働省. 「第34回がん検診のあり方に関する検討会資料 2020年度職域におけるがん検診の実態調査報告」.
https://www.mhlw.go.jp/content/10901000/000894795.pdf
(2025年1月7日アクセス) - 日本消化器がん検診学会大腸がん検診精度管理委員会. 大腸がん検診マニュアル-2021年度改訂版-. 日消がん検診誌 2022; 60(3):385-536
- Rex DK, Anderson JC, Butterly LF, et al. Quality indicators for colonoscopy. Gastrointest Endosc. 2024;100(3):352-381.
- 斎藤豊、岡志郎、河村卓二、他. 大腸内視鏡スクリーニングとサーベイランスガイドライン. Gastroenterol Endosc 2020; 62(8): 1519-1560
- Hsu WF, Chang CY, Chang CC, et al. Risk of colonoscopy-related complications in a fecal immunochemical test-based population colorectal cancer screening program. Endoscopy 2022; 54(03): 290-298.
- 内閣府. 「がん対策に関する世論調査(令和5年度)(がん検診を受診していない理由)」.
https://survey.gov-online.go.jp/r05/r05-gantaisaku/#T1
(2025年1月7日アクセス) - Chiu HM, Jen GHH, Wang YW, et al. Long-term effectiveness of faecal immunochemical test screening for proximal and distal colorectal cancers. Gut 2021;70 (12):2321–2329.
- Hoffmeister M, Holleczek B, Zwink N, et al. Screening for Bowel Cancer: Increasing Participation via Personal Invitation. Dtsch Arztebl Int 2017; 114 (6): 87-93.
- Kaminski MF, Kraszewska E, Rupinski M, et al. Design of the Polish Colonoscopy Screening Program: a randomized health services study. Endoscopy. 2015;47(12):1144-1150.
- OECD EU Country Cancer Profiles 2023. EU Country Cancer Profile: Poland 2023 [Internet]. Warsaw. 2023.
https://www.oecd-ilibrary.org/social-issues-migration-health/eu-countrycancer-profile-poland-2023_04cfc3ee-en
(2025年1月7日アクセス) - American Cancer Society. Colorectal Cancer Facts & Figures 2023-2025. Atlanta: American Cancer Society; 2023.
- Peng SM, Hsu WF, Wang YW, et al. Faecal immunochemical test after negative colonoscopy may reduce the risk of incident colorectal cancer in a population-based screening programme. Gut. 2021;70(7):1318-1324.
- 厚生労働省. 「職域におけるがん検診に関するマニュアル」.
https://www.mhlw.go.jp/file/05-Shingikai-10901000-Kenkoukyoku-Soumuka/0000204422.pdf
(2025年1月7日アクセス) - 厚生労働省第42回がん検診のあり方に関する検討会. 「職域におけるがん検診の現状と 課題について」.
https://www.mhlw.go.jp/content/10901000/001271790.pdf
(2025年1月7日アクセス)
編集者・執筆者・査読者一覧
| 編 集 者 |
|---|
| 小林 望 (国立がん研究センターがん対策研究所) |
| 執 筆 者 |
|---|
| 要 約 |
| 小林 望 (国立がん研究センターがん対策研究所) |
| 第1章 大腸がんの病態 |
|
関口 正宇 (国立がん研究センターがん対策研究所) 小林 望 (国立がん研究センターがん対策研究所) |
| 第2章 日本の大腸がんの罹患・死亡の動向 |
|
田中 宏和 (国立がん研究センターがん対策研究所) 片野田 耕太 (国立がん研究センターがん対策研究所) |
| 第3章 大腸がんのリスク |
|
金原 里恵子 (国立がん研究センターがん対策研究所) 田嶋 哲也 (国立がん研究センターがん対策研究所) 井上 真奈美 (国立がん研究センターがん対策研究所) |
| 第4章 大腸がん検診 |
|
細野 覚代 (国立がん研究センターがん対策研究所) 中山 富雄 (国立がん研究センターがん対策研究所) |
| 第5章 大腸がんの治療 |
|
豊嶋 直也 (国立がん研究センター中央病院) 斎藤 豊 (国立がん研究センター中央病院) |
| 第6章 今後の方策 |
| 小林 望 (国立がん研究センターがん対策研究所) |
| 査 読 者 |
|---|
| 全 体 |
|
小林 望 (国立がん研究センターがん対策研究所) 関口 正宇 (国立がん研究センターがん対策研究所) |
| 第5章 |
|
金光 幸秀 (国立がん研究センター中央病院) 高島 淳生 (国立がん研究センター中央病院) |
| 第6章 |
|
斎藤 豊 (国立がん研究センター中央病院) 片野田 耕太 (国立がん研究センターがん対策研究所) 細野 覚代 (国立がん研究センターがん対策研究所) |
| 編 集 補 助 | |||
|---|---|---|---|
|
角川 康夫 (国立がん研究センター中央病院) 中村 佳子 (国立がん研究センター中央病院) 久田 泉 (国立がん研究センター中央病院) |
|||
| 利 益 相 反 | |||
|
編集者 小林 望 (原稿料 : オリンパス) |
|||
|
執筆者(章立て順) 関口 正宇 (なし) 田中 宏和 (なし) 片野田 耕太 (なし) 金原 里恵子 (なし) 田嶋 哲也 (なし) 井上 真奈美 (なし) 細野 覚代 (なし) 中山 富雄 (なし) 豊嶋 直也 (なし) 斎藤 豊 (講演料 : EAファーマ、 Erbe Elektromedizin GmbH、オリンパス、 オリンパスマーケティング、富士製薬工業、研究費 : オリンパス、 富士フィルム) |
|||