トップページ > 広報活動 > プレスリリース > 卵巣がんの治療を困難にする腹膜播種性転移のメカニズムを世界に先駆け解明新たな治療標的かつバイオマーカーとなりうるエクソソームを同定
卵巣がんの治療を困難にする腹膜播種性転移のメカニズムを世界に先駆け解明新たな治療標的かつバイオマーカーとなりうるエクソソームを同定
2017年2月28日
国立研究開発法人国立がん研究センター
国立大学法人名古屋大学
国立研究開発法人日本医療研究開発機構
研究成果のポイント
- 卵巣がんの治療を困難にしてる腹膜播種性転移の成立メカニズムにエクソソームが関与することを解明した。
- 卵巣がん細胞が分泌するエクソソームは腹膜の主要構成細胞である中皮細胞を細胞死へと誘導し、腹膜を破壊することにより、腹膜播種性転移を促進していた。
- 転移に関わるエクソソームが卵巣がん患者腹水中にも存在することを同定し、さらに同エクソソームは早期卵巣がん患者の予後を精度高く予測する有用なバイオマーカーとなりうる。
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)と国立大学法人名古屋大学大学院医学系研究科(研究科長:高橋雅英、愛知県名古屋市)は、卵巣から腹腔内(おなかの中)を覆う腹膜にばらまかれたように広がる卵巣がん細胞の腹膜播種(ふくまくはしゅ)による転移について、そのメカニズムを世界に先駆けて明らかにしました。
卵巣がんの5年生存率は、がんが卵巣に限局する初期症例では90%ですが、骨盤内臓器であるため腫瘍が発生しても自覚症状に乏しく、40%から50%の症例が骨盤外での腹膜播種性転移などのある進行症例でみつかります。卵巣がんにおいては、腹膜への進展や再発が治療を困難にしており、進行症例の5年生存率は40%と極めて低く、その作用機序の解明と新たな治療の開発が強く求められています。
本研究により、卵巣がん細胞から分泌される微小な小胞エクソソームにMMP1遺伝子が多く含まれており腹膜播種性転移に関わっていること、また卵巣がん患者の腹水に含まれるエクソソーム中にもMMP1遺伝子が多く含まれることを発見し、これらの研究成果により、同遺伝子の量が予後や治療効果の予測に有用なバイオマーカーとなる可能性が示唆されました。
本研究は、国立がん研究センター研究所分子細胞治療研究分野(落谷孝広分野長、横井暁研究員)と同中央病院婦人腫瘍科(加藤友康科長)、名古屋大学大学院医学系研究科産婦人科学(吉川史隆教授)との共同研究で、日本医療研究開発機構(AMED)「次世代がん医療創生研究事業」の支援を受け行ったもので、英科学誌Nature姉妹誌Nature Communications(電子版)に掲載されました。
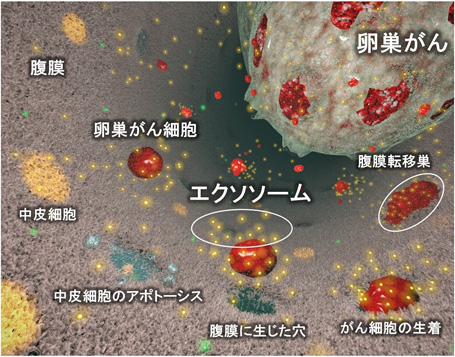
図1:卵巣がん細胞由来エクソソームによる腹膜播種性転移のメカニズム
中央病院婦人腫瘍科長加藤友康のコメント
「卵巣がんは、リンパ節転移や隣接臓器への浸潤例には、手術により根治も望めますが、腹膜に進展、再発治療している場合は治療が困難となり、予後に大きく影響します。つまり、腹膜播種の制御が卵巣がん治療の要と言えますが、これまでこの発生機序は不明で、有効な治療法もありませんでした。今回の研究成果は、腹膜播種制御に向け突破口を開いたものと期待しています。」
背景
卵巣がんは、おなかの中にがんが広がることで腹水という体液が溜まり、腹部全体が張ってくることによる膨満感や息切れがするといった症状により初めて異常に気づくことが多く、初期での自覚症状に乏しい危険ながんです。そのため、診断された時にはすでに、卵巣からがん細胞が、お腹の中を覆う腹膜にばらまかれたように広がる腹膜播種による転移を起こしているような、進行した状態で発見されることが少なくありません。発生要因には遺伝的関与のほか、出産歴がない場合にリスクが高まることも指摘されていますが、現時点では発症を予防することは難しく、罹患数、死亡数ともに上昇しています。さらに、卵巣がんが進行する分子メカニズムなどは不明な点が多く残されており、有効な早期発見方法や治療法の確立に至ってはいないのが現状です。
一方、細胞外膜小胞(Extracellular vesicles: EVs)の一つであるエクソソームは、直径100ナノメートル前後の微細な小胞で、がん細胞のみならず、あらゆる細胞から分泌されていることが報告されています。これらエクソソームに内包される核酸やタンパク質といった小分子が、受け手となる細胞で機能することで、細胞間相互作用に関与することが報告されており、近年多くの研究分野で注目を集めています。
国立がん研究センター研究所分子細胞治療研究分野でも、大腸がんの早期診断のための検出標的として(Nature Communications 2014)、また、乳がんの術後長期間を経ての再発に関わること(Science Signaling 2014)、そして、乳がんの脳転移のメカニズムの主役として(Nature Communications 2015)、エクソソームが関与することを報告しています。
- がん細胞が分泌するエクソソームを簡便に検出する画期的方法を開発わずかな血液で大腸がんを発見
- 術後長期間を経た乳がんの再発、転移メカニズムを解明 休眠中の乳がん細胞の治療抵抗性への関連も示唆
- 乳がんの脳転移メカニズムにエクソソームが関与 脳転移の早期診断への応用に期待
研究手法と成果
- 卵巣がんの腹膜播種性転移の成立の過程で、卵巣がん細胞が分泌するエクソソームは腹膜の主要構成細胞である中皮細胞をアポトーシスと呼ばれる細胞死へ誘導し、腹膜による障壁を破壊することにより、腹膜播種性転移を促進していた。(図1)
卵巣がん細胞が分泌するエクソソームが卵巣がんの腹膜播種性転移を促進することを動物モデルにて証明しました。その詳細なメカニズムを解明するために、腹膜の主要構成成分である中皮細胞に着目しました。同エクソソームが中皮細胞に作用し、アポトーシスと呼ばれる細胞死を誘導することが分かり、結果として、卵巣がん細胞が腹膜播種を成立する上で障壁となる腹膜を破壊していることを明らかにしました(図2)。また、この現象に重要な役割を持つ、エクソソーム中の分子としてMMP1遺伝子を同定しました。
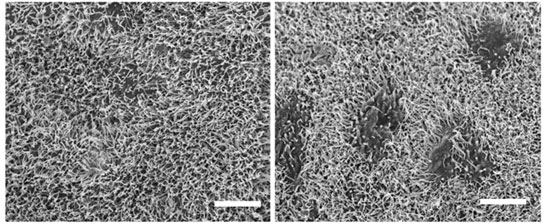
図2:エクソソームによって破壊された腹膜 電子顕微鏡像(3,000倍)
左:正常腹膜 右:卵巣がんエクソソームが作用した腹膜
- 転移に関わるエクソソームが卵巣がん患者腹水中にも存在することを同定し、さらに同エクソソームが早期卵巣がん患者の予後を精度高く予測する有用なバイオマーカーとなりうる。
腹水中エクソソームのMMP1遺伝子量は患者の予後に大きく関与
MMP1遺伝子が卵巣がん患者において、重要な遺伝子であることを確かめるために、卵巣がん患者1000人を超える大規模データべースの遺伝子情報を解析しました。さらにその中で、ステージ1の早期卵巣がん患者74名に対象を絞ると、MMP1遺伝子の量が少ない患者群(図3黒線)は、すべての患者がその後10年の観察期間の間生存しているのに対し、多い患者群(図3赤線)は、ステージ1であってもその後、再発・増悪により死亡するケースが約半数でみられることが分かりました。よって、MMP1遺伝子量の高低が極めて精度高く、その後の生存を予測しうることを示唆してます。
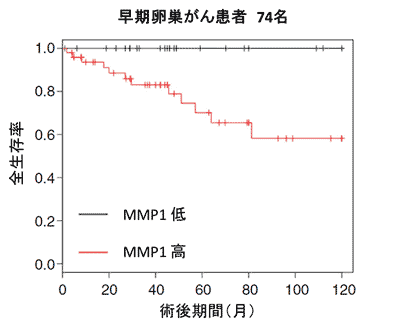
図3:MMP1遺伝子の卵巣がん患者の予後に与える影響
腹水中エクソソームのMMP1遺伝子量は治療効果も反映
動物モデルにおいてMMP1遺伝子を多く含むエクソソームが卵巣がんの腹膜播種性転移を促進したことを踏まえ、MMP1遺伝子含有エクソソームが、実際の卵巣がん患者さんにも存在するかを調べました。がん細胞が分泌するエクソソームが多く含まれると考えられる腹水に着目し解析を行った結果、腹水の中のエクソソームにMMP1遺伝子を多く含む患者が、今回解析した卵巣がん患者の27%に同定され(図4左赤枠内)、この割合は大規模データベースによる卵巣がん組織の、MMP1遺伝子の高い患者群の割合と一致するものでした。また、その遺伝子量は手術前に化学療法を受けていた患者群で、有意に低下することが分かりました(図4右)。
以上から、腹膜播種性転移を促進する、MMP1遺伝子を多く含むエクソソームは腹水中に存在し、患者さんの予後や治療効果を反映していると考えられます。
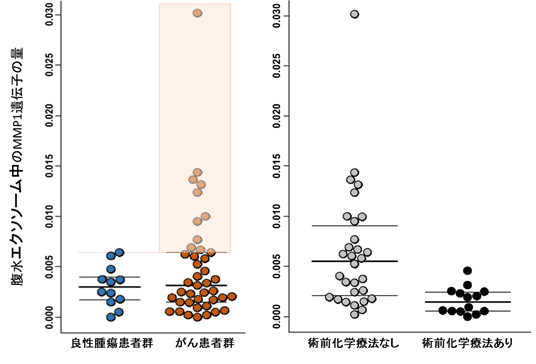
図4:腹水中のエクソソームに含まれるMMP1遺伝子量
手術時に採取した腹水からエクソソームを抽出し、エクソソーム中のMMP1遺伝子量をPCRにて検討した結果
今後の展望
本研究で同定した腹膜播種性転移を促進するエクソソームは、患者腹水中にも存在しており(図5)、早期卵巣がん患者において、同エクソソームが同定されれば、予後が不良であることが示唆されました。卵巣がん診療において腹水採取は、卵巣がん細胞の有無を検討するために必ず検査される事項で、同エクソソームの解析が加われば、早期卵巣がん患者の予後を予測でき、その後の経過観察における重要な情報となり得ると考えられます。また、腹水中のMMP1含有エクソソームは化学療法を行うことにより低下することも示されたことから、化学療法の効果判定に活用できる可能性もあります。
近年、エクソソームを標的としたがん治療の研究が進められ、特定のエクソソームの除去を行うことが将来的に可能となることが期待されます。当研究分野では、特定のエクソソームを標的とし、取り除くことによる治療効果を検討する研究も進めており、今後、本研究で同定したMMP1遺伝子を含んだエクソソームを阻害することにより、卵巣がんの転移を予防するような新規治療開発を目指します。また、腹水や血清など臨床サンプルの収集も継続し、バイオマーカーとしての意義を前向きに検討することも予定しております。
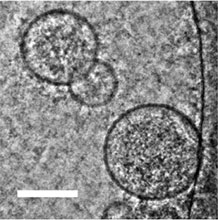
図5:卵巣がん腹水中のエクソソーム(電子顕微鏡像)
発表論文
雑誌名
Nature Communications
タイトル
Malignant extracellular vesicles carrying MMP1 mRNA facilitate peritoneal dissemination in ovarian cancer
著者
Akira Yokoi, Yusuke Yoshioka, Yusuke Yamamoto, Mitsuya Ishikawa, Syunichi Ikeda, Tomoyasu Kato, Tohru Kiyono, Fumitaka Takeshita, Hiroaki Kajiyama, Fumitaka Kikkawa and Takahiro Ochiya
研究費
国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)
研究開発課題名「がん特異的エクソソームの捕捉による新規体液診断の実用化研究」
プレスリリース
- 卵巣がんの治療を困難にする腹膜播種性転移のメカニズムを世界に先駆け解明 新たな治療標的かつバイオマーカーとなりうるエクソソームを同定
- 資料
関連ファイルをご覧ください。
報道関係からのお問い合せ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
郵便番号:104-0045 東京都中央区築地5-1-1
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp(●を@に置き換えください)
国立大学法人名古屋大学
大学院医学系研究科・医学部医学科
総務課総務係
郵便番号:466-8550 名古屋市昭和区鶴舞町65番地
電話番号:052-744-2228
Eメール:iga-sous●adm.nagoya-u.ac.jp(●を@に置き換えください)
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
郵便番号:100-0004 東京都千代田区大手町一丁目7番1号
電話番号:03-6870-2221
Eメール:cancer●amed.go.jp(●を@に置き換えください)
