トップページ > 診断と治療 > 治験情報(ちけんじょうほう)
治験情報(ちけんじょうほう)
更新日 : 2024年4月18日
公開日:2014年4月28日
治験(臨床試験)について
国立がん研究センターでは、よりよい医療を提供するとともに、新しい治療法や診断法などを開発する研究を行っています。そのような研究の中でも患者さんに参加していただいて、新薬や新しい治療法の効果や安全性を調べる試験を臨床試験(がん情報サービスへリンクします)といいます。中でも、国(厚生労働省)の承認を得るための成績を集める試験で、承認前の薬の有効性や安全性を調べたり、既に承認済みの薬について新たな適応症や用法・用量の有効性や安全性を調べる試験を治験(がん情報サービスへリンクします)といいます。ここで有効性と安全性が確かめられてはじめて「薬」として世に出ることになります。私たちが現在使用している薬や治療法は、このような臨床試験によってその効果が確認されてきました。これは臨床試験に参加していただいた患者さんのご協力のたまものであり、病気の治療方法が進歩するためには不可欠のものです。
治験にはいくつかの段階があります。第一段階は、治験薬の人間に対する副作用の種類と程度を調べ、治療に適切な投与量を検討するための試験で、第I相試験といいます。この試験では、薬を少ない量から一定の副作用が認められるまで、数人の患者さん毎に段階的に量を増やしていきます。第I相試験で安全な投与量がわかったら、第二段階として、その投与量で効果と副作用を検討します。この試験を第II相試験といいます。第三段階として、より多くの患者さんを対象として現在行われている標準的な治療薬と治験薬の効果と安全性を比較して優れているかどうかや劣っていないかどうかを検討します。この試験を第III相試験といいます。
抗がん剤の治験では、第I相試験と第II相試験の2つの試験、あるいは第III相試験を含めた3つの試験で集められた情報をもとに、厚生労働省で十分な審査を受け、効果と安全性が認められれば「薬」として承認、発売されることになります。
希少がんに対する新薬の開発と治験
日本で行われる治験のほとんどは、国内外の製薬企業から医療機関に委託された、いわゆる企業治験であり、これまでは、承認後の収益が見込める主要5大がん(胃がん、大腸がん、乳がん、肝がん、肺がん)への開発が優先される傾向にありました。1つの薬剤を開発して承認を得るまでに300億から500億とも言われる巨額の開発費用がかかること、利潤追求が背景にある製薬企業の本質を考えれば、これは致し方ないこととも考えられます。
一方、主要5大がんと対極に位置する希少がんに対する抗がん剤の開発については、1日本だけでは、一定の期間の中で治験を行うだけの十分な患者数が確保しがたいこと、2承認後も使用される場面が少なく、利潤追求の製薬企業の立場上、開発の優先順位として上位に位置付けることが難しい事情があること、などの理由により、なかなか進んでいないのが現状です。
日本では、2003年7月から製薬企業に代わって、医師自らが薬剤開発を行うことのできる「医師主導治験」の仕組みが作られました。医師主導治験は、小児がんをはじめとする希少がん、国内未承認の海外医薬品(海外では承認されているもの)、適応外使用など、その収益性の観点から製薬企業が開発に積極的でないにもかかわらず、医療現場における必要性が高い薬剤が実施の対象になることが多いのが現状です。このように、希少がんに対する薬剤開発において、医師主導治験はきわめて重要な位置付けにあるといえますが、その実施における種々の業務(モニタリング・監査・データマネジメントなど)において、多額の費用を必要とすることが多く、基盤資金の確保が大きな課題となっています。(参考:医師主導治験の基盤資金のほとんどは、公的機関からの競争的資金確保によって運用されています。)
国内で薬事法上未承認・適応外である医薬品について
独立行政法人医薬品医療機器総合機構(PMDA)が公開している「未承認薬データベース」をもとに、国立がん研究センター先進医療・費用対効果評価室が、米国あるいは欧州の承認情報を追加して作成しています。
希少がんに対する新薬開発の現状
新薬開発は、国立がん研究センターにおける重要な使命の一つです。下記にお示しするとおり、当センターでは多くの治験を行い、新薬開発を精力的に進めています。
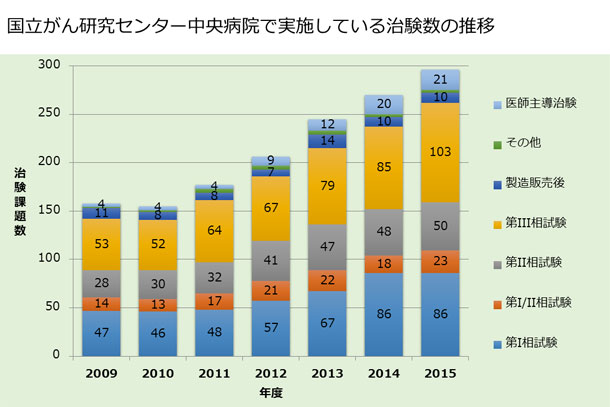
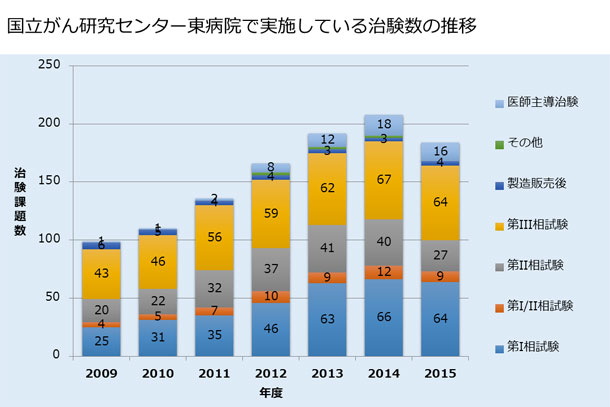
当センターにおける希少がんに対する新薬開発は、大きく二つに分かれています。
- 特定の希少がんに対する新薬開発は、各臓器診療科(例:中央病院(腫瘍内科、骨軟部腫瘍科)、東病院(腫瘍内科、骨軟部腫瘍科))で、第I、II相試験として実施されています。一部の新薬においては、第III相試験へ進んでいるものもあります。
- 1. よりも、より前段階(動物実験が終わって間もない、はじめて患者さんに投与される試験(First in Human試験)などの第I相試験)の新薬開発は、先端医療科で実施されています。先端医療科(中央病院・東病院)は、臓器横断的に新薬開発を進めるため、2013年に各診療部門から専門家が参画した新薬の早期開発に特化したチームです。
希少がんに対する治験情報
希少がんのみならず、治験に関する情報を入手する方法として、
- 日本医薬情報センター(JAPIC)(外部サイトにリンクします)
- 大学病院医療情報ネットワーク研究センター(UMIN)(外部サイトにリンクします)
- 米国NIHからのClinicalTrials.gov(外部サイトにリンクします)
などのWebサイトや、各医療機関のHPなどがあります。当センターにおいても治験に関する情報(中央病院・東病院)を公開しています。
希少がんにおける国立がん研究センターの役割
国立がん研究センターでは新薬開発を通じて希少がんの患者さんの治療選択肢を広げるとともに、新たな治療法の確立を目指すことが重要な役割であると考えています。
最近の分子生物学的研究の進歩によって、希少がんの一部においては、その増殖・浸潤・転移など、病気の活動に関係するメカニズム(例:遺伝子異常)が解明されつつあります。国立がん研究センターをはじめとする世界のがん治療開発施設では、疾患のオミックス(ゲノミックス、プロテオミックス、トランスクリプトームなど)解析を実施し、がんや宿主を詳しく解析することにより、臨床試験・治験の早期の段階から有望な治療を見出すことを目標としたトランスレーショナル研究を実施しています。これらをはじめとするトランスレーショナル研究により治療の概念実証試験(Proof of concept: POC試験)を行うことは、現在の治療開発において極めて重要で、これらの成果をきっかけにして、今後、希少がんに対する新薬開発はさらに発展してくるものと期待されます。
国立がん研究センターで行っている治験に参加するには?
治験の参加に際しては、一定の参加基準(適格基準)が設けられています。また、参加する試験毎に少しずつ適格基準が異なるため、参加を希望される(または検討してみたい)患者さんは、現在、診療を受けておられる主治医から、当センターの治験相談窓口(中央病院・東病院)へお問い合わせください。
執筆協力者

- 山本 昇(やまもと のぼる)
- 希少がんセンター
- 国立がん研究センター中央病院
- 先端医療科 呼吸器内科

- 土井 俊彦(どい としひこ)
- 国立がん研究センター東病院
- 先端医療科

- 内藤 陽一(ないとう よういち)
- 希少がんセンター
- 国立がん研究センター東病院
- 先端医療科






