平成29年度トピックス
担当領域の特性を踏まえた戦略的かつ重点的な研究・開発の推進
重点的な研究・開発
- 症例集積性の向上、臨床研究・治験手続の効率化、研究者・専門家の育成、臨床研究・治験の情報公開や適正化等に関し、一層強化。
- First in human試験をはじめ治験・臨床研究体制を整備し、診療部門や企業等との連携を図り、これまで以上に研究開発を推進。
- 遺伝子解析等による未来型医療を実現するための診断・治療法の研究開発
- 難治性がん、希少がんなどを中心とした新規治療法の研究開発
- 全国ネットワークを活用し、個人や集団に対しより最適化された標準治療開発のための多施設共同臨床研究
- がんのリスク・予防要因を究明するための精度の高い疫学研究及び前向き介入研究
戦略的な研究・開発
がんの本態解明、予防法・早期発見手法、アンメットメディカルニーズに応える新規薬剤開発、患者に優しい新規医療技術開発、新たな標準治療の創出、充実したサバイバーシップ、がん対策の推進・評価に関する研究に取り組む。
重要度「高」
国民が健康な生活・長寿を享受できる社会を形成するために極めて重要。
難易度「高」
同じ臓器のがんであっても、発生原因・メカニズムなどは患者の遺伝子変異の性質に応じて様々であるなど、研究の困難性が増している。生命科学、工学等他分野の技術・成果を統合的に応用する必要がある。
がんの本態解明に関する研究
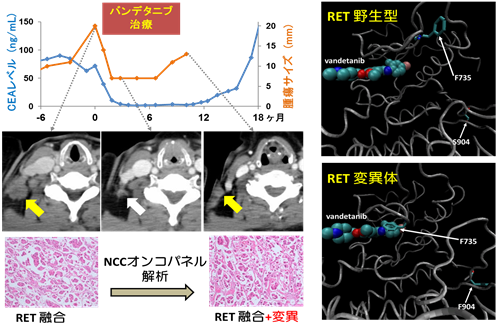
RET融合遺伝子陽性肺がんの薬剤耐性メカニズムを発見
RET融合遺伝子は、研究所により発見されたもの。これまでに全国遺伝子診断ネットワーク「LC-SCRUM-Japan」に基づいて同定された陽性例を対象とする医師主導治験(LURET試験)により、RET阻害薬バンデタニブの治療効果を示した。
平成29年度は、 LURET試験でバンデタニブが奏効し、後に耐性化したRET遺伝子融合陽性肺がんのRET遺伝子上に生じた二次変異について、X線構造解析、スーパーコンピュータ「京」等を用いた分子動力学シミュレーションなどを組み合わせた機能ゲノム解析により、世界に先駆けて薬剤耐性メカニズムを発見した。
- LC-SCRUM-Japanスクリーニングに基づき、RET融合遺伝子陽性肺がんにおける薬剤耐性変異を世界に先駆けて同定した。
- 遺伝子変異はアロステリック効果(タンパク質構造を協調的に変化させる効果)によって、薬剤耐性を引き起こす。
- 変異の効果は、スーパーコンピュータ「京」を用いた分子シミュレーションで推定できる。
平成28年度は臨床試験においてバンデタニブの有効性を確認したことを報告。平成29年度は、バンテダニブに対して耐性を示した症例のサンプルを用いて、耐性化のメカニズムを解明。
肺がんの世界の死亡者数は年間160万人で、RET陽性肺がん患者はその1パーセントから2パーセント。薬になると年間2万人から3万人に恩恵。
本研究成果は国際学術誌『Nature Communications』に掲載された。
経緯等については、実⽤化を⽬指した研究・開発の推進及び基盤整備参照
担当領域の特性を踏まえた戦略的かつ重点的な研究・開発の推進
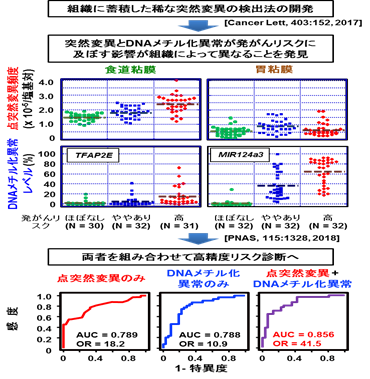
これまで測定困難であった、正常組織に蓄積された微量の点突然変異の測定法の開発に成功した。
胃がんの国内年間発生数は13万人、食道がんは1.8万人。その10-100倍程度が高リスク群で、そのリスク層別化に有用となる可能性があり、他のがんにも応用可能。
- 食道では喫煙や過度の飲酒により、胃ではピロリ菌感染により、正常組織でも既に突然変異が増加していることが示された。
- ライフスタイルに応じて蓄積した突然変異とDNAメチル異常(以前開発した方法)を測定することで、正確な新しい発がんリスク診断への発展が期待される。
本研究成果は米国科学アカデミーの機関誌『Proceeding of National Academy of Sciences』に掲載された。
革新的なハイスループット遺伝子変異機能解析手法を開発
大規模ながんゲノム研究によって、多数の臨床的意義不明な遺伝子変異が報告されるが、それらのがんとの関連性を評価するため、革新的なハイスループット遺伝子変異機能解析手法(mixed-all-nominated-mutants-in-one method: MANO法)を構築した(細胞情報学分野での東京大学との共同研究成果)。
- 101種類のEGFR変異を評価し、64種類でがん化能をもつ遺伝子変異が判明。さらに、5種類のEGFR阻害剤に対する感受性を評価することにより、多くのEGFR阻害剤耐性変異を発見。
- EGFR(L858R)変異陽性の肺腺がんを検査し、約20パーセントにEGFR遺伝子内の同一アレル上に重複変異が存在し、ゲフィチニブ耐性を誘導していることが判明。
- MANO法は、個別化医療の基盤的な手法になると期待され、新しい分子標的治療法の研究開発にも大きな貢献をすると考えられる。
本研究成果は国際学術誌『Science Translational Medicine』に掲載された。
胆道がんの世界横断的・最大の分子統合解析により、特徴的な治療標的分子を発見
胆道がんは、国内年間2万人以上の罹患者が新たに発生。5年生存率が膵がんに次いで予後不良な難治がん。国際がんコンソーシアムにおける国際共同研究によって、これまで未解明だった胆道がん発症の分子メカニズムを明らかにした。
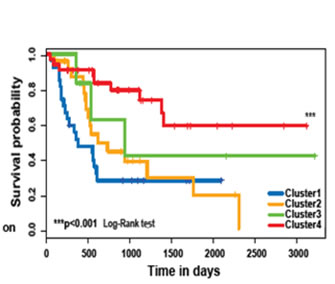
- 10カ国(日本・シンガポール・タイなど)から収集された世界最大の胆道がん症例(総計489例)に対し、ゲノム・エピゲノム・遺伝子発現の包括的シークエンス解析を行った。
- このうち、NCCは日本人胆道がんについて260症例を解析。単独の機関としては世界最大の解析数。
- 分子データを基に、生命予後と有意に相関する新たな4つの胆道がん分子タイプを同定し、更に新規も含め各タイプに特徴的な治療標的分子を発見。
- グループごとに治療法最適化が必要であることが明らかになり、必要な胆道がんのゲノム・分子異常の解明が大きく前進。
本研究成果は、国際学術誌『Cancer Discovery』に掲載された。
注:経緯等については、実⽤化を⽬指した研究・開発の推進及び基盤整備参照。
AIを活用したリアルタイム内視鏡診断サポートシステムを開発
大腸がん及び前がん病変(大腸腫瘍性ポリープ)の内視鏡画像約5000例を教師データとして深層学習技術を用いた解析を行い、大腸内視鏡検査時にリアルタイムに病変を発見するシステムの開発に成功した。
戦略的創造研究推進事業(CREST)の一環として実施。
- 臨床現場でリアルタイムに医師にフィードバックするため、AI技術と高速処理アルゴリズム、高度な画像処理装置を用い1台のPCで動作するシステムを構築。
- 本AI技術を用いて内視鏡画像を解析し、前がん病変としてのポリープと早期がんの発見に関し、感度98パーセント・特異度99パーセント・正診率98.8パーセントと高い精度を示した。
- 大腸内視鏡検査によって大腸がんの死亡リスクが61パーセント低下することが報告されている。本システムを社会実装することにより、病変見逃しの回避が期待される。
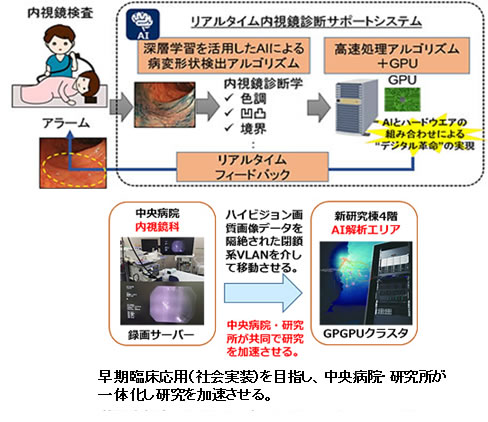
平成28年度は、AIを活用した統合的がん医療システム開発プロジェクトの開始を報告。
29年度は、内視鏡診断サポートシステムの開発に進展。
今後、研究所に設置されたAI解析エリアと中央病院内視鏡科の録画サーバーを、隔絶された閉鎖系VLANで接続し研究を
膵臓がんのリスク疾患や早期膵臓がんの新バイオマーカーによる検診を開始
当センターで発明・キット化された膵臓がんリスク疾患・早期膵臓がんを検出するバイオマーカーについて、鹿児島県で実施されている一般健診、がん検診、人間ドックに導入し、実験的な膵臓がん検診を開始した。
- 血液中の apolipoprotein A2 2量体のC末端切断異常を検出することで、非侵襲的に膵臓がんハイリスクグループを設定できる。
- このバイオマーカーは、米国国立がん研究所早期診断研究ネットワーク(NCI EDRN)でも盲検されている。
世界では、年間338,000例が新たに膵臓がんと診断されており、その多くは進行がん。早期膵臓がんや膵臓がんハイリスク群を血液バイオマーカーで濃縮し、高精度画像検査で早期膵臓がんを効率よく発見できれば、死亡率の低減に寄与できる可能性が高い。
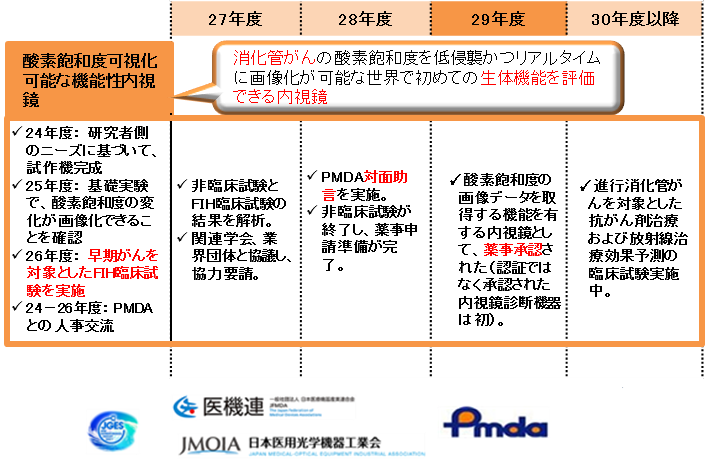
世界初の酸素飽和度可視化可能な機能性内視鏡の開発と承認に成功
従来なかった内視鏡でのがんの機能診断の臨床応用に取り組み、消化管粘膜表面の酸素飽和度を侵襲なく測定する画像技術(酸素飽和イメージング)を開発し、内視鏡の診断補助機能として初の薬事承認を平成29年7月に取得した。
- 内視鏡診断補助機能に該当する機能を抽出し、その有用性・評価手法を検討した。
- PMDAや関連学会、業界団体と概念の明確化を議論し、審査の考え方について提言した。
- がんの多くは低酸素状態にあるという機能的特性を応用し、新しい内視鏡機器開発を企業と共同で開発を進める。
がんの予防法や早期発見手法に関する研究
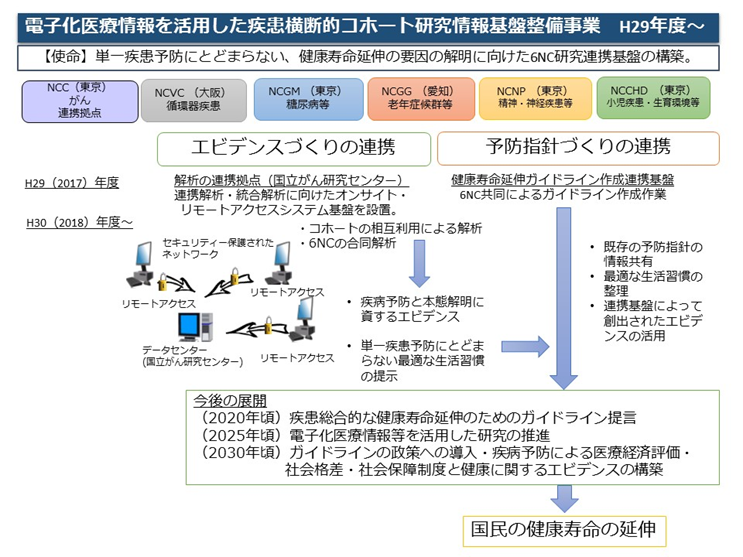
6NCコホートの共同研究基盤体制構築を開始
疾病横断的な研究体制を構築するため、各NCの既存コホートについて、がん・循環器・糖尿病・精神疾患等の疾病横断的な研究を実施できるよう基盤強化するとともに、6NCの疫学・公衆衛生研究担当部署が一体となった拠点を構築し、各NCのコホート研究基盤を相互に利活用できる体制整備を開始した。
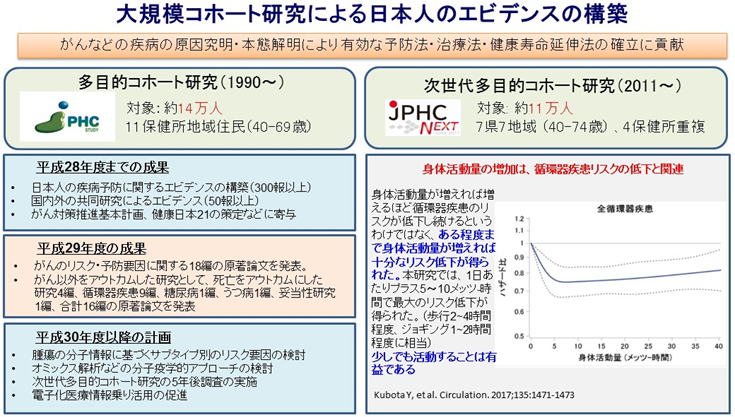
多目的コホート研究の成果として、健康寿命延伸のエビデンス確立へ
がんについて、女性関連要因と胆管がん、甲状腺がん、膵がんとの関連や、食事に関し、アブラナ科野菜と肺がん、食事パターンと大腸がんとの関連等を報告した。比較的まれながんの解析として、喫煙で急性骨髄性白血病のリスクがあがること、骨髄異形成症候群のリスクが2倍程度上昇することを報告。
がん以外では、食事パターンと死亡において、健康型のみならず、欧米型食事パターンでもリスクが低下することや、少しでも身体活動を増やすことは循環器疾患リスクを低下させるが、強めの身体活動による活動量が過剰になると出血性脳卒中のリスクが上昇することを報告。
アンメットメディカルニーズに応える新規薬剤開発に関する研究
がん新薬の開発試験体制の整備を進め、多数シーズ早期臨床試験を加速
東病院内に「シーズ開発支援室」及び「産学連携支援室」を設置するとともに、企業開発経験者やPMDA経験者等からなる専門家チームを構築。他施設からの医薬品シーズに関する開発相談・支援を本格化し、新たに東京大学・岡山大学でそれぞれ開発された2シーズの医師主導治験を開始。
- がん新薬のシーズ段階から、非臨床試験の実施、各種規制対応、臨床での開発戦略・ベンチャー起業等をサポート。
- First-in-human 等の医師主導治験を、迅速かつ規制に対応する質で実施し、わが国初のオリジナルシーズ開発を促進。
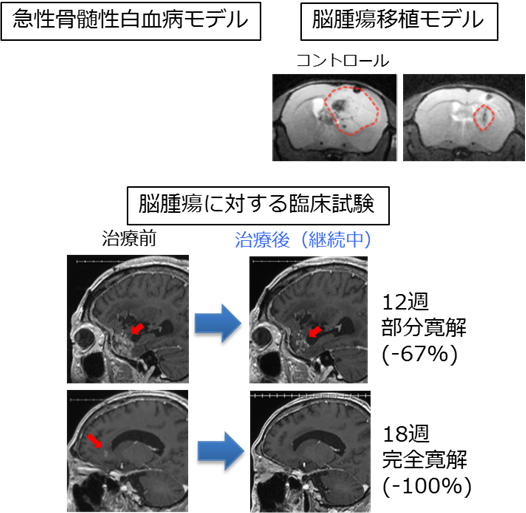
悪性脳腫瘍等の増殖を抑制する変異型IDH-1阻害剤を開発(臨床試験で著効)
平成28年度に変異型IDH1阻害剤の臨床試験を開始し、平成29年度は臨床試験で実際に著効した症例を確認。今後は有効性、安全性等の検証を経て保険適用を目指す。
- 代謝酵素であるIDH1の変異は、白血病・脳腫瘍・胆道がん・軟骨肉腫などで高頻度に見られる。
- IDH変異ががんの維持に必須であることを示し、変異型IDHが治療標的となることを証明。
- 独自の変異型IDH1阻害剤を第一三共株式会社と共同で開発し、白血病・脳腫瘍・軟骨肉腫の増殖を抑制することを解明。
- 平成29年1月より、悪性脳腫瘍に対する臨床試験を開始し、著効例を得た。
TR研究を基盤とした産官学開発コンソーシアムの新規モデル:GAP-FREE2
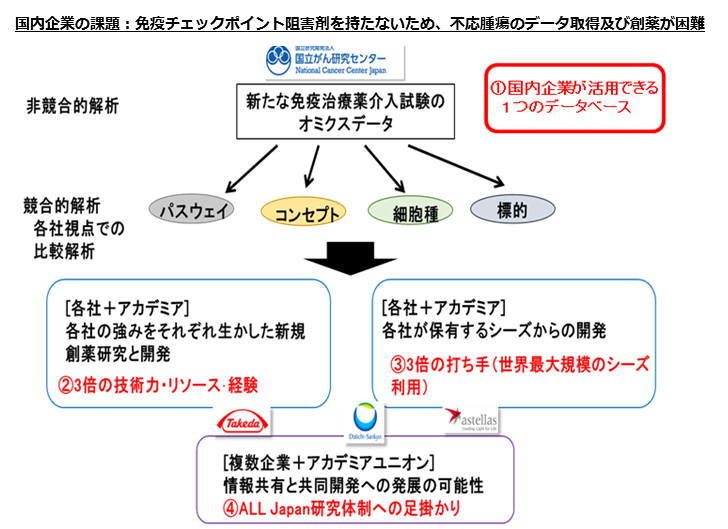
東病院において、28年度から欧米企業のがん新薬開発に負けない競争力を持った新たな次世代免疫治療薬剤等の創薬に向けて、国内企業3社との共同研究を東大柏キャンパスとともに主導的に実施(AMED研究事業)。
29年度は、参加各社とも新たなシーズ開発を開始。新たに2社からも共同開発研究の申し入れあり。
- 豊富な世界最先端の新薬臨床試験での検体に、世界的に類を見ないオリジナル先端的技術による詳細な免疫機能解析とシングルセル遺伝子解析を加え、データおよび臨床データを提供。
- 各企業がオリジナルで保有する創薬技術を融合することにより、開発を促進。
- 欧米トップ施設でも持ちえないデータの情報共有により、欧米企業に負けない新たな免疫療法剤開発への発展が期待される。
主な研究の成果
RET融合遺伝子陽性肺がんの薬剤耐性メカニズムを発見

胆道がんの世界横断的・最大の分子統合解析により、特徴的な治療標的分子を発見

国立がん研究センターの論文数と被引用数
論文数、被引用数 2018年6月1日時点(22分野(注1)で集計)
「Web of Science」のデータを元に集計

注1:クラリベイト・アナリティクス社が設定した医療に限定しない自然科学及び社会科学のうち、広く一般的に認知されている分野
他のがん研究機関等との比較(2012年から2017年)
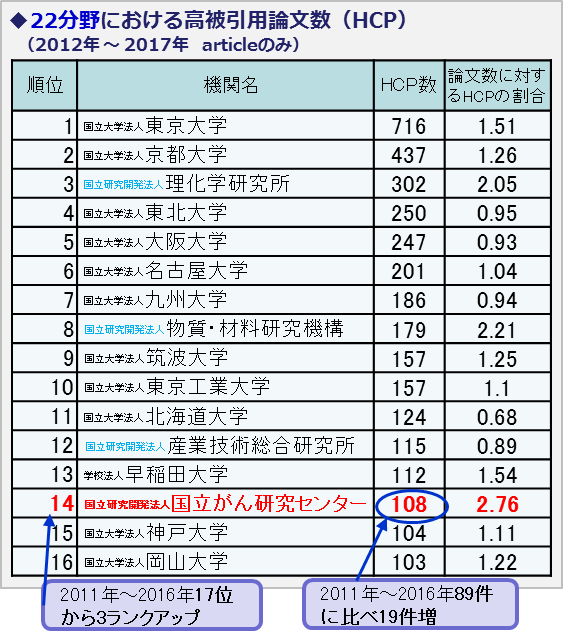
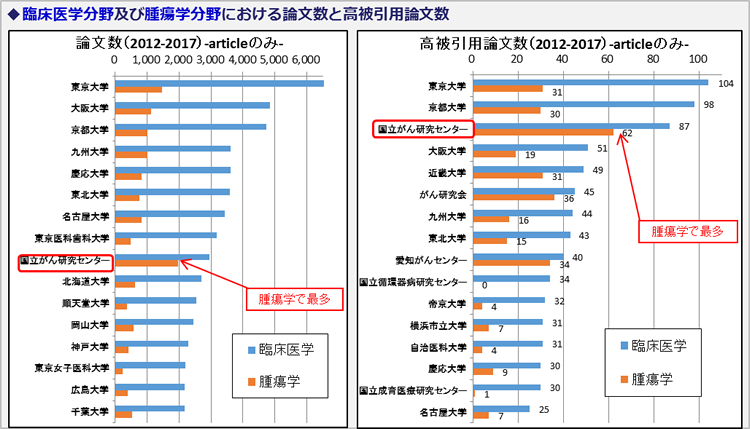
- 出典:クラリベイト・アナリティクス(旧トムソン・ロイター)「Essential Science Indicators(ESI)」を元に国立がん研究センター(NCC)において集計。
- ESIは、科学全体を大きく22の研究分野に分類して、各年・分野別に被引用数が世界でトップ1パーセントに入る論文を高被引用論文として特定し、研究機関別にその数を公表している。
本集計は、ESIに収録されている研究機関情報から、日本国内の研究機関と比較できるようにすることで、国立がん研究センターがどれだけインパクトの高い論文を出しているのかを示す指標とした。
なお、2018年4月19日にクラリベイト・アナリティクスが公表した「インパクトの高い論文数分析による日本の研究機関ランキングを発表」はreview(総説)を含めて集計しているが、本集計ではarticleのみを対象とした。
実⽤化を⽬指した研究・開発の推進及び基盤整備
- メディカルゲノムセンターの機能整備と人材育成、バイオバンク、データベース、共同利用施設の充実、研究管理・研究支援の充実、産官学連携・ネットワークの構築、倫理性・透明性の確保、国際連携の強化・国際貢献等により、研究・開発を推進する。
- 医療分野研究開発推進計画に基づき、臨床研究及び治験を進めるため症例集約化を図るとともに、臨床研究の質向上、研究者・専門家の育成・人材確保、臨床研究及び治験の共通的な基盤の共用など、基礎研究成果を実用化につなぐ体制を構築する。
注:難易度「高」…国民が健康な生活・長寿を享受できる社会を形成するために極めて重要。
がんゲノム医療の基盤整備
産学連携全国がんゲノムスクリーニング事業(SCRUM-Japan)…新薬承認を取得し、リキッドバイオプシーを用いた新しい世界最先端研究を開始
SCRUM-Japanは、平成25年に開始した希少肺がんの遺伝子スクリーニングネットワーク「LC-SCRUM-Japan」と、翌26年に開始した大腸がんの遺伝子スクリーニングネットワーク「GI-SCREEN-Japan」が統合してできた、日本初の産学連携全国がんゲノムスクリーニングプロジェクト。
全国約250医療機関と16社の製薬会社が参画し、アカデミアと臨床現場、産業界が一体となって、日本のがん患者の遺伝子異常に合った治療薬や診断薬の開発を目指す。
平成29年度までに約9,000例の肺・消化器がんゲノムスクリーニングを実施、企業・医師主導治験計42試験へ適合症例を登録。治験結果をもとに2剤の薬事承認を取得し、もう1剤の承認申請を準備中。
平成30年1月から、血液での多遺伝子検査パネルによるリキッドバイオプシー診断による新薬開発体制を構築。肺・消化器がん計4,000例の世界最先端・最大規模の開発試験を開始し、日本人患者への利益早期還元とわが国での新薬開発・ゲノム研究の活性化を図っている。

網羅的遺伝子パネル検査(NCCオンコパネル)によるゲノム解析…最新の個別化医療研究を開拓
中央病院では、平成25年より「TOP-GEAR(トップ-ギア)プロジェクト」を立ち上げ、日本で先駆けとなるがん関連多遺伝子パネル検査(NCCオンコパネル)を開発。
注:「NCCオンコパネル」は、がんに関連する114個の遺伝子変異と12個の融合遺伝子変異を1回の検査で調べることができる。
日本人の特徴を踏まえ開発した試薬による抗がん剤選択に役立つ遺伝子検査をはじめ、解析プログラムの開発、解析結果に基づいて方針を決定するエキスパートパネルの実施方法や院内体制などの検証を進めてきた。
平成29年度は、体外診断用医薬品・医療機器としての薬事承認、保険適用を目指し、シスメックス株式会社とともに一連の検査システムとして構築した。(平成30年4月から先進医療Bで実施)。

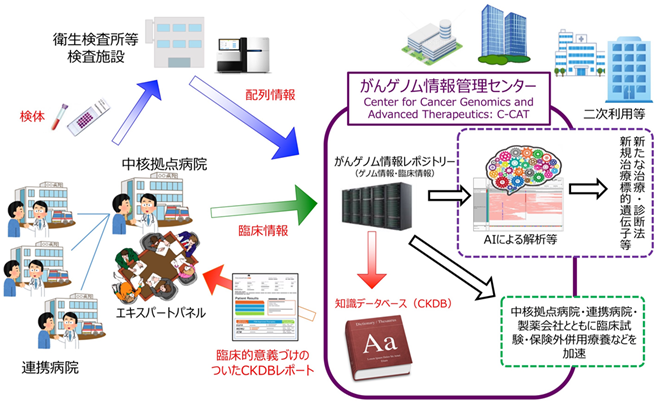
厚生労働省「がんゲノム医療推進コンソーシアム懇談会報告」(平成29年6月、座長:間野研究所長)を受けて、がんゲノム情報の全国的な集約・管理・利活用を実現するため、がんゲノム医療・研究のマスターデータベース「がんゲノム情報レポジトリー」を管理・運営するがんゲノム情報管理センター(Center for Cancer Genomics and Advanced Therapeutics: C-CAT)の設置(平成30年6月)に向けて、準備を開始した。
がんゲノム情報管理センターの役割
- 日本人の臨床・ゲノム情報を集約するとともに、我が国に至適化された知識データベースを構築
- がんゲノム医療中核拠点病院等との間でレポジトリーデータベースの情報を共有、保険医療へ活用
- 臨床試験・医師主導治験等の基盤データとして、企業を含む創薬・個別化医療開発へ利活用
- 全ゲノム解析の医療応用に向けて人材育成・技術開発
また、がんゲノム医療中核拠点病院として、両病院が平成30年3月に指定された。がんゲノム医療連携病院(中央病院9、東病院6)と協力しながら、がんゲノム医療の開発・提供に努めていく。
国際連携・国際貢献
アジアにおけるがん治療のリーダーシップポジションに向けて
- アジアに多いがん種の予防・診断・治療で世界を牽引すること目指す。平成29年9月、日本、中国、韓国、シンガポール、台湾の早期新薬開発拠点(フェーズ1センター)である医療機関と、連携強化の覚書を締結。アジアの5医療機関でコンソーシアム「Asian Oncology Early Phase 1 Consortium」を構築し、早期臨床試験(フェーズ1治験)の共同実施を加速し、アジアの特性を踏まえた効率的な早期新薬開発を目指す。
- アジアでは、これまで5機関(中国、韓国、台湾)と包括的な協力協定を締結。平成29年度は、新たにインドネシア国立がんセンタ-と締結。30年度は、さらにベトナム、タイの機関と締結を予定。
世界保健機関(WHO)/国際がん研究機関(IARC)から、がん登録に関する国際協力事業のコラボレーティングセンターに指定
平成29年5月、WHOのがん専門研究機関である国際がん研究機関(IARC)が世界的ながん登録推進のために新たに設けたコラボレーティングセンターとして、NCCが世界で初めて指定を受けた。
IARCは、がん罹患数等は多いが実態把握が遅れている地域において、がん登録の支援を行うため、平成23年よりGlobal Initiative for Cancer Registry Development計画を実施。
本指定により、WHO/IARCや地域のハブセンター(世界に6カ所)と協働し、がん登録やがん対策に関わる教材作成、研修、人材交流、現地でのがん登録立上げ・がん統計整備などを推進していく。
産学官の連携ネットワークの構築
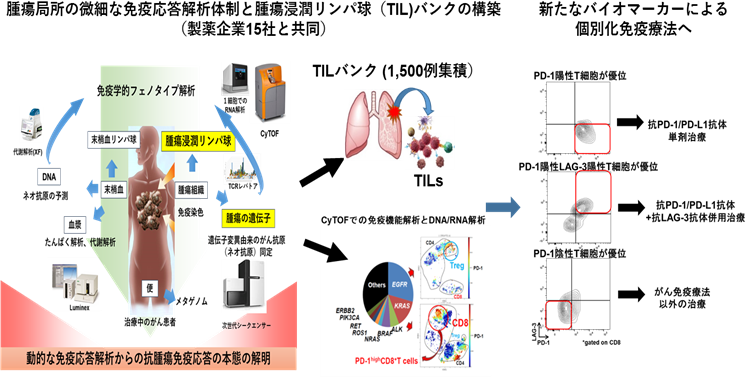
平成27年度から、がん治療を大きく変えつつある免疫療法の個別化治療開発に向け、新鮮な生検検体を用いた先端的な免疫機能解析と1細胞RNAシーケンスを含むゲノム解析を行い、腫瘍局所での微細な免疫応答の変化を動的にとらえる体制を構築。薬剤投与時の免疫モニタリングを製薬企業15社との共同研究として実施。
すでにがん免疫応答の主役となる腫瘍浸潤リンパ球(TIL)を約1,500検体集積し、世界的にも例を見ないTILバンキングを構築。平成29年度には、がん免疫応答の本態解明に迫るとともに、個別化治療に向けた新たな治療効果予測バイオマーカーを発見した。
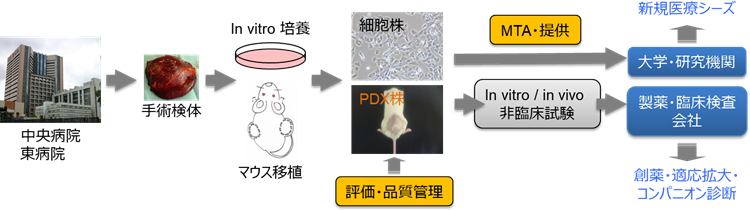
日本人がん患者由来PDXライブラリーの整備を開始
平成30年3月、AMED「医療研究開発革新基盤創成事業」(CiCLE)により、医薬基盤・健康・栄養研究所及びLSIメディエンスとともに、「がん医療推進のための日本人がん患者由来PDXライブラリー整備事業」を開始。
PDXは、がん患者由来のがん組織を免疫不全マウスに移植するものであり、従来の細胞株等に比べて極めて高い治療効果予測能を示すことが報告されており、抗がん剤開発にパラダイムシフトを起こしている。
日本人の特性も加味した効率的な新薬開発を目指し、PDXを産業活用できるよう、高度な研究・医療への応用を推進する。
産学連携ラボを構築
NEXTでの医療機器開発産学連携ラボ:企業8社、2大学
平成29年度、東病院に新しく開設したNEXT内に医療機器開発センターを設置。医療機器開発企業8社及び2大学が入居し、医療現場のスタッフとともに常駐し、現場のニーズに応える新たな外科手術、内視鏡機器の共同開発を開始。新たなロボット手術機器を開発し、ベンチャーキャピタルからの資金を得て承認申請準備に入るとともに、人工知能を用いた新たな手術支援ロボット開発に着手した。
新研究棟のラボ:企業9社
平成29年度、築地キャンパスに新研究棟を設置。治療技術開発企業9社が入居し、研究所のスタッフと協力し、新たな治療薬、治療技術及び医療機器の共同開発を目指す。
山形県鶴岡市で連携研究拠点が稼働
がんのメタボロノーム研究を進めるため、山形県鶴岡市に拠点を設けた。慶應義塾大学先端生命科学研究所が有する世界最先端のメタボローム解析施術を活用し、がんの診断薬や解析技術等の開発に向け、連携して研究を進める。
地域イノベーションの創出につながるよう、山形県及び鶴岡市の総合的支援のもと、公益財団法人庄内地域産業振興センターが事務局及び研究実施主体となって運営。平成29年度は、抗がん剤の効き目を検証する中で、核酸の存在ががん細胞の増殖に深く関わることを突き止めた。
倫理性・透明性の確保
認定臨床研究審査委員会を設置(臨床研究法への対応)
平成30年4月の臨床研究法施行に向け、両病院にそれぞれ臨床研究審査委員会を設置。
平成30年3月には臨床研究法に基づく厚生労働省の認定を取得し、全国の特定臨床研究を実施する機関に対する審査提供体制を整備した。
