過去の臨床試験データをプラセボ投与の代替とする新たな新薬開発の仕組みを目指す~No Placebo Initiative~
2023年10月5日
国立研究開発法人国立がん研究センター
発表のポイント
- 標準治療のない被験者を対象とした新薬のランダム化比較試験*1では、その比較対照群としてプラセボ(偽薬)*2が用いられることが一般的ですが、プラセボの使用には、患者さんへの倫理的配慮や、患者さんおよび医師の実務上の問題などのデメリットが知られています。
- 進行再発大腸がん臨床試験の世界的統合データベースプロジェクトARCAD(アルカド)のデータベースには、合計9試験1,673例のプラセボ投与症例データが格納される予定であり、これらのデータからプラセボ対照群を作り出すことにより、新薬を投与する単群試験での薬効評価ならびに承認申請への活用を計画しています。
- このプラセボが不要な新薬の承認を目指すNo Placebo Initiativeを実現するための方法を発表しました。
- 患者さんにとっては新薬のみを投与できるメリット、製薬企業にとっては承認手続きの迅速化や開発コストの削減などのメリットが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区) 東病院(病院長:大津 敦、千葉県柏市) 吉野 孝之副院長の研究グループは、進行再発大腸がん臨床試験の世界的統合データベースプロジェクトARCAD(Aide et Recherche en Cancérologie Digestive)の利用により過去の臨床試験データをプラセボ投与の代替とし新薬の承認を目指すNo Placebo Initiativeの概要を発表しました。
標準治療のない被験者を対象としたランダム化比較試験では、その比較対照群としてプラセボが用いられることが一般的ですが、プラセボの使用には、患者さんへの倫理的配慮や、患者さんおよび医師の実務上の問題などのデメリットが知られています。ARCADのデータベースには、合計9試験1,673例のプラセボ投与症例データが格納される予定であり、これらのデータから作られるプラセボ対照群を用いることにより、新薬のみの単群試験による薬効評価ならびに承認申請への活用を計画しています。過去の臨床試験データをプラセボ投与の代替とし新薬の承認を目指すNo Placebo Initiativeにより、患者さんにとっては新薬のみを投与できるメリット、製薬企業にとっては承認手続きの迅速化や開発コストの削減などのメリットが期待されます。
本研究成果は科学雑誌「Nature Medicine」(2023年7月28日付、Correspondence)に掲載されました。
研究方法・成果
欧米では、2000年代半ばから、仏国の公益認定であるARCAD財団と、米国のメイヨー・クリニックの共同運営による進行再発大腸がん臨床試験の統合データベースプロジェクトARCADが開始されました。このプロジェクトでは、世界中の臨床試験を格納し様々な研究に利用できるようなデータベースを持続的に作り出す仕組みが検討されてきました。今日までにそのデータベースは産官学の各ステークホルダーが重要視するものへと成長し、多くの研究者がこのデータベースを用いて代替エンドポイントの提案や新しい病期分類の提案、また高齢者ないし若年者における予後の検討など、米国や欧州の規制当局が承認の根拠として用いるレギュラトリーサイエンス上の実績を含む幅広い成果を挙げてきました。さらに2021年にはARCADアジア*3が始動することで、アジア圏で行われた臨床試験データが加わり、より充実度の高い世界的なデータベースが完成しました。
このデータベースには、合計9試験1,673例のプラセボ投与症例データが格納される予定ですが、これらのデータから仮想的に作られたプラセボ対照群を作り出すことにより、新薬を投与する単群試験での薬効評価ならびに承認申請への活用が検討可能となります。プラセボを投与された被験者の有効性評価項目である全生存割合*4、無増悪生存割合*5、奏効割合*6および病勢制御割合*7は、それぞれ5~7ヵ月、1~2ヵ月、0%、および10~20%と一貫した結果が示されています。
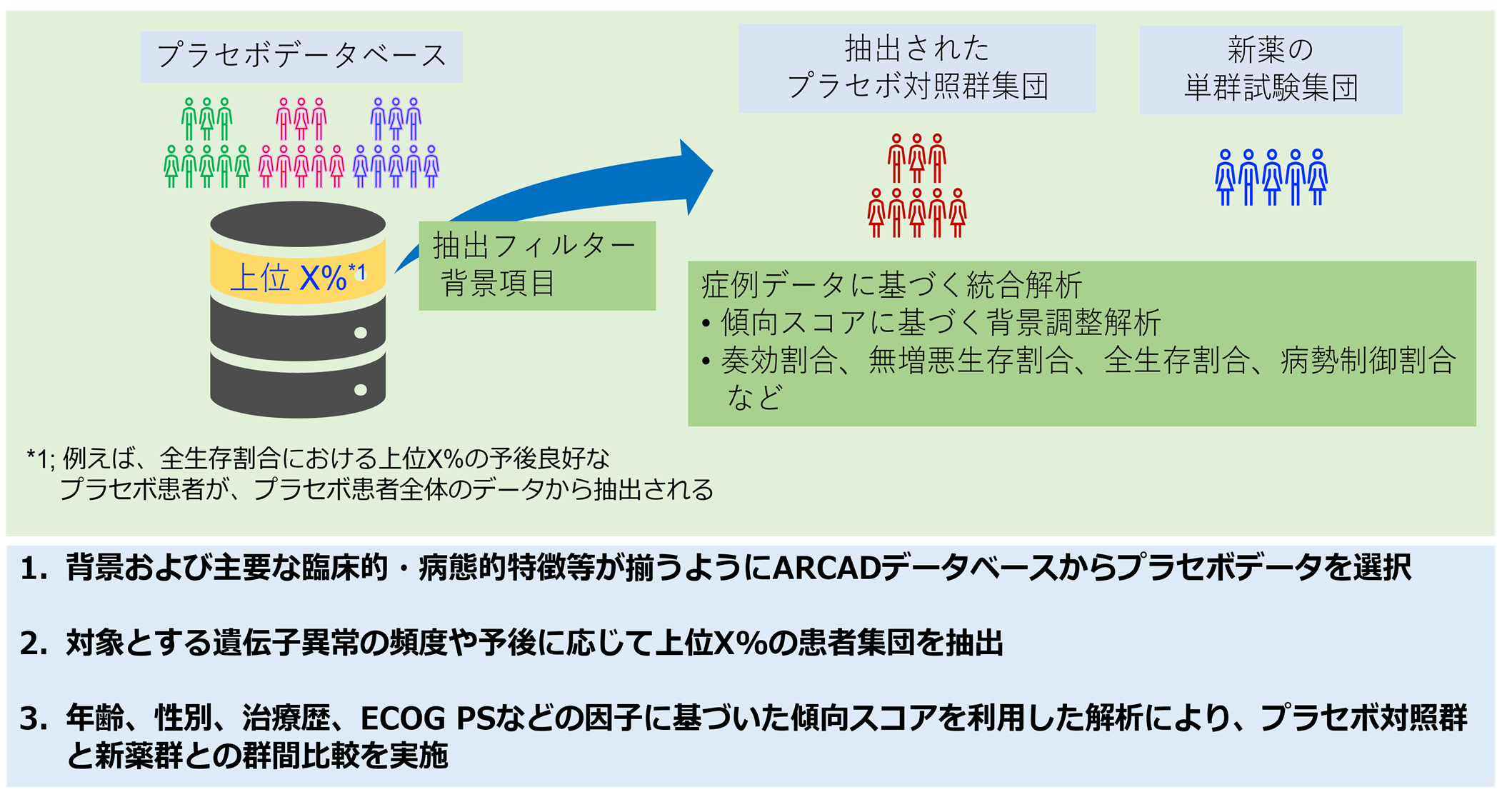
本論文では、No Placebo Initiativeを実現するために3段階の解析方法を提案しました。第1段階として、ARCADのデータベースから、新薬の単群試験と同様の集団になるように適格基準に基づいてプラセボの投与症例データを選択します。第2段階では、予後の良い上位何パーセントかの被験者をデータから抽出します。何パーセントとするかは、遺伝子変異(例えば、BRAF V600E変異の頻度が5~8%で予後不良とされています)の頻度やデータが取得された年代、統計学的な考察など、いくつかの要因に基づいて決定されます。第3段階は、年齢、性別、治療歴などの因子に基づく傾向スコアを用いた統計解析*8により、プラセボ対照群と単群試験の有効性を比較し、新薬の治療効果を推定することができます。
図1. No Placebo Initiative実現のための提案方法
展望
過去の臨床試験データをプラセボ投与の代替とし新薬の承認を目指すNo Placebo Initiativeにより、患者さんにとっては新薬のみを投与できるメリット、製薬企業にとっては承認手続きの迅速化や開発コストの削減などのメリットが期待されます。今回の成果を元に主要な国際学会および規制当局との議論・連携を深めていく方針です。
発表論文
雑誌名
Nature Medicine
タイトル
A synthetic control arm for refractory metastatic colorectal cancer: the no placebo initiative
著者
Takayuki Yoshino, Qian Shi, Toshihiro Misumi, Hideaki Bando, Masashi Wakabayashi, Morteza Raeisi, Thierry Andre, Aimery de Gramont
DOI
https://doi.org/10.1038/s41591-023-02488-0
掲載日
2023年7月28日
URL
https://www.nature.com/articles/s41591-023-02488-0(外部サイトにリンクします)
用語解説
*1 ランダム化比較試験
登録された患者さんをランダムに各治療群に割り付け、治療成績を比較する研究のことです。
*2 プラセボ
見た目などが新薬と同じで有効成分が入っていないものを指します。臨床試験において、新薬群と成分以外の条件をそろえるために使用されます。
*3 ARCADアジア
アジアを中心として行われた過去の治験・臨床試験データを収集・統合し、医薬品の研究開発等への利活用を行うことを目的としたデータシェアリング事業のことです。
参考:https://www.ncc.go.jp/jp/information/pr_release/2022/0804_1/index.html
*4 全生存割合
臨床試験の開始日(患者さんが群に割付られた日など)からある時点まで生存している患者さんの割合を指します。通常、全生存期間から比較したい群(試験群:臨床試験で効果を見たい治療を受けた患者さん、対照群:プラセボなど)ごとに各時点の生存割合を算出し、これらを比較することによりその治療に効果があったのかを確認します。
*5 無増悪生存割合
あるがん治療をした患者さんに対して、ある時点において治療中(治療後)にがんが進行せず安定した状態である患者さんの割合のことを指します。進行がんの患者さんにとっても治療により生存期間を延長することが最も重要ですが、長期間にわたり病態が安定し生活の質を保つことができることも重要です。そのため、この指標は進行がん患者さんに対する治療効果を見るときによく使われます。
*6 奏効割合
あるがん治療をした患者さんに対して、治療後にその治療の効果(がんの消滅や縮小)があった症例の割合を指します。治療法の評価の基準として用いられます。通常、画像上で明らかな縮小が確認できる完全奏効と部分奏効の合計で表されます。
*7 病勢制御割合
あるがん治療をした患者さんに対して、がんの消滅や縮小に加え、腫瘍の大きさが変化していないことまで確認できた症例の割合です。治療法の評価の基準として用いられます。
*8 傾向スコアを用いた統計解析
治療効果を比較するのに妨げとなりそうな因子(年齢、性別、治療歴など)の影響を考慮したうえで、群ごとの効果を評価する統計手法です。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター東病院
医薬品開発推進部門データサイエンス部 三角俊裕
電話番号:04-7130-0222
Eメール:tmisumi●east.ncc.go.jp(●を@に置き換えてください)
