日本発の分子イメージング技術を導入した創薬研究システムの実用化
がん組織中の薬物動態を可視化し臨床試験の早期段階での薬物評価を可能にする画期的技術
2013年12月18日
独立行政法人国立がん研究センター
株式会社 島津製作所
独立行政法人国立がん研究センター(理事長:堀田 知光、東京都中央区、略称:国がん)と株式会社島津製作所(代表取締役社長:中本 晃、京都市中京区)は、双方が有する研究開発能力を活かし、世界をリードするがんの高度先駆的医療技術を開発するため2011年4月に包括共同研究契約を締結、共同研究を進めております。
共同研究においては、次世代の創薬研究手法の開発を行い、質量分析技術を応用した2つの成果「分子イメージング技術の実用化による組織中の薬物分布濃度の可視化」および「抗体医薬品の種類に依存しない血液濃度測定技術による抗体医薬品の血中濃度モニタリング」が得られ、この研究成果を導入した創薬研究の観点からの分子イメージング技術の有用性評価、さらに臨床研究が開始されました。
いずれも、国立がん研究センターと島津製作所の双方が有する研究開発能力と、研究と診療の連携による成果で、国内はもとより世界的に見ても価値の高い成果です。
国立がん研究センターと島津製作所は、今後も包括契約の目標のひとつである"創薬プロセス革新のための薬物動態解析"をさらに推進し、緊密な連携を図りながら、より効果的で副作用の少ない、患者さんにやさしい抗がん剤開発に取り組んでまいります。
成果1 腫瘍組織中の薬物分布濃度を可視化する分子イメージング技術の確立により、ヒトの腫瘍組織中の薬物分布濃度と効果との関連の評価を開始
国立がん研究センター研究所 臨床薬理部門 濱田哲暢部門長
腫瘍組織中の薬物分布濃度を可視化する分子イメージング技術を確立することで、ヒトの腫瘍組織中の薬物分布濃度と効果との関連を評価し、医薬品の早期相の臨床試験(第I相臨床試験)注1の促進を目指しています。これまで見ることのできなかった組織の間質、血管部位、腫瘍部位への移行などまで捉えることができるこの革新的な創薬研究手法は、ヒトの腫瘍組織中の薬物分布濃度を可視化する分子イメージングを行うことで、投与量の設定、作用の評価、臨床試験の短縮を可能にする画期的技術として期待されています。
非小細胞肺癌患者に薬物を投与後採取された腫瘍の顕微鏡写真と質量顕微鏡注2を用いた薬物分布イメージング画像を示します。腫瘍組織全体から薬物シグナルが検出されていますが、正常組織では分布が少ない様子が認められます。効率的に標的腫瘍組織に集積する薬物特性は、高い治療効果を反映すると予想されます。
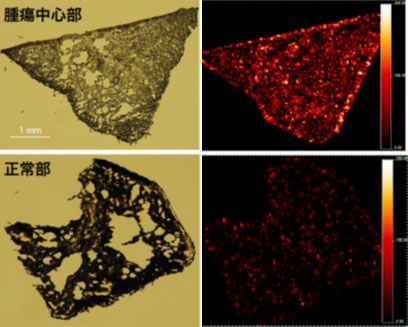
画像提供:共同研究者 島根大学医学部 内科学講座 呼吸器・臨床腫瘍学 礒部 威 教授
注:本研究は、厚生労働省 革新的医薬品・医療機器・実用化促進事業注3「全ゲノム配列解読・分子イメージング技術を組み合わせた革新的創薬研究手法の開発と個別化医療の実現」および国立がん研究センターがん研究開発費「抗悪性腫瘍薬の新規臨床薬理研究手法の開発に関する研究」により行われました。
原論文情報
Shimma S, Takashima Y, Hashimoto J, Yonemori K, Tamura K, Hamada A. Alternative two-step matrix application method for imaging mass spectrometry to avoid tissue shrinkage and improve ionization efficiency.
J Mass Spectrom. 48(12), 1285-1290, 2013(外部サイトにリンクします)
成果2 DDS(Drug Delivery System:薬物送達システム)抗がん剤の薬剤分布を高精細画像化し、がん組織に多く長く集まり、かつ正常組織への移行が少ない創薬コンセプトを証明
国立がん研究センター東病院臨床開発センター 新薬開発分野 松村保広分野長
DDS抗がん剤(パクリタキセル内包ナノ粒子、NK105)の薬剤分布を高精細画像化し、創薬コンセプトの通り、DDS抗がん剤が通常の抗がん剤よりもがん組織に多く長く集まり、かつ正常組織にはほとんど移行しないことを明らかにしました。質量顕微鏡を用いて、NK105を投与したマウスのがん組織と正常組織を画像で評価しました。その結果、NK105ががんの塊(かたまり)の奥深くまで長時間集まっていること、また正常な組織にはほとんど移行していないことが確認されました。DDS抗がん剤の創薬コンセプトがマウスにおいて証明されたことで、現在進行中の第III相臨床試験の結果が期待されます。さらに、前臨床の段階で詳細な薬剤分布を確認できることは、次世代DDS抗がん剤のドラッグデザインにおいても強力な武器となります。
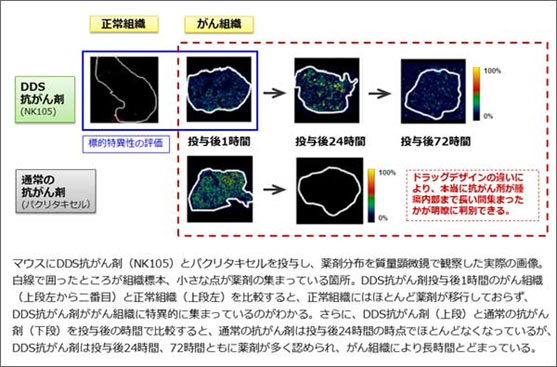
注:本研究は国立がん研究センターがん研究開発費(特別枠)「がんナノテクノロジー研究プラン」により行われました。
原論文情報
Masahiro Yasunaga, Masaru Furuta, Koretsugu Ogata, Yoshikatsu Koga, Yoshiyuki Yamamoto, Misato Takigahira & Yasuhiro Matsumura. The significance of microscopic mass spectrometry with high resolution in the visualisation of drug distribution
Scientific Reports 3, Article number: 3050 doi:10.1038/srep03050(外部サイトにリンクします)
成果3 抗体医薬品の血中濃度自動測定システム開発を目的とした、抗体可変領域の限定分解法を考案
島津製作所 ライフサイエンス研究所 産学連携研究室 嶋田崇史グループ長
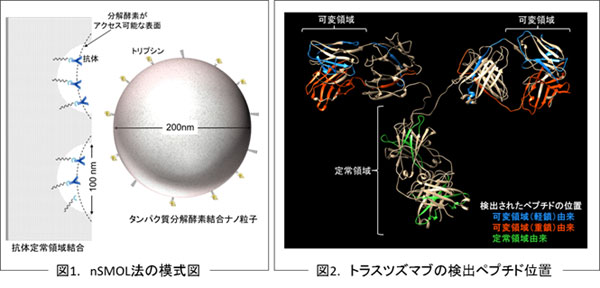
がん治療において適用範囲や品目が拡大する抗体医薬品の、投薬量の決定や副作用の予測、医薬品の品質管理などを目的とし、多品目にわたる抗体医薬品に対応可能な血中濃度モニタリング技術(質量分析を用いた血液濃度測定技術)を開発しました。ナノ粒子表面に結合したタンパク質分解酵素を用いて、支持体上の抗体を分解することにより、抗体ごとに異なる相補性決定領域注4(CDR)ペプチドの分析が可能となりました。そして血液中に添加した抗体医薬品を用い、CDRペプチドを確認、定量しました。本手法(nSMOL法:nano-surface and molecular-orientation limited proteolysis)を応用し、日本発の抗体医薬品の血中濃度モニタリングシステム開発を目指します。
抗体医薬の濃度が測定できることは、血中や腫瘍内での薬物動態解析を行う上で、極めて重要な新しい手法となります。
原論文情報
Noriko Iwamoto, Takashi Shimada, Yukari Umino, Chikage Aoki, Yutaka Aoki, Taka-Aki Sato, Akinobu Hamada & Hitoshi Nakagama. Selective detection of complementarity-determining regions of monoclonal antibody by limiting protease access to the substrate: nano-surface and molecular-orientation limited proteolysis.
Analyst, DOI: 10.1039/c3an02104a in press.(外部サイトにリンクします)
注:成果3の詳細については島津製作所(下記)にお問い合わせください。
補足説明
- 注1:第I相臨床試験
前臨床試験で有効性・安全性が検討された治験薬をヒトに投与する臨床試験であり、毒性の種類や程度、毒性の状況からII相臨床試験で用いる投与量や投与スケジュールの推定、薬物動態・薬力学の検討等を目的に臨床試験の早期の段階で実施されます。国立がん研究センターは、平成23年度より日本発の革新的な医薬品・医療機器の創出を目的とした早期・探索的臨床試験拠点(医薬品/がん分野)として選定されています。 - 注2:質量顕微鏡
科学技術振興機構「先端計測分析技術・機器開発プログラム」の支援を受けて、光学顕微鏡と質量分析計を融合した日本オリジナルの分子イメージング装置。従来の質量分析法では、生体組織を破砕・分離してから目的分子を測定するため、分子が生体試料のどの部位に分布しているか評価することが不可能でしたが、質量顕微鏡は、見ているものや、見ている場所に含まれている分子をそのまま質量分析することが可能です。これまでの分子イメージング装置では、通常100ミクロンから200ミクロンであった解像度が、質量顕微鏡では最小5ミクロンでの細胞レベルを判別できる高解像度イメージングを可能とするため、これまで判別できなかった細胞内薬物分布を解析する手法として期待されます。 - 注3:革新的医薬品・医療機器・再生医療製品実用化促進事業
厚生労働省による、日本発の革新的な医薬品・医療機器等の創出により、健康長寿社会を実現するとともに、国際競争力強化による経済成長に貢献する事を目的とした事業です。 - 注4:相補性決定領域(CDR:complementarity-determining region)
抗体分子の可変部位の中で、実際に抗原に直接結合する5から10アミノ酸残基の領域を指し、重鎖と軽鎖にそれぞれ3つの領域が存在します。CDRは、抗原に対する特異性を決定する領域であるため、抗体間でアミノ酸配列が大きく異なります。抗体医薬品においてもそれぞれのCDRは異なるため、CDRを指標とした抗体医薬品の特異的分析が可能となります。
問い合わせ先・報道対応
- 独立行政法人国立がん研究センター
企画戦略局広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp(●は@に置き換えてください) - 株式会社 島津製作所 ホームページ(外部サイトにリンクします)
広報室
電話番号:075-823-1110
Eメール:pr●group.shimadzu.co.jp(●は@に置き換えてください)
記者説明会資料
日本発の分子イメージング技術を導入した創薬研究システムの実用化 記者説明会(2013年12月18日開催)
関連ファイルからご覧いただけます。
