申請資料作成における業務の標準化、作業効率化を図り、データシェアリングが容易にSDTM規格に対応した薬事承認申請用プロトコルテンプレートを開発
国立研究開発法人国立がん研究センター(理事長:中釜 斉、略称:国がん)東病院(院長:大津 敦、所在地:千葉県柏市)は、CDISC標準(注1)に対応した、臨床試験データセット標準規格(Study Data Tabulation Model:SDTM(注2))である薬事承認申請用のプロトコルテンプレートを開発しました。また、本テンプレートから承認申請に必要なデータを抽出し、SDTM規格データとしてマイクロソフト社のMicrosoft Excelへ移行するツールも作成しました。これにより薬事承認申請におけるSDTM規格データとプロトコルとの整合性確認の作業効率化が図れ、他施設とのデータシェアリングが容易にできることが期待されます。
背景
2020年4月から独立行政法人医薬品医療機器総合機構(以下、PMDA)へ提出する薬事承認申請データにSDTM(Study Data Tabulation Model)規格で作成された臨床試験の電子データを含めることが義務化されます。薬事承認申請データを提出する際、プロトコルに記載された内容との整合性確認は目視で行っており、多くのリソースがかかっています。そのため、効率的かつ信頼性の高い変換ツールの研究開発が世界中で行われています。なお、海外では既にFDA(アメリカ食品医薬品局)がSDTM規格を導入しています。
テンプレートの特徴
今回開発したプロトコルテンプレートは、世界的な標準開発機関であるCDISC標準の観点からレビューし、SDTMドメイン、変数、Controlled Terminologyを、Microsoft Wordの機能であるコンテンツ コントロールのプロパティを用いて、タグ情報として追加しました。
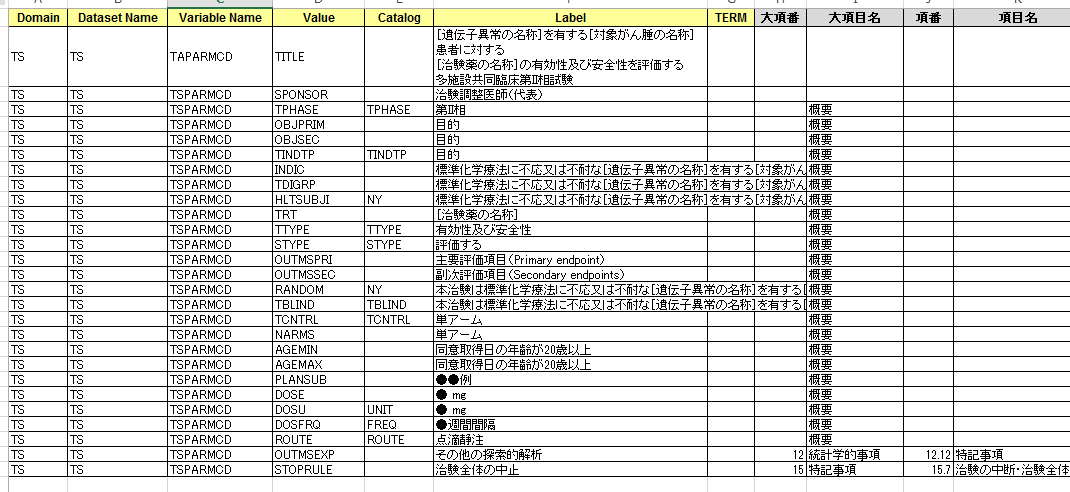
プロトコルの記載事項に入力することにより、SDTM規格データに無変換で移行できるため、相互にデータの共有が可能となり、高効率で信頼性が高く、SDTM規格で重要な原データからSDTMに変換されるまでの過程を追跡できるデータを作成することができます(事項図1)。また、このテンプレートは統一規格のため、薬事承認申請に至らない臨床試験のデータも他施設や企業とデータシェアリングがスムーズに行えます。規格が統一されることにより、現在使用されている薬剤との比較が容易になります。
今後の展望
SDTM規格データとプロトコルとの整合性確認の効率化の課題は、多くの個人開発者や製薬企業、CRO(Contract Research Organization 医薬品開発受託機関)、ITベンダー企業等で開発されていますが、個人や企業内のみでの共有に留まっているのが現状です。本プロトコルテンプレートおよびツールは、オープンソースソフトウェアとして広く公開することにより、様々な視点から改良が加えられより自由度の高いツールになっていくことを目的としており、年内の公開を予定しています。なお、本プロトコルテンプレートはMicrosoft Wordのフォーマットで作成されており、SDTM規格データとして出力される際はMicrosoft Excelのフォーマットになるため、オペレーティングシステム(OS)に依存する設計です。CDISCではプロトコルなどのドキュメントもオープンソースであるXML(注3)フォーマット等の汎用性が高い形式で作成することを推進しているため、今後はそれらに対応した改良が成されることで、CDISCが掲げる「CDISC標準実装メリット」である、効率化、イノベーションの強化、データシェアリングの円滑化、予測の向上、完全なるトレーサビリティ、データ品質の向上、コスト削減、合理化されたプロセスの一翼を担うことができます。
国立がん研究センターでは、2018年中にSDTM形式に対応したプロトコルの使用を開始するため、現在進行中の治験のデータベースを調整し、今後新たに開始される治験はこのテンプレートを使用します。
本研究への支援
日本医療研究開発機構 平成29年度 革新的がん医療実用化研究事業「ゲノム等のバイオマーカー情報に基づく希少がん・希少フラクション領域の臨床開発を促進するための基盤整備研究」(研究開発代表者:佐藤暁洋)
用語解説
注1:CDISC標準…CDISC(Clinical Data Interchange Standards Consortium)とは臨床研究や治験を実施する際に利用できる国際的なデータ取得・交換・申請のための標準を定めている非営利団体。CDISCにて策定される標準(CDISC標準)を導入することで臨床試験を効率的に行うことができる。また、平成28年からは新薬の製造販売申請のデータについてはCDISC標準に準拠することが求められている(平成32年3月末まで経過処置)。東病院では、臨床研究・医師主導治験におけるCDISC標準の導入を積極的に行っている。
注2:SDTM(Study Data Tabulation Model)規格…当局申請時に提出する臨床試験データセットの標準モデル。
注3:XML…コンピュータ言語のひとつ。異なる情報システムの間で、構造化された文書や構造化されたデータの共有を容易にすることできることで広く利用されている。
報道関係からのお問い合わせ先
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
郵便番号:277-8577
住所:千葉県柏市柏の葉6-5-1
電話番号:04-7133-1111(代表)
E-mail:ncc-admin@ncc.go.jp
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 がん研究課
郵便番号:100-0004
住所:東京都千代田区大手町一丁目7番1号
電話番号:03-6870-2221
E-mail:cancer@amed.go.jp
