乳がん幹細胞様細胞が分裂し、倍増する仕組み発見
トリプルネガティブタイプ等の一部の乳がんは、再発が多く予後不良のため、よりよい分子標的治療薬の開発が強く望まれています。乳がん組織内に存在するがん幹細胞は、がんの治療抵抗性に関わると考えられており、これらの細胞を標的とした治療薬の開発が、乳がんの根治につながると期待されます。本論文は、乳がん幹細胞で活性化しているMICAL3が、これらの細胞増殖を促進する事を見出しました。がん分化制御解析分野の岡本康司分野長はがん三次元培養技術の専門家として、がん幹細胞培養の技術供与に貢献しました。今後、MICAL3の阻害剤開発を通じて、乳がん根治に向けた治療につながる事が期待されます。
2018年12月26日
金沢大学がん進展制御研究所/新学術創成研究機構の後藤典子教授、富永香菜研究協力員、東京大学医科学研究所先端医療研究センターの東條有伸教授、東京大学医学部附属病院の多田敬一郎准教授(研究当時)、田辺真彦講師、国立がん研究センター研究所の岡本康司がん分化制御解析分野長らの研究グループは、乳がん幹細胞様細胞が分裂を繰り返すごとに倍増する仕組みを明らかにしました。
がん組織はさまざまながん細胞から構成されています。幹細胞に近い性質を持った「がん幹細胞様の細胞」が親として存在し、分化段階の異なるがん組織内の全てのがん細胞を生み出すことが近年分かってきました。したがって、がん幹細胞様細胞をなくすことが、がんを根治させるために重要です。しかし、がん幹細胞様細胞をなくす分子標的薬は未だ存在せず、有効な治療方法の開発が強く求められています。
通常、がん幹細胞様細胞が分裂して二つの細胞を生み出すとき、一つの細胞はがん幹細胞様細胞に、もう一方の細胞は分化したがん細胞になります。しかし、悪性のがんでは、分裂により生み出された二つの細胞がいずれもがん幹細胞様細胞になり、がん幹細胞様細胞が分裂するたびに倍増されることで、がん幹細胞様細胞のみが増殖することが知られています。
本研究グループは、乳がん組織由来のがん幹細胞様細胞の培養に成功しました。その培養細胞を用いて、がん幹細胞様細胞内にある分子であるMICAL3の持つモノオキシゲナーゼ(注1)の活性化を介して、がん幹細胞様細胞が分裂ごとに倍増する仕組みを解明することに成功しました(図1)。
今後、MICAL3の機能を阻害する分子標的薬が開発できれば、がん幹細胞様細胞の倍増を阻止してがん幹細胞様細胞の増殖を抑制することが期待できます。
本研究は、社会医療法人社団正志会南町田病院、金沢医科大学などの協力も得て、共同研究により行われました。また本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的がん医療実用化研究事業「女性難治がんのPDXモデルを用いたがん微小環境を標的とした革新的診断治療法の構築」(研究開発代表者:後藤典子)、次世代がん医療創生研究事業「乳がんのがん幹細胞様細胞の維持機構を標的とした革新的治療法の開発」(研究開発代表者:後藤典子)、文部科学省の次世代がん研究シーズ戦略的育成プログラム「乳がん幹細胞維持の鍵シグナルを標的とする革新的分子標的薬の開発」研究開発代表者:後藤典子)などの支援を受けて行われました。
本研究成果は、国際学術雑誌「Proceedings of National Academy of Science」のオンライン版に掲載されました。
研究の背景
乳がんは、今や日本女性の11人に1人が一生に一度は罹患する、女性に最も多いがんであり、罹患数・死亡数ともに年々増加しています。乳がんは組織型によりいくつかのサブタイプに分類されます。エストロゲンもしくはプロゲステロンという女性ホルモン受容体を多く発現するルミナルタイプは、比較的予後が良いことが知られています。その他、HER2受容体が過剰発現するHER2陽性タイプ、二つの女性ホルモン受容体とHER2(注2)のいずれもが陰性のトリプルネガティブタイプに分類されます。トリプルネガティブタイプのがんは、良い分子標的薬などの治療薬が存在しないため、従来型抗がん剤であるタキサン系の抗がん剤が標準的に使用されています。しかし、再発が多く予後不良であることから、大きな問題になっています。
近年の研究の進展により、がん幹細胞様細胞が、がん組織内の全てのがん細胞の親であることが分かってきました。そのため、がん幹細胞様細胞をなくすことが、がんを根治させるために非常に重要です。トリプルネガティブタイプの乳がん患者では、従来型抗がん剤で治療してもがん幹細胞様細胞が残ってしまうことが、再発の温床となり、予後不良の原因と考えられています。しかし、がん幹細胞様細胞をなくす分子標的薬は未だ存在せず、有効な治療方法の開発が強く求められています。
がん幹細胞様細胞が分裂し、同時に分化して通常のがん細胞を生み出すことを繰り返すことで、がん組織は作られていきます。がん幹細胞様細胞は1回分裂するごとに二つの娘細胞を生み出します。通常、一つはがん幹細胞様細胞になります(自己複製という)が、もう一方は分化したがん細胞となります。これを「非対称性分裂」と言います(図2左)。しかし、悪性のがんでは、1回分裂するごとに娘細胞二つともが自己複製したがん幹細胞様細胞となって倍増する「対称性分裂」を繰り返すため、指数関数的にがん幹細胞様細胞が増え、がん幹細胞様細胞のみが増殖することが知られており、これが悪性化の原因になっています(図2右)。
そのため、対称性分裂を阻害できる薬剤があれば、がん幹細胞様細胞の倍増を阻止して、その増殖を抑制できると考えられますが、対称性分裂の仕組みが全く解明されてきていなかったことから、対称性分裂阻害剤の開発は不可能でした。
研究成果の概要
本研究グループは、患者からいただいた乳がん組織を培養し、培養条件を工夫することにより、がん幹細胞様細胞の培養に成功しました。また、患者由来の乳がん組織を免疫不全マウスに移植することにより、マウスの乳腺内でヒト乳がんを再現するpatient-derived xenograft (PDX)モデルマウスを構築してきました。これらを用いた解析の中で、がん幹細胞様細胞が周囲に存在するさまざまな細胞の影響(腫瘍微小環境という)を強く受けて、そこに棲み着くことを見いだしてきました。腫瘍微小環境には、がん幹細胞様細胞の子孫である通常のがん細胞も含まれます。
今回、腫瘍微小環境に存在する通常のがん細胞が、セマフォリン(注3)という細胞外分子を産生、分泌することを見いだしました。そしてセマフォリンががん幹細胞様細胞の細胞膜に存在する受容体ニューロピリン(注4)に結合することで、がん幹細胞様細胞内でモノオキシゲナーゼ酵素活性を持つMICAL3という分子を刺激することを明らかにしました。
元々ニューロピリンやMICAL3の仲間のMICAL1は、神経の軸索に発現していることが知られており、セマフォリンがニューロピリンに結合してMICAL1を活性すると、神経の軸索が反発する「反発シグナル」として知られていました。本研究では、神経の反発シグナルとは全く異なるがん幹細胞様細胞の機能に、同じシグナルが使われていることを世界で初めて明らかにしました。MICAL3が活性化すると、分裂により生み出された二つの細胞をがん幹細胞様細胞化させ、がん幹細胞様細胞が倍増し続けることを明らかにし、これまで全く不明であった、がん幹細胞様細胞の対称性分裂の仕組みを解明しました(図1)。
今後の展開
本研究により、MICAL3を介してがん幹細胞様細胞が分裂ごとに倍増する仕組みを解明したことで、今後、MICAL3の機能を阻害する分子標的薬の開発が進められることにつながると考えられます。これにより、がん幹細細様細胞の倍増を阻止して、その増殖を抑制することが期待できます。
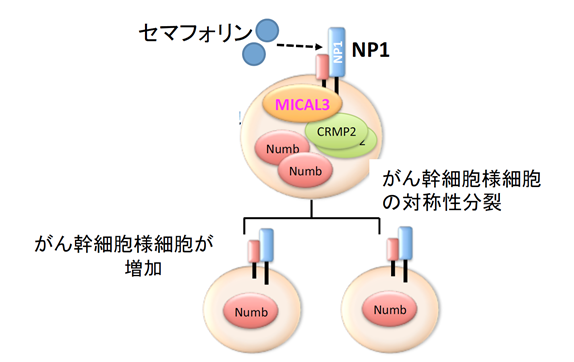
図1:乳がん幹細胞様細胞がMICAL3を介して自己複製する仕組み
腫瘍微小環境にある通常のがん細胞が細胞外因子セマフォリンを産生する。セマフォリンが、がん幹細胞様細胞にのみ発現するその受容体ニューロピリン1(NP1)に結合すると、細胞内に存在する分子MICAL3の持つモノオキシゲナーゼが活性化する。それを受けて、CRMP2が二量体化し、Numbたんぱく質が細胞内にたまってくる。これが引き金となり、分裂した際に二つの娘細胞とも、がん幹細胞様細胞になる(対称性分裂)。
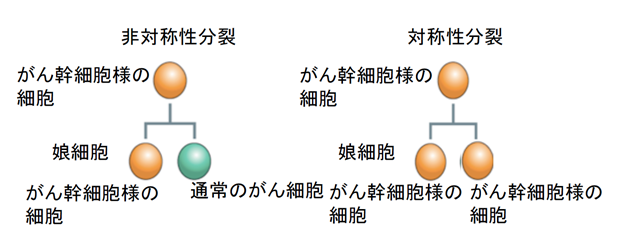
通常、がん幹様細胞細胞は分裂して娘細胞を生み出す際に、自分と同じがん幹細胞様細胞と、分化した通常のがん細胞を生み出す(非対称性分裂)。悪性のがんでは、がん幹細胞様細胞が分裂して生み出された娘細胞が二つともがん幹細胞様細胞となり(対称性分裂)、がん組織はがん幹細胞様細胞だらけになる。
掲載論文
雑誌名:Proceedings of National Academy of Science, USA
論文名:Semaphorin signaling via MICAL3 induces symmetric cell division to expand breast cancer stem-like cells.
(セマフォリンは、MICAL3を介して乳がん幹細胞様細胞の対称性分裂を引き起こし、がん幹細胞様細胞を増加させる)
著者名:Kana Tominaga, Hiroshi Minato, Takahiko Murayama, Asako Sasahara, Tatsunori Nishimura, Etsuko Kiyokawa, Hajime Kanauchi, Seiichiro Shimizu, Ayaka Sato, Kotoe Nishioka, Ei-ichi Tsuji, Masao Yano, Toshihisa Ogawa, Hideshi Ishii, Masaki Mori, Koichi Akashi, Koji Okamoto, Masahiko Tanabe, Kei-ichiro Tada, Arinobu Tojo and Noriko Gotoh
(富永香菜,湊宏,村山貴彦,笹原麻子,西村建徳,清川悦子,金内一,清水誠一郎,佐藤綾花,西岡琴江,辻栄一,矢野正雄,小川利久,石井秀始,森正樹,赤司浩一,岡本康司,田辺真彦,多田敬一郎,東條有伸,後藤典子)
用語解説
注1 モノオキシゲナーゼ
酸化還元酵素の一つで、酸素分子から一つの酸素原子を基質分子内に取り入れ、もう一つの酸素原子を還元して水を生成する反応を触媒する。
注2 HER2
がん細胞膜に存在する受容体。乳がんの一部にHER2ががん細胞に過剰に発現しているタイプ(HER2陽性サブタイプ)では、がん細胞が増殖する指令が入る。HER2に対する抗体は、その増殖の指令を阻害するため、このタイプの乳がんの治療に用いられる。
注3 セマフォリン
細胞外に分泌する因子。
注4 ニューロピリン
細胞膜に存在し、セマフォリンと結合する受容体。細胞外にあるセマフォリンがニューロピリンに結合すると、細胞内でニューロピリンと結合しているMICAL3が持つモノオキシゲナーゼ酵素を活性化させる。
本件に関するお問い合わせ先
研究内容に関すること
金沢大学がん進展制御研究所/新学術創成研究機構 教授
後藤 典子(ごとう のりこ)
電話番号:076-264-6731
E-mail:ngotoh●staff.kanazawa-u.ac.jp(●を@に置き換えてください)
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
電話番号:03-6870-2221
E-mail:cancer●amed.go.jp(●を@に置き換えてください)
広報担当
国立大学法人金沢大学 総務部広報室広報係
嘉信 由紀(かしん ゆき)
電話番号:076-264-5024
E-mail:koho●adm.kanazawa-u.ac.jp(●を@に置き換えてください)
国立大学法人金沢大学 医薬保健系事務部薬学・がん研支援課企画総務係
永平 智子(ながひら ともこ)
電話番号:076-234-6858
E-mail:y-somu●adm.kanazawa-u.ac.jp(●を@に置き換えてください)
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511
E-mail:ncc-admin●ncc.go.jp(●を@に置き換えてください)
