進行卵巣癌の悪性化に関わる新たなメカニズムを解明腹膜環境から化学療法抵抗性の原因
2020年1月29日
名古屋大学
国立がん研究センター
名古屋大学大学院医学系研究科産婦人科学の吉原 雅人 大学院生、梶山 広明 准教授、吉川 史隆 教授、同大ベルリサーチセンター協同研究講座の那波 明宏 特任教授、国立がん研究センター研究所の山本 雄介 主任研究員、アデレード大学のCarmela Ricciardelli(カルメラ リチャーデリ)博士らの研究グループは、進行卵巣癌の悪性化に関わるメカニズムを解明し、腹膜環境から新たな化学療法に対する抵抗性の原因を明らかにしました。
卵巣癌は婦人科領域における最も予後不良な癌の一つであり、腹膜播種注1を伴う特徴的な進行の形を示します。特に、進行・再発した腫瘍では、プラチナ製剤注2を中心とした化学療法への抵抗性を獲得することで、難治性癌(治りにくい癌)へと変化します。本研究では、腹膜播種における卵巣癌細胞の生存を支える「土壌」、すなわち環境としての腹膜に着目し、腹膜の特徴的な構成要素としての腹膜中皮細胞注3に焦点を当て、卵巣癌細胞との間で行われる異種細胞間のクロストーク注4と化学療法への抵抗性の関連について検討しました。
卵巣癌の腹膜播種では、腹膜中皮細胞が腫瘍内へと侵入し、TGF-β1注5という癌細胞由来の因子により間葉転換注6を引き起こすことで、卵巣癌に関連する腹膜中皮細胞(OCAM)へと変化することを見出しました。また、OCAMと接することで、卵巣癌細胞はAktシグナル注7の活性化を通してプラチナ製剤への抵抗性を獲得することを発見しました。こうしたメカニズムの要因となるOCAMを治療の標的とすることは、今後、腹膜播種を伴う進行卵巣癌における新たな治療法になると考えられます。
本研究成果は、2020年1月24日付け(欧州時間)国際医学総合誌「International Journal of Cancer」(電子版) に公開されました。
本研究は、日本学術振興会科学研究費助成事業挑戦的萌芽研究(課題番号:16K15704)、基盤研究(B)(課題番号:17H04338)の助成を受けました。
ポイント
- 卵巣癌は多くが腹膜播種を伴う進行期に発見され、難治性化する予後不良な癌腫である。化学療法への抵抗性が最大の予後不良になる因子であるが、仕組みに関しては不明な点が多い。
- 本来はバリア機能を果たす腹膜表面の中皮細胞が、卵巣癌細胞から放出される液性因子TGF-β1により、卵巣癌に関連する腹膜中皮細胞(OCAM)へと変化し、卵巣癌細胞と共に浸潤することで腹膜播種の微小環境を形成することを示した。
- OCAMに発現するフィブロネクチン注8が、卵巣癌細胞内のAktシグナルを活性化し、プラチナ製剤に対するアポトーシス注9への抵抗性を獲得する。
背景
卵巣癌は婦人科領域における最も予後不良な癌の一つです。多くの症例では、腹膜播種という、腹膜の壁全体に多発性の微小な転移を伴う特徴的な進行の形を示します。腹膜播種は、プラチナ製剤を中心とした化学療法を含む初回治療への反応性は比較的良好ですが、その後、高い確率で腹腔内に再発性の腫瘍が出現し、さらに化学療法への抵抗性を獲得することで、難治性癌(治りにくい癌)へと変化していきます。こうした化学療法への抵抗性を獲得するメカニズムに関しては、これまでに幾つかの報告があるものの、依然として不明な点も多く、新たなメカニズムの解明や新規治療標的の探究が求められています。
研究グループは、卵巣癌の腹膜播種における癌細胞の生存を支える「土壌」、すなわち、環境としての腹膜に着目し、腹膜の特徴的な構成要素として腹膜中皮細胞に焦点を当てて研究をしました。そして、これまでに卵巣癌細胞から放出される液性因子の一つであるTGF-β1により、卵巣癌に協力的な卵巣癌に関連する腹膜中皮細胞(OCAM)が出現し、卵巣癌の接着および増殖を促進することを明らかにしました。一方で、腹膜播種という腫瘍が構築する微小環境においてOCAMがどのように進展し、また、卵巣癌の化学療法への抵抗性を獲得するのにどう関与するのかは明らかにされていませんでした。本研究では、OCAMが卵巣癌細胞と共に腹膜播種という微小環境を構成するための環境構築を行い、さらに、卵巣癌細胞のプラチナ製剤への抵抗性の獲得に関与する可能性を新たに検討しました。
研究成果
卵巣癌の腹膜播種の組織では、中皮細胞の標識マーカーの一つであるcalretininという分子(陽性の細胞)が、腹膜の表面の単層上皮層から腫瘍の微小環境内へと連続して存在することを確認しました。これらの変化は、主に卵巣癌から放出される液性因子であるTGF-β1により誘導される腹膜中皮細胞の間葉転換に基づくことを示し、研究グループは、これらの細胞を卵巣癌に関連する腹膜中皮細胞(OCAM)と定義しました(図1)。
図1
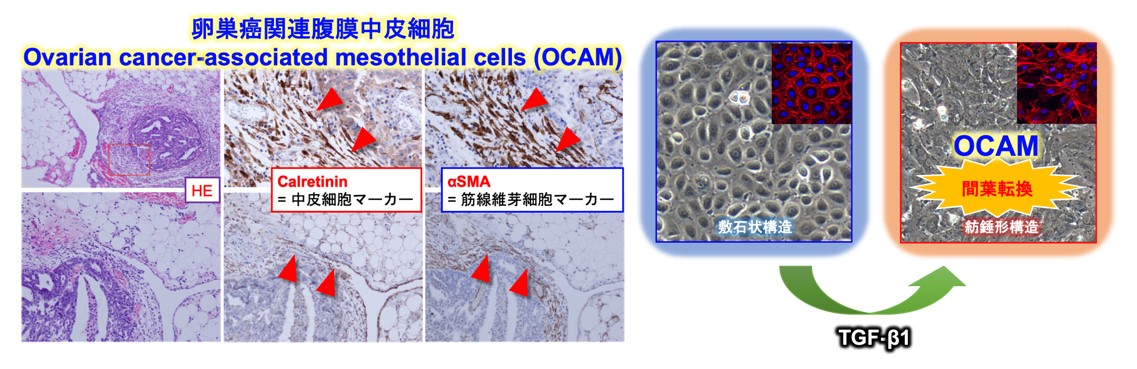
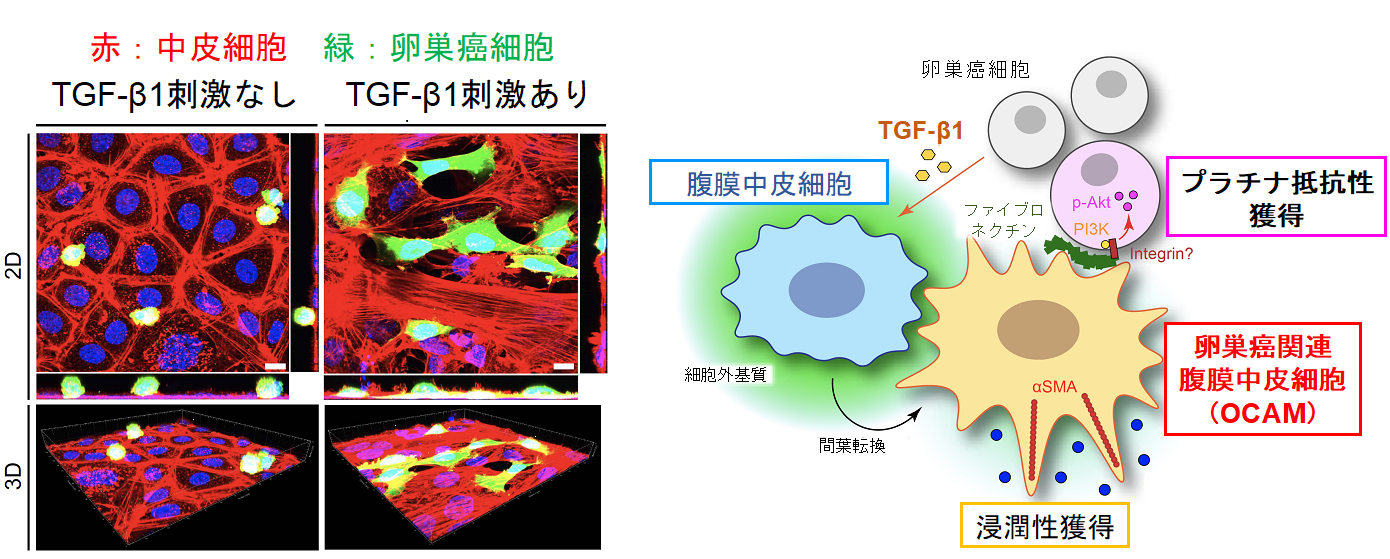
TGF-β1刺激後の腹膜中皮細胞を用いて卵巣癌細胞株との共培養を行ったところ、対照と比較して、明らかににシスプラチンへの抵抗性が増強していることが判明しました。RNAマイクロアレイ注10により、網羅的にメカニズムの探索を行った結果、卵巣癌細胞内のAktシグナル活性化が、プラチナ製剤への抵抗性を獲得する原因と同定されました。さらに、上流のシグナルを網羅的にプロテオーム解析注11をして調査したところ、TGF-β1の刺激により、腹膜中皮細胞上に強発現したフィブロネクチンが卵巣癌細胞のAktシグナル活性を生み出す候補として浮上しました。siRNAを用いて、TGF-β1刺激を行った腹膜中皮細胞上のフィブロネクチンを減少させると、共培養実験において卵巣癌細胞のAktシグナル活性は低下し、プラチナ製剤への抵抗性が改善することが判明しました。一方、TGF-β1刺激により、マウスの腹膜上にもフィブロネクチンの発現が増えることを同定し、さらに、腹膜播種のモデルとして卵巣癌細胞を腹腔内に注入したところ、TGF-β1前投与を行ったグループでの腹膜に生着した卵巣癌細胞において、Aktシグナル活性の亢進を確認しました。
以上の結果から、癌に関連する腹膜中皮細胞は、フィブロネクチンを介して卵巣癌細胞のAktシグナルを活性化させることにより、プラチナ製剤への耐性を誘導する可能性をもつことが明らかとなりました(図2)。
図2
今後の展開
今回の研究を通して、腹膜播種の微小環境における卵巣癌に関連する腹膜中皮細胞(OCAM)と卵巣癌細胞の織りなす相互関係が、腫瘍の進展を促進し、一部のプラチナ製剤への抵抗性の原因になっている可能性が分かりました。したがって、これらのメカニズムの外因的要因である環境としてのOCAMを治療の標的とすることは、腹膜播種を伴う進行卵巣癌における新たな治療戦略になると考えます。
用語説明
注1 腹膜播種
腹膜を覆う腹膜表面へ腫瘍細胞が「種を播いた」ように散布し、腹膜に転移巣を形成する卵巣癌に特徴的な転移形態。
注2 プラチナ製剤
抗腫瘍薬の一つ。シスプラチンやカルボプラチンなどが代表的である。
注3 腹膜中皮細胞
腹膜全体の表面を覆う単層の上皮細胞。
注4 異種細胞間のクロストーク
卵巣癌細胞と腹膜中皮細胞の間で行われる異なる種類の細胞同士の相互作用。
注5 TGF-β1
トランスフォーミング増殖因子-β1。上皮間葉転換に関わる代表的な因子であり、細胞の分化や増殖にも関与する。
注6 間葉転換
接着能力を失い、動きやすい挙動を示すように細胞が変化する事象。
注7 Aktシグナル
タンパク質の合成や細胞増殖および生存など、基本的な細胞動態に関与するシグナル経路。
注8 フィブロネクチン
細胞膜表面に存在する糖タンパク質。細胞接着やシグナル伝達に関与する。
注9 アポトーシス
プログラムされた能動的な細胞死。
注10 RNAマイクロアレイ
遺伝子の発現パターンを網羅的に調べる手法。
注11 プロテオーム解析
タンパク質の発現を網羅的に調べる手法。
発表雑誌
掲雑誌名
International Journal of Cancer(欧州時間1月 24日の電子版)
論文タイトル
Ovarian cancer-associated mesothelial cells induce acquired platinum-resistance in peritoneal metastasis via the FN1/Akt signaling pathway
著者
Masato Yoshihara1, *Hiroaki Kajiyama1, Akira Yokoi1, Mai Sugiyama2,3, Yoshihiro Koya2,3, Yoshihiko Yamakita3, Wenting Liu3, Kae Nakamura2,3, Yoshinori Moriyama1, Hiroaki Yasui1, Shiro Suzuki1, Yusuke Yamamoto4, Carmela Ricciardelli5, Akihiro Nawa2,3, Kiyosumi Shibata6, and Fumitaka Kikkawa1
所属
1. Department of Obstetrics and Gynecology, Nagoya University Graduate School of Medicine, 2. Bell Research Center-Department of Obstetrics and Gynecology Collaborative Research, Nagoya University Graduate School of Medicine, 3. Bell Research Center for Reproductive Health and Cancer, 4. Division of Molecular and Cellular Medicine, National Cancer Center Research Institute, 5. Discipline of Obstetrics and Gynaecology, Adelaide Medical School, Robinson Research Institute, University of Adelaide. 6. Department of Obstetrics and Gynecology, Fujita Health University Bantane Hospital.
DOI
https://doi.org/10.1002/ijc.32854
問い合わせ先
名古屋大学医学部・医学系研究科総務課総務係
電話番号:052-744-2228 FAX:052-744-2785
E-mail:iga-sous●adm.nagoya-u.ac.jp(●を@に置き換えてください)
国立がん研究センター 企画戦略局 広報企画室
電話番号:03-3542-2511(代表) FAX:03-3542-2545
E-mail:ncc-admin●ncc.go.jp(●を@に置き換えてください)
