細胞不死化酵素「テロメラーゼ」に新しいがん化機能を発見
全く新しいタイプのがん治療法の開発を期待
2020年3月25日
国立研究開発法人国立がん研究センター
金沢大学
東北大学
国立研究開発法人日本医療研究開発機構
発表のポイント
- 正常細胞を不死化する酵素として知られるテロメラーゼ注1に細胞不死化とは全く別の新たながん化機能があることを明らかにしました。
- さらに、この新たな機能のスイッチがどのように入るか、その機序の解明にも成功しました。
- テロメラーゼの新たな機能を標的にしたがん治療に対する薬剤の開発が期待されます
概要
国立研究開発法人国立がん研究センター 研究所 がん幹細胞研究分野の増富健吉分野長、金沢大学附属病院総合診療部の山下太郎准教授および医薬保健研究域医学系の金子周一教授、東北大学大学院医学系研究科抗体創薬研究分野の加藤幸成教授らの共同研究グループは、細胞不死化酵素として知られているテロメラーゼに、細胞のがん化に深く関わる別の新しい機能があることを明らかにしました。さらに、この新たな機能は、肝臓がんや膵臓がんのうちでも悪性度が高いものほど活発であること、また、その機能を保持するスイッチのオン・オフに関する機序の解明にも成功しました。これらの知見をもとに、テロメラーゼの新たな機能を抑制する全く新しいタイプのがん治療法の開発が期待されます 本研究成果は、2020年3月25日に英国科学誌『Nature Communications』に掲載されました。
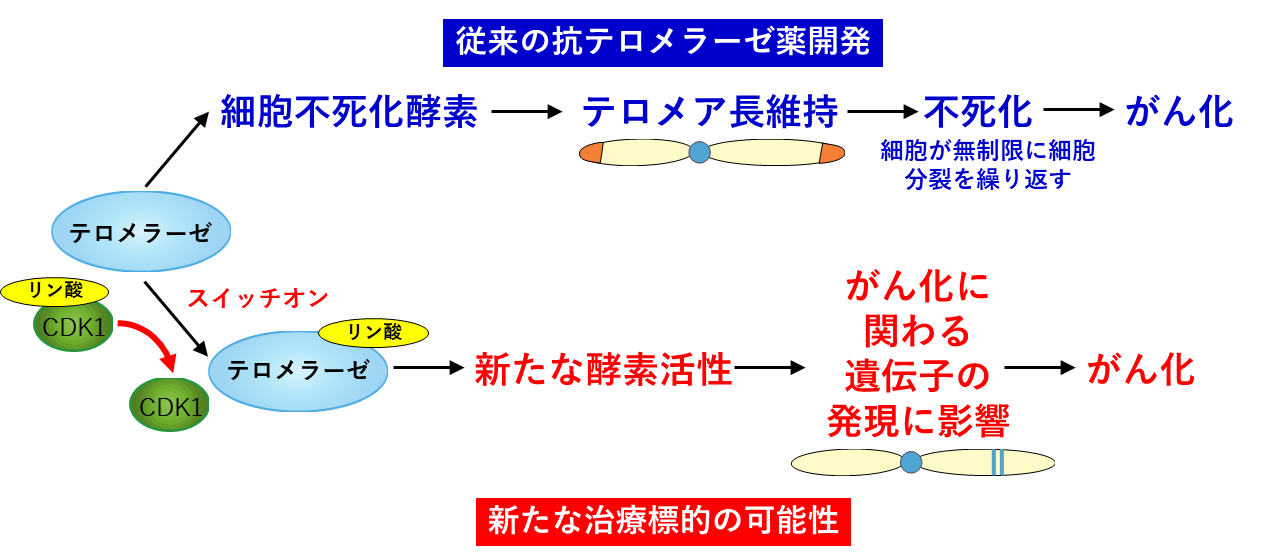
図1 テロメラーゼのがん化機能
青)細胞が無制限に細胞分裂できる不死化機能によりがん化が進む。
赤)分子CDK1によりスイッチが入り、がん化が進む新たな機能。新たな治療法の開発が期待される。
背景
がん細胞の最大の特徴の一つとして、何度でも細胞分裂を続けることができるという性質があります。この「がん細胞が無制限に細胞分裂できる能力」のことを専門用語では「細胞不死化能」といいます。一方、正常な細胞は、細胞分裂の回数に制限があり、無制限に細胞分裂を繰り返すことはできません。このように、がん細胞には不死化能があるのに対して、正常細胞には不死化能がないことが大きな違いであったため、約30年にわたり多くの研究者によって、がん細胞はどのようにして細胞不死化能を獲得するのかという研究が行われ、1997年に細胞不死化酵素としてテロメラーゼという分子が発見されました。その後も、世界中のがん研究者らは、細胞不死化能の有無に着目して、テロメラーゼを阻害する薬剤の開発を進めてきましたが、がん治療として十分に効果がある薬剤は開発できませんでした。
また、近年、世界中のがん研究者が参加する国際共同研究による、「がん全ゲノム解読」によりテロメラーゼが大変重要であることが改めて証明されることとなりました。例えば、C型肝炎関連肝臓がんなどでは、患者検体を用いた大規模ゲノム解析で、約7割の症例でテロメラーゼが発がん過程における最も重要な分子であることが報告されています。テロメラーゼは、もともと細胞不死化酵素として同定された分子であることから、これまでは、このテロメラーゼの役割は唯一、「細胞に不死化能を付与する」ものと理解されてきましたが、「テロメラーゼの細胞不死化能を阻害する」という考え方に基づくと、がん治療薬の開発が順調に進展しなかったことなどから、テロメラーゼには別の働き(新たな機能)があるのではないかと考える研究者らが出てきました。
このように、がん遺伝子情報の大規模な解析から、がん治療に対する標的としてテロメラーゼ分子の重要性が再認識されました。一方で、過去20年以上にわたる、細胞不死化酵素としてのテロメラーゼを標的としたがん治療薬の開発戦略は行き詰まっており、新たな分子機序の発見が待ち望まれています。
このような背景の下、本共同研究グループは、1)新たなテロメラーゼの分子機序の探索、2)テロメラーゼの新たな機能が、がん細胞で活発に作用しているのか、3)どのようにしてテロメラーゼの新たな機能のスイッチが入るのか、に関して研究を進めてきました
研究内容
細胞不死化酵素として知られるテロメラーゼは、テロメア注2の長さを維持することで細胞に不死化能を付与することが知られてきました。しかし、最近では、テロメラーゼにはこの細胞不死化酵素としての役割以外にも異なる酵素活性(テロメラーゼの新たな機能)が存在することが示唆されてきましたが、その詳細は分かっていませんでした。
本共同研究グループは、テロメラーゼとの関連が示されている肝臓がんと膵臓がん患者からの手術検体等を用いた解析を行いました。その結果、テロメラーゼの新たながん化機能が肝臓がんや膵臓がんのうちでも悪性度が高いものほど活発であり、この機能の作用が強いほど予後が悪いことを明らかにしました(図2,図3)。
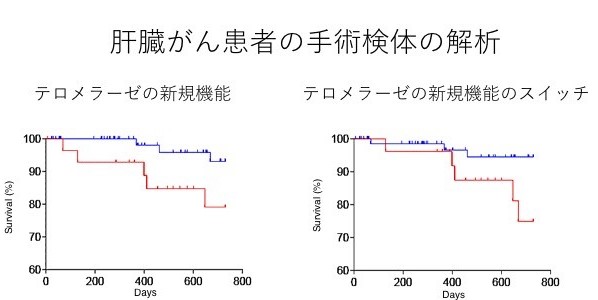
図2:肝臓がん患者100例の手術検体を用いた解析
左:テロメラーゼの新たな機能の作用が強い患者群(赤色)とその作用が弱い患者群(青色)では、新たな機能の作用が強い患者群(赤色)の方が統計学的に有意に予後が悪かった。右:テロメラーゼの新規機能のスイッチを入れる分子であるCDK1の作用が強い患者群(赤色)とその作用が弱い患者群(青色)では、CDK1の作用が強い患者群(赤色)の方が統計学的に有意に予後が悪かった。
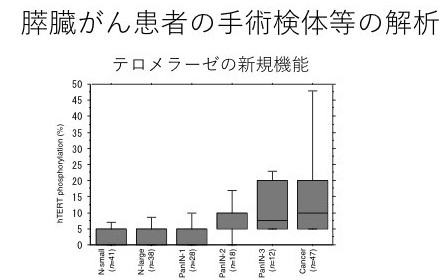
図3:膵臓がん患者約50例の手術検体等を用いた解析
膵臓がんでは正常(左側)から前がん病変、がん(右側)へと病気が進むにつれて、テロメラーゼの新たな機能が活発に作用していることが確認された。
このテロメラーゼの新たな機能のスイッチがどのように制御されるのかについて調べたところ、CDK1注3という分子がテロメラーゼをリン酸化注4することでスイッチを入れていることを見いだしました。そこで、テロメラーゼの新たな機能のスイッチを入れる分子であるCDK1の機能を阻害してみると、細胞不死化酵素としての機能には何の影響も及ぼさない一方、テロメラーゼの新たな機能は完全に阻害されることを確認しました(図4)。これらのことから、このスイッチは、テロメラーゼの新たな機能のオン、オフをコントロールしていることが確認できました。これまでは、テロメラーゼは、細胞不死化酵素としてがん細胞のがん細胞たる特徴を制御していると考えられていましたが、今回の発見から、テロメラーゼの新たな機能が細胞のがん化に何らかの影響を及ぼしているという疑問が出てきたため、その疑問に対する答えを探すために研究を続けました。最近では、遺伝子編集技術注5を用いることで、細胞内の任意の遺伝子を改変できることから、この技術を用いて、テロメラーゼの新たな機能のみが働かなくなった細胞を作製しました。その結果、この細胞では、正常な細胞と同じようにマウスで腫瘍を作らなくなりました(図5)。これらの結果を総合的に判断すると、「テロメラーゼの新たな機能」だけを働かなくする(スイッチをオフにする)だけで、もはやがん細胞としての特徴を持たなくなってしまう。
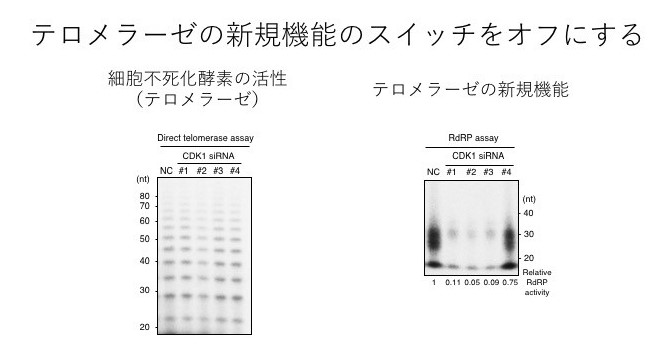
図4:テロラーゼが持つ機能の検証 テロメラーゼの新たな機能のスイッチを入れる分子であるCDK1の機能を抑えて、細胞不死化酵素と新たな機能のそれぞれの作用の強さを検証した。いずれのパネルも#1,#2,#3のレーンが効率的にCDK1の機能が押さえ込まれている細胞を示す
左:CDK1の機能を抑えても、細胞不死化酵素の作用には影響がない。
右:CDK1の機能を抑えると、テロメラーゼの新たな機能の作用が極端に弱まる。 という結論が導き出されました。
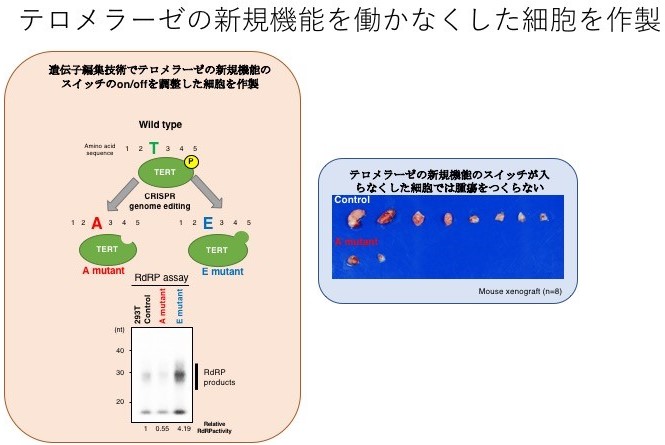
図5:遺伝子編集技術を用いた、テロメラーゼの新たな機能のスイッチが入らなくなった細胞の作製
左:赤色で示した部分(A)が遺伝子編集技術で改変した部分であり、この細胞ではどれほどCDK1が作用を発揮しようとしても、テロメラーゼの新たな機能のスイッチは入らなくなっている。
右:この細胞(A細胞)をマウスに移植してももはや腫瘍を作ることはなくなった。
展望
近年の世界的規模による、がん遺伝子情報の大規模な解析によって、多くのがん種でテロメラーゼ分子のがん治療に対する標的としての重要性が再認識されてきた一方で、過去20年以上にわたって行われてきた細胞不死化酵素としてのテロメラーゼを標的とした治療薬の開発は、残念ながら不成功に終わっています。このような中で、本研究により、テロメラーゼの新たな機能が、これまで想定していなかった分子群の関与により制御され、細胞のがん化に深く関与していることを発見したことは、肝炎関連肝臓がんや膵臓がんでの全く新しいがん治療法の開発につながると期待されます。
さらには、テロメラーゼの新たな機能は広くがん種横断的に関わる可能性が考えられることから、肝臓がんや膵臓がんのみならず、多くのがん種に効果を発揮する新たな薬剤の開発につながる可能性も期待されます。
共同研究者
国立研究開発法人国立がん研究センター研究所
- がん幹細胞研究分野
特任研究員 安川 麻美
外来研究員 安藤 吉成
研究員 町谷 光弘
分野長 増富 健吉 - 希少がん研究分野
特任研究員 塩澤 久美子
分野長 近藤 格
国立大学法人金沢大学
- 附属病院総合診療部
准教授 山下 太郎 - 医薬保健研究域医学系
教授 金子 周一
地方独立行政法人東京都健康長寿医療センター
- 病理診断科
医長 松田 陽子
国立研究開発法人理化学研究所
- 生命機能科学研究センター
研究員 庄司 志咲子
チームリーダー 白水 美香子 - 生命医科学研究センター
研究員 森岡 勝樹
開発ユニットリーダー 川路 英哉 - 予防医療・診断技術開発プログラム
プログラムディレクター 林崎 良英 - ライフサイエンス技術基盤研究センター (研究当時)
研究員 阿部 高也
チームリーダー 古田 泰秀
国立大学法人東北大学大学院
- 医学系研究科 抗体創薬研究分野
助教 山田 慎二
准教授 金子 美華
教授 加藤 幸成
発表論文
雑誌名
Nature Communications
タイトル
CDK1 dependent phosphorylation of hTERT contributes to cancer progression
著者
Yasukawa Mami, Ando Yoshinari, Yamashita Taro, Matsuda Yoko, Shoji Shisako, Morioka Suimye Masaki, Kawaji Hideya, Shiozawa Kumiko, Machitani Mitsuhiro, Abe Takaya, Yamada Shinji, Kaneko K. Mika, Kato Yukinari, Furuta Yasuhide,Kondo Tadashi, Shirouzu Mikako, Hayashizaki Yoshihide, Kaneko Shuichi, Masutomi Kenkichi
DOI
10.1038/s41467-020-15289-7
掲載日
日本時間2020年3月25日
研究費
-
科学研究費助成事業 平成27年度挑戦的萌芽研究
-
国立がん研究センター研究開発費
-
国立研究開発法人日本医療開発機構
平成29年度 創薬等先端技術支援基盤プラットフォーム(BINDS)
-
国立研究開発法人日本医療開発機構
平成30年度 肝炎等克服実用化研究事業
-
公益財団法人第一三共生命科学研究振興財団 第35回(平成29年度)研究助成
用語解説
注1 テロメラーゼ
染色体末端に存在する構造であるテロメアを伸長させる酵素。テロメアを伸長させることで細胞の寿命を制御し、細胞が何度でも繰り返し分裂が可能になる能力(細胞不死化能)を与えると考えられている。細胞不死化能はがん細胞の特徴の一つであり、細胞ががん化する際に必要な過程と考えられている。
注2 テロメア
染色体の末端にある構造で、染色体末端を保護する機能を持つ。テロメアが失われると、染色体融合といった構造異常を誘発する。正常細胞は分裂するたびにテロメアがわずかに短縮し、ある一定長以上より短くなると増殖を停止し、細胞老化を引き起こす。しかし、がん細胞のように細胞分裂が盛んな細胞では、テロメアを伸長させる酵素であるテロメラーゼの発現が上昇するなどさまざまな分子機構によってテロメアの短縮を防いでいる。
注3 CDK1
Cyclin Dependent Kinase-1(サイクリン依存性キナーゼ−1)の略。細胞はDNA複製とDNA分配とを繰り返して細胞分裂することが知られている。複製と分裂の繰り返しの単位のことを細胞周期と呼び、大きく分けて4つの時期に分けることができる。細胞周期のそれぞれの時期に、規則正しく正確にタンパク質の機能を発揮(スイッチオン)させたり機能を抑制(スイッチオフ)させることで、正確な細胞分裂が保証されている。CDK1は細胞周期の分裂期にのみ作用を発揮するキナーゼであり、キナーゼは作用する標的のタンパク質のリン酸化を司っている。
注4 リン酸化
タンパク質はその機能を発揮したり機能を停止したりするために、リン酸化という化学修飾を受ける。タンパク質にリン酸基を付ける化学修飾のことをリン酸化、逆にリン酸基を外す化学修飾のことを脱リン酸化という。リン酸基をタンパク質に付加する化学修飾を行う酵素を総称してキナーゼという。
注5 遺伝子編集技術
ゲノム編集技術ともいう。大腸菌などの原核生物が、元来、その生命現象の維持のために有している機能として外来の核酸を切断する機能がある。原核生物の免疫機能と捉えることができるが、本質的には外来の遺伝子情報(核酸)を切断するヌクレアーゼという原核生物由来の酵素を、科学的技術として応用したのが遺伝子編集技術である。ヌクレアーゼを用いて、さまざまな生物の遺伝子の特定部位を切断したり置き換えたりすることが可能になった。最も汎用されている技術としてはCRISPR/Cas9というヌクレアーゼを用いて遺伝子編集を行う技術であり、本研究においてもこの方法を用いた。
問い合わせ先
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表) FAX:03-3542-2545
Eメール:ncc-admin●ncc.go.jp(●を@に置き換えてください)
金沢大学
総務部広報室広報係
電話番号:076-264-5024 FAX:076-234-4015
Eメール:koho●adm.kanazawa-u.ac.jp(●を@に置き換えてください)
東北大学
東北大学大学院医学系研究科・医学部広報室
電話番号:022-717-7891 FAX:022-717-8187
Eメール:pr-office●med.tohoku.ac.jp(●を@に置き換えてください)
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
戦略推進部 感染症研究課
肝炎等克服実用化研究事業
電話番号:03-6870-2225 FAX:03-6870-2243
Eメール:hepatitis●amed.go.jp(●を@に置き換えてください)
