がんの臨床試験情報を網羅的に検索できる唯一のサイトがん情報サービス「がんの臨床試験を探す」の機能拡充jRCTのデータも含めて国内のすべての臨床試験が検索可能に
2020年3月27日
国立研究開発法人 国立がん研究センター
国立研究開発法人国立がん研究センター(理事長:中釜斉、所在地:東京都中央区)は、種類や制度ごとに各所に分散しているがんの臨床試験の実施情報を網羅的に収集し、一般の方でも様々な条件で検索できるデータベースを構築し、臨床試験に関する解説と合わせウェブサイト「がん情報サービス(がん情報サービスにリンクします。)」で公開しています。
本サイトでは2006年より情報提供を開始し、順次機能追加を行ってきましたが、このたび、新たに臨床研究法の下で行われる臨床試験等が登録されているjRCT(Japan Registry of Clinical Trials:臨床研究実施計画・研究概要公開システム)のデータを追加し、日本国内で行われているすべてのがんの臨床試験情報を検索できるようになりました。本サイトでは、分類(カテゴリー)別での検索形式に加え、コンピューターと対話しながら検索するチャット形式でも検索できます。
背景
臨床試験とは、研究段階の医療の有効性や安全性を評価するもので、科学的根拠に基づいた観点で最良の医療であり、保険診療で受けることのできる標準治療の確立を目的に実施されます。臨床試験への参加は、新しい治療を受けられる可能性がある一方で、予期せぬ副作用など不利益を被る可能性があることも考えられ、個々の患者さんに適した臨床試験の検討、参加できるかどうかの判断は医師を通して行われます。また、患者さん自身も試験を受ける前に、その内容やメリット・デメリットを理解する必要があります。
臨床試験は、国内では未承認でも海外では承認されている抗がん剤の投与を受けられる最善の機会となるため、最近では、患者さんやご家族自身が選択可能な標準治療実施後のさらなる選択肢を探す目的で情報収集することが少なくありません。しかし、臨床試験は種類・制度などが複雑な上に、実施情報は各所に分散し医師向けにまとめられているものが多く、一般の方が情報収集することは容易ではありません。
がん情報サービスは、患者さんやご家族などが臨床試験を受ける前に知っておく必要のある基礎知識が得られ、また国内での臨床試験情報を網羅的に検索できる唯一のサイトです。
がん情報サービス 「臨床試験について」の概要
臨床試験、治験などの研究段階の医療について、「臨床試験とは何か」をはじめとして、「受けるにはどうしたらよいのか」、「だれがどこで受けられるのか」、そして「どのような種類があるのか」などについてわかりやすく紹介しています。
- 臨床試験のQ&A:基礎知識
- 臨床試験のQ&A:参加に際して
- 研究段階の医療(臨床試験、治験など) 基礎知識
- 臨床試験の詳しい情報(リンク集)
- がんの臨床試験を探す[機能拡充]
「がんの臨床試験を探す」 [機能拡充ページ]
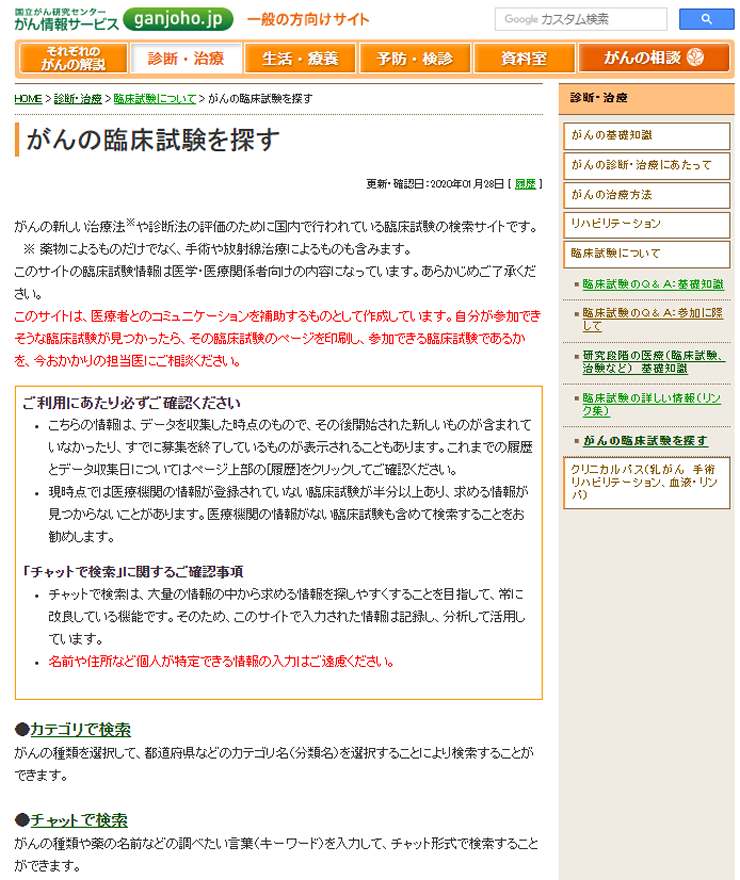
日本全国で実施されているがんの臨床試験の情報について、大学病院医療情報ネットワーク研究センター(通称:UMINセンター)、一般財団法人日本医薬情報センター(JAPIC)、公益社団法人日本医師会治験促進センターから提供いただき、情報を整理し、2006年より公開しています。2013年には、より様々な条件で検索できるシステム「がんの臨床試験を探す」を構築し、データベースに含まれる情報の拡充を進めてきました。2017年より、臨床試験情報をがんの種類、都道府県、実施状況での絞り込みに加えて、「先進医療A、先進医療B、主たる治験、人道的見地からの治験(拡大治験)、患者申出療養」それぞれについてさらに絞り込んで探す機能を追加しました。さらに2019年5月にはより細かいがんの種類により検索可能となるように検索システムを変更し、同12月には利用者がキーワードを入力し、システムとチャット形式(コンピューターとの対話)で検索を進めることが出来る「チャットで検索」機能を追加しています。2020年3月よりjRCTのデータも検索対象に追加しました。なお、データ更新は2020年4月以降、当面2カ月に1度程度を予定しています。
今回追加したデータソース jRCT(Japan Registry of Clinical Trials:臨床研究実施計画・研究概要公開システム)[機能拡充]
jRCTは2018年に施行された臨床研究法に基づき厚生労働省が新設したデータベースで、臨床研究法の下で行われる臨床試験(特定臨床研究)はこのデータベースへの登録が義務づけられています。現在は特定臨床研究に加え、治験・医師主導治験や再生医療等研究の登録もなされています。今回の機能拡充により、「がんの臨床試験を探す」は日本国内で行われているがん領域の治験・臨床試験のすべてを網羅することとなり、これらのデータベースでは検索が容易ではない先進医療・患者申出療養・拡大治験等の情報も含め、ワンストップで必要な情報を抽出することができます。
このページで探すことのできる情報
国内で行われている、以下の臨床試験や先進医療を検索することができます。
- 企業治験
- 医師主導治験
- 拡大治験
- 先進医療A
- 先進医療B
- 医師・研究者主導臨床試験
- 患者申出療養
データ協力
本ページでは、次の組織のご協力を得て、各臨床試験登録システムに登録・公開されている臨床試験に関する情報を提供しています。各々のデータベースを利用する際の注意事項は、各々のウェブサイトにアクセスしてご確認ください。
臨床試験全般
- jRCT(臨床研究実施計画・研究概要公開システム)(外部サイトへリンクします)
- 大学病院医療情報ネットワーク研究センター(通称:UMINセンター)(外部サイトへリンクします)
- 一般財団法人日本医薬情報センター(JAPIC)(外部サイトへリンクします)
- 公益社団法人日本医師会治験促進センター(外部サイトへリンクします)
先進医療A、先進医療B、患者申出療養、主たる治験、拡大治験の情報については次のウェブサイトで公開されているものを取り込んでいます。
先進医療A、先進医療B
患者申出療養、主たる治験、拡大治験
「チャットで検索」機能の紹介
利用者が検索したい事項を入力し、コンピューターと対話しながら検索するチャット形式によって臨床試験を絞り込んでいくことが出来る機能。パソコン及びスマートフォンでも検索が可能。
最初の画面

最初に「肺癌」と入力し、続いて「東京都」と入力した場合

続いて「国立がん研究センター」を選択した場合
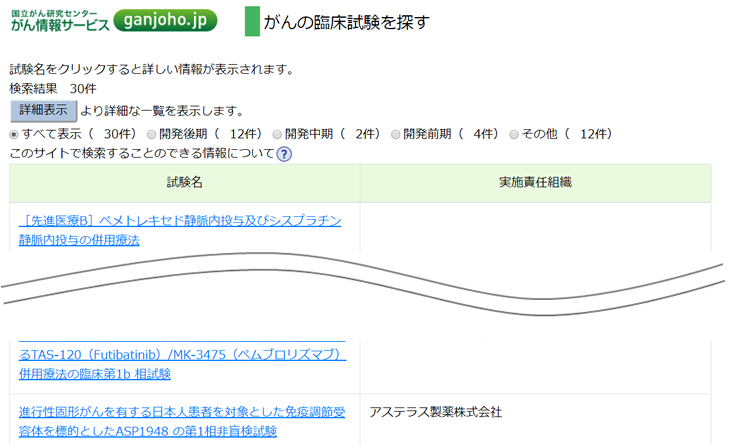
続いて「JCOG1701: 非小細胞肺癌に対する…試験」を選択した場合
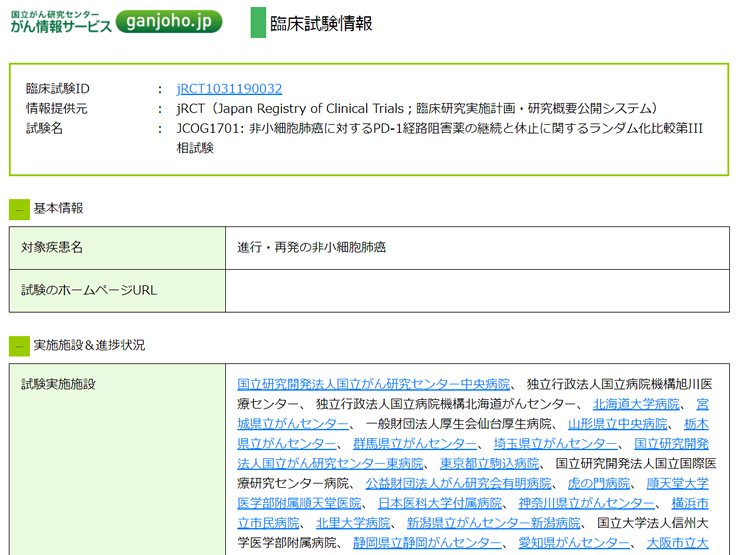
がん情報サービス内の関連する情報
治験と臨床試験、臨床研究など、臨床試験の基礎知識をQ&Aでまとめています。
臨床試験へ参加に関する基礎知識をQ&Aでまとめています。
研究段階の医療を担当医から提案されたり、ご自身で興味をもったり、患者さんやご家族が研究段階の医療を考える場面がきたときに、その内容を理解するために必要な基本的なことを簡潔にまとめて紹介しています。
医学・医療関係者等、専門家向けの臨床試験、治験、医薬品に関する外部サイトを紹介しています。
臨床試験の基本的な仕組みから、新しい治療法を必要とする患者さんが研究段階の医療にアクセスできるように設けられたさまざまな制度、患者負担の費用などについて紹介しています。
研究段階の医療を希望する患者さんから相談を受けた場合に活用できるように、それぞれの研究段階の医療の概要に加え、探し方の紹介をしています。
報道関係からのお問い合わせ先
国立研究開発法人国立がん研究センター
郵便番号:104-0045
住所:東京都中央区築地5-1-1
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
ファクス番号:03-3542-2545
E-mail:ncc-admin●ncc.go.jp(●を@に置き換えてください)
参考資料
臨床試験の種類
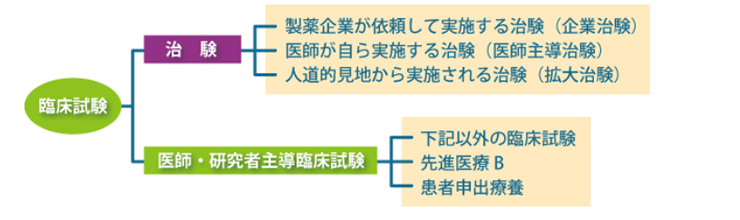
企業治験
新しい医薬品・医療機器等について安全性および有効性を検証し、厚生労働省から承認を得ることを目的として、製薬企業等から医師に依頼をして行われる治験です。
医師主導治験
医療上の必要性に基づき、製薬企業では開発が進まないような医薬品・医療機器等について、医師自ら行う治験です。
人道的見地から実施される治験(拡大治験)
治験の対象とならない患者さんに対して、必要な薬の承認および保険適用までの期間を待つことができない生命に重大な影響がある疾患で、既存の治療法に有効なものが存在しないことから、人道的見地から実施される治験です。従来は、「日本版コンパッショネートユース」と呼ばれていました。
主たる治験
人道的見地から実施される治験(拡大治験)の対象となり得る治験。製薬企業が実施する治験には、開発の早期に実施される第I相試験から開発の後期に実施される第III相試験まで、様々な段階のものがあります。早期の治験よりも後期の治験の方が安全性や有効性に関する情報が多く蓄積しており、相対的にはより日常診療に近いものになります。これらの治験のうち後期の治験(新薬の有効性を示す上で重要な根拠となる役割の治験)を「主たる治験」と分類し、医薬品医療機器総合機構のホームページで情報提供されています。
医師・研究者主導臨床試験/特定臨床研究
医師や研究者が主体となって行う臨床試験です。そのうち、これまで厚生労働省で承認された薬、治療法や診断法から、最良の方法や薬のよりよい組み合わせを確立することを目的として行う試験は「人を対象とした医学系研究に関する倫理指針」に従って実施されます。一方、厚生労働省から承認されていない薬の使い方などの評価を目的として行う試験のうち医師主導治験に含まれないものは「臨床研究法」という法律に従って実施されます。
先進医療制度について
公的医療保険が適用されない医療と保険が適用される医療を同時に受ける場合(混合診療と呼ばれることがあります)は、保険が適用される医療の費用も含め、すべての費用を自己負担することになります。先進医療制度は、新しい医療を評価するためにこの仕組みに例外を定めるもので、厚生労働大臣が「先進医療」として特別に定めた公的医療保険が適用されない医療については、保険診療との併用を認めるものです。まだ開発・評価の途上にある医療技術であるため、不適切な形で実施されたり安全性上の問題を引き起こしたりして患者さんに不利益が生じないようにすることが必要です。そのため、先進医療は国が定めた一定の条件を備えた医療機関でのみ実施が認められています。先進医療には二つの細分類があり、以下の先進医療Aと先進医療Bとに分けられます。
先進医療A
保険診療として認められていない医療技術の中で、保険診療とすべきかどうかの評価が必要であると厚生労働大臣が定めた治療法(評価療養)です。臨床試験以外の枠組みで評価中のもので、未承認薬等を使用しない治療法、または人体への影響が極めて少ない未承認薬等を使用しない診断法です。
先進医療B
先進医療Aと同じく評価療養ですが、未承認薬等を使用する治療法、または未承認薬等を使用しない治療法の場合でも臨床試験として、安全性および有効性の評価が特に必要とされる治療法です。
患者申出療養制度について
困難な病気と闘う患者さんからの申出により、検討されるようになる治療法です。国内の未承認・適応外のさまざまな治療法が対象になりますが、保険収載を前提とするものに限ります。したがって費用については、未承認薬等の費用に加え、保険収載を目指すためのデータをつくるための研究支援者の人件費や研究の品質管理、統計解析のための費用などもかかり、患者負担が多額になる可能性があります。申出をしても必ず受けられるようになるとは限りません。

