COVID-19ワクチン候補ペプチドの同定
細胞性免疫誘導を特徴とする画期的ワクチンの開発へ
2020年7月30日
国立研究開発法人国立がん研究センター
ブライトパス・バイオ株式会社
発表のポイント
- 国立がん研究センターとブライトパスは、COVID-19の原因ウイルスに対する細胞性免疫(T細胞)の誘導を特徴とするペプチドワクチン*1候補を同定しました。
- 今回同定したペプチドで日本人に多いHLA型が広くカバーされ、日本人での高い有効性が期待されます。
この度、国立研究開発法人国立がん研究センター(理事長:中釜 斉、所在地:東京都中央区、以下国立がん研究センター)とブライトパス・バイオ株式会社(代表取締役社長:永井 健一、所在地:東京都千代田区、以下ブライトパス)は、共同研究において新型コロナウイルス感染症(COVID-19)の予防ワクチンとなり得る複数の候補ペプチドを同定しましたのでお知らせいたします。
COVID-19の世界的大流行は依然として収束する兆しが見えてきません。国立がん研究センター先端医療開発センター(センター長:落合 淳志、所在地:千葉県柏市)中面哲也免疫療法開発分野長らとブライトパスは、がん細胞の遺伝子変異(ネオアンチゲン*2)に着目したがんワクチンの臨床応用を目指す共同研究を進めています。さらにこのネオアンチゲン・ワクチン候補を同定する技術を応用し、COVID-19をもたらすウイルス(SARS-CoV-2)に対するペプチドワクチン候補を同定し、パンデミック収束の一翼を担えるCOVID-19ワクチンの開発を共同研究で進めてまいりました。
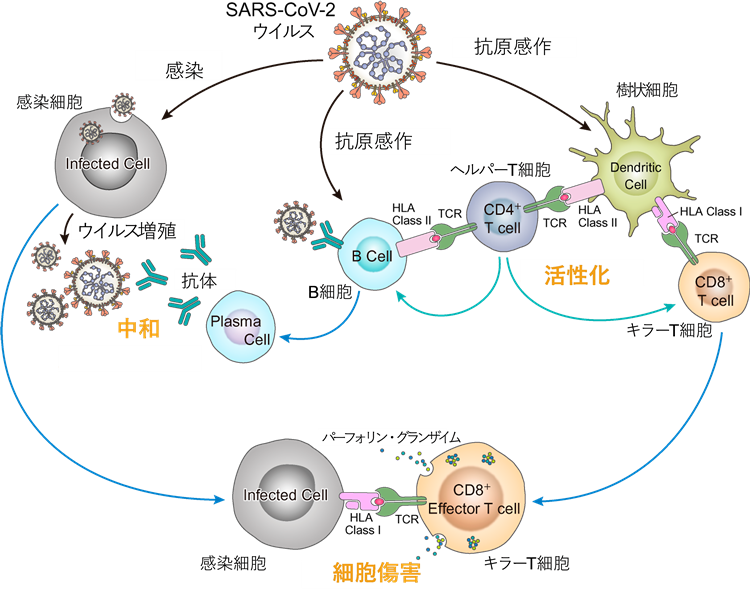
現在世界で開発が進んでいるCOVID-19ワクチンのほとんどが、ウイルスを細胞感染前に捕捉する中和抗体*3(液性免疫)の誘導を目指すものですが、ウイルス感染に対する免疫反応は、抗体反応だけではありません。ウイルスに対するT細胞(細胞性免疫*4)反応が重要な鍵を握っています。ウイルスを中和する抗体反応が誘導されるためにはT細胞(CD4+ T細胞:ヘルパーT細胞*5)の助けが必要です。さらにウイルス感染が進行してしまった細胞は細胞内でウイルスを増殖させるため、T細胞(CD8+ T細胞:キラーT細胞*6)によって殺傷しなくてはいけません【図1】。このようなウイルス特異的T細胞を誘導できるワクチン開発が、ウイルス防御において有効であることを示唆する研究報告*7が、昨今続々と発表されています。
国立がん研究センターとブライトパスがこれまで開発してきたのは、がん細胞を殺傷するT細胞(細胞性免疫)の誘導を作用機序とするがんワクチンであり、この開発経験を活かし、ウイルスに対するT細胞を、ペプチド*8という短く絞り込まれた断片を用いてピンポイントで強力に誘導するワクチンの開発に取り組み、複数のワクチン候補ペプチドを同定するに至りました。
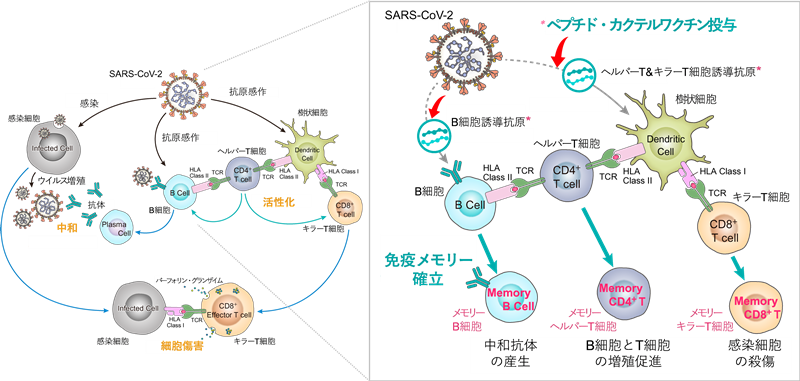
T細胞がウイルス抗原(ウイルスのタンパク質から切り出される短いペプチド)に反応するためには、このペプチドがヒト主要組織適合性遺伝子複合体(HLA)*9と一緒に感染細胞の表面で提示されていなければなりません。HLAは一人が複数の型をもち、その組み合わせは一人ひとりで大きく異なります。今回同定したペプチドは、HLA-A24とHLA-A2を合わせて日本人の85%をカバーするHLAに結合するため、日本人での有効性が期待されます。さらに中和抗体の誘導を図るペプチドも含む製剤デザインがなされています【図2】。
【図1】SARS-CoV-2に対する免疫の成立
【図2】複合的免疫メモリー*10を成立させるワクチン
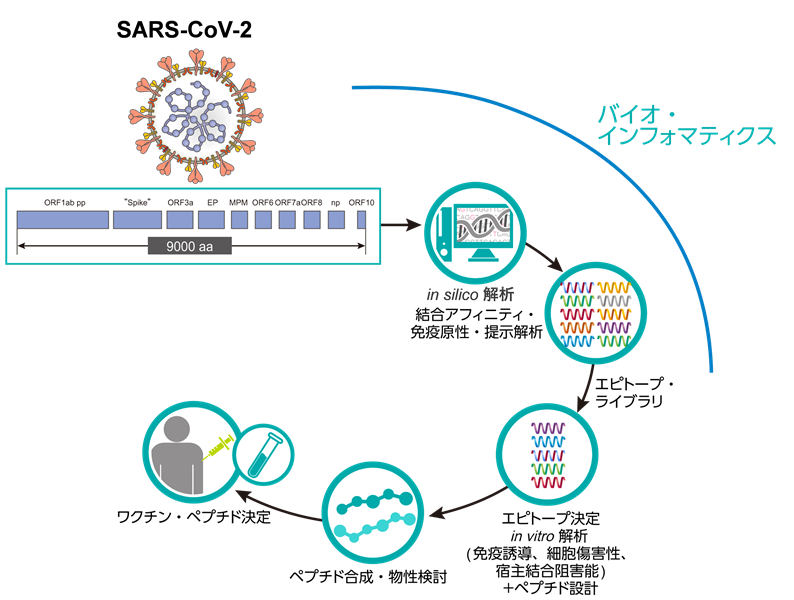
本COVID-19ワクチンの設計は、これまでに登録されている約11,000株のSARS-CoV-2のゲノムデータを参照し、ウイルスがコードするタンパク質から切り出されると予測されるペプチドを、HLAへの結合能、細胞表面へHLA複合体として提示されるか等の観点から検討しました。ネオアンチゲン・ワクチン設計に用いる予測アルゴリズムを用いたin silico解析*11によってリストアップし、HLA遺伝子導入マウスモデルで実際の免疫原性の有無を確認するスクリーニング法によって、絞り込みを行いました【図3】。
【図3】COVID-19ワクチン候補ペプチド同定のフロー
本共同研究は国立がん研究センター先端医療開発センターの中面哲也免疫療法開発分野長らを中心にブライトパスとの間で進められています。中面分野長は、本邦におけるがん免疫療法*12のサイエンスを牽引するとともに、グリピカン3を始め、多くのがんペプチドワクチンの探索研究から臨床試験までを一貫して推進してまいりました。ブライトパスは、日本人で一番多いHLA-A24拘束性ペプチドワクチンを、前立腺がんを対象とするテーラーメイド型がんワクチンITK-1として国内で第3相臨床試験まで進めた経験を有し、現在は米国人で一番多いHLA-A2拘束性4種ペプチド・ミックス・ワクチンGRN-1201を、非小細胞肺がんを対象に米国で第2相臨床試験を進めています。
ペプチド製剤は、化学的な合成によって製造できることから、今後COVID-19ワクチンの普及に必須となる大量製造、安定した薬剤供給にも対応できる可能性があります。国立がん研究センターとブライトパスは、本共同研究の成果を第三者の開発パートナーやアカデミア、大学病院などとの協業も視野に入れ、臨床応用と早期実用化へと進める機会を探ってまいります。
国立研究開発法人国立がん研究センターについて
国立がん研究センターは、1962年に国立機関として創設され、がん研究・がん医療における国立の中核機関として、先端的な研究を牽引してきました。2015年に設立された先端医療開発センター(NCC-EPOC)は、トランスレーショナルリサーチを中心に、先進的ながん治療薬・医療機器開発を推進してきました。革新的医療実現を目指す挑戦者として、国内外のアカデミアや創薬、医療機器開発企業など幅広い分野と交流し、「がんの治癒」に向けて歩み続けます。
ブライトパス・バイオ株式会社について
ブライトパスは、従来の標準治療の適用が困難な難治性・進行性のがんに対する治療法としてがん治療の革新をもたらした「がん免疫療法」の開発を行う、創薬バイオベンチャーです。米国で臨床試験を実施中のGRN-1201を含むがんワクチン、HER2 CAR-Tを含む細胞医薬、自社創製の免疫制御分子に対する抗体の3つのモダリティをパイプラインに有します。
用語説明
*1 ペプチドワクチン
ペプチドとはタンパク質の断片のことをいい、抗原ペプチドをワクチンとして接種することにより、ペプチドに反応する主には細胞傷害性T細胞(CTL)を患者さんの体内で増やし、ペプチドを提示している細胞を排除することを目的とした免疫療法の一つです。がん領域では、がん細胞に特有のペプチドを患者さんに注射し、患者さん自身の持っている免疫力を利用してがんの増大あるいは再発を抑えることを目指した新薬開発が進められています。
今回は、その手法を転用して、ウイルスが発現するタンパク質から切り出されるペプチドのうち、キラーT細胞、ヘルパーT細胞、抗体誘導型のペプチドを混ぜてカクテルワクチンとして接種することにより、患者自身の免疫力を利用して、ペプチドに反応するT細胞を増強しウイルス感染細胞を排除する効果に加え、ウイルスの中和活性にも期待したペプチドワクチンを開発します。
*2 ネオアンチゲン
がん細胞の遺伝子変異を含む抗原。免疫系は抗原を認識して反応し、「がん免疫」はがん細胞表面上に提示される抗原を目印として、がん細胞を排除しにかかります。免疫系は正常な「自己」の抗原には反応しませんが、ネオアンチゲンは正常な細胞には存在しないため「非自己」として認識されて強い免疫反応の標的になります。
ネオアンチゲン・ワクチン候補は、がん細胞を殺傷するキラーT細胞が、がん細胞を認識するのに用いる、がん細胞のタンパク質から切り出される短いペプチドを特定する技術を用いて同定しました。
参考:
*3 中和抗体
ウイルス感染阻止能(中和能)を有する抗体。ウイルスは細胞に感染して増殖しますが、COVID-19を引き起こすSARS-CoV-2は、スパイク(棘)・タンパク質が細胞のACE2受容体に結合して細胞内に入り込む(感染する)ので、このスパイク・タンパク質のACE2結合部位を認識する抗体は、中和能を発揮できる場合が多いと考えられています。
*4 細胞性免疫
SARS-CoV-2を排除する免疫は2通りあります。1つは抗体で、ウイルスが細胞に感染する前にウイルスに結合し、細胞への感染を阻止します。もう1つは、キラーT細胞を主体とする細胞性免疫で、ウイルスが感染した細胞を殺傷します。ウイルスは細胞内で増殖し、また細胞外に出て次の細胞へ感染を繰り返していくため、ウイルスが制圧される(無症状になる)ためには、最終的には細胞性免疫が発動されています。なお、がん治療ワクチンは、一部のウイルスに起因するがんの予防ワクチンを除き、ほぼすべてがT細胞誘導型ワクチンです。
*5 ヘルパーT細胞
ウイルスに対する抗体の産生に関わるB細胞を活性化するとともに、ウイルス感染細胞を直接殺傷するキラーT細胞も活性化します。
*6 キラーT細胞
ウイルス感染細胞を直接殺傷します。
*7 研究報告(参考情報)
- Robust T cell immunity in convalescent individuals with asymptomatic or mild COVID-19 Sekine et al. pre-print doi.org/10.1101/2020.06.29.174888
- SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls Bert et al. Nature (2020) doi.org/10.1038/s41586-020-2550-z
- Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals Grifoni et al. Cell (2020) doi.org/10.1016/j.cell.2020.05.015
*8 ペプチド
キラーT細胞が、ウイルス感染細胞を認識するために目印とするのは、HLA(ヒト主要組織適合性遺伝子複合体)とともに複合体として細胞表面上に提示される、ウイルス由来のタンパク質の短い断片(ペプチド)になります。他のCOVID-19ワクチンは、ウイルスそのものの殻(不活化ワクチン)やタンパク質全長であるなど、T細胞が必ずしも認識しない断片(圧倒的に多い)を多く含んでいるのに対して、ペプチドワクチンは数々のT細胞が認識する数々の断片の中から、特に強力な細胞傷害活性を有するT細胞を誘導できる断片に絞り込まれたものとなっています。
*9 HLA(ヒト主要組織適合性遺伝子複合体)
ほぼすべての細胞に発現し、ヒトの免疫に関わる重要な分子として働く組織適合性抗原。その主な役割は自他認識をすることにあります。ヒト一人がもつHLAは、HLA-A, HLA-B, HLA-C, HLA-DR, HLA-DQ, HLA-DPなど多くの抗原の組み合わせで構成され、さらにそれぞれが数十種類の異なるタイプ(アリル)をもち、ハプロタイプ(両親から受け継いだ2つのアリルで一対の組み合わせ)は、数万通りともいわれます。
*10免疫メモリー
一度病原体などの侵入や感染を受けて生じた抗体(B細胞が産生)やT細胞が保持され、二度目以降に同じ抗原に対して迅速かつ強力な免疫応答を示すこと。これによって、感染・発症を防ぎ、あるいは発症しても軽度で済むようにます。
*11 in silico 解析
COVID-19を引き起こすウイルスSARS-CoV-2が含むタンパク質は、ウイルス感染細胞内で断片化され、ペプチドとなって同じく感染細胞内にあるHLAと結合し、細胞表面上に提示されます。ウイルス感染細胞を排除するキラーT細胞はこれを攻撃の目印にします。よって、ワクチンとして投与するペプチド(体内にあるはずのものを模倣して化学合成により製造)が、HLAと結合するかどうか等を、そのタンパク質構造から予めコンピューターでシミュレーションします。
*12がん免疫療法
がん免疫療法は、元々人の身体に備わっている免疫の力を強めることでがんを排除することを目的とした治療法です。がん細胞などが免疫系にかけるブレーキを解除する免疫チェックポイント阻害薬の中には、臨床試験で有効性と安全性が確認され、現在標準治療となっているものもあります。しかし、そのようながん免疫治療薬はまだ一部で、適応がん種もまだ一部に限られています。この科学的に有効性を証明された「がん免疫」という作用メカニズムを有する新規がん免疫治療薬によって、アンメット・メディカル・ニーズが満たされることが期待されています。
本件に関するお問い合わせ先
- 国立研究開発法人国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
Tel: 04-7133-1111(代表) FAX: 04-7130-0195
e-mail: ncc-admin@ncc.go.jp - ブライトパス・バイオ株式会社 管理部
Tel: 03-5840-7697 FAX: 03-5840-7716 e-mail: irpr@brightpathbio.com
