がん原因遺伝子ELF3のがん進展に関わる新たな機能を解明
~日本人に多い胆管がんなどに対する新規薬剤開発に期待~
研究成果のポイント
- 正常な上皮組織の維持を担う転写因子*1であるELF3(E74 Like ETS transcription Factor 3)は、胆管がん・十二指腸乳頭部がんなどのがん原因遺伝子として知られていたが、どのようにがんの進展にかかわっているのかはこれまで不明であった。
- 上皮細胞において、ELF3にタンパク質の機能が不活化してしまうような変異(不活化変異)が起きた細胞では、上皮系から間葉系へと形態が変わり、浸潤・転移しやすい形質となること、さらに、免疫細胞を呼び寄せる能力が低下することを明らかにした。
- ELF3が不活化変異したがんやELF3の発現の低いがんに対する新規薬剤の開発が期待される。
概要
大阪大学大学院医学系研究科の鈴木雅美 助教、谷内田真一 教授(がんゲノム情報学)と国立がん研究センター 先端医療開発センター HPV関連がん予防・治療プロジェクト 清野 透プロジェクトリーダーらの研究グループは、がん原因遺伝子であるELF3が、がんの転移や浸潤に関わる上皮間葉転換*2を制御することや免疫細胞の機能を調節することを世界で初めて明らかにしました。
研究グループは、2016年にがん組織においてELF3の不活化変異が存在することをCancer Cell誌に報告し、ELF3はがん抑制遺伝子として機能していることが示唆されていました。しかしながら、ELF3がどのようにがんの進展に関わるかは解明されていませんでした。
今回、研究グループは、ELF3ががん抑制遺伝子としてどのように機能しているかを明らかにするため、ELF3が直接的に発現を調整する遺伝子を探索し、がんの転移に関わる上皮間葉転換を担う転写因子や細胞接着に関連するタンパク質、免疫細胞を調節するタンパク質などを特定しました (図1)。これにより、ELF3が不活化した細胞では、細胞同士の接着が乏しく、上皮系から間葉系へと形態を変化させ、転移しやすい形質になっていることが分かりました。さらに、ELF3が、がん細胞を攻撃するナチュラルキラー細胞など細胞傷害性の免疫細胞を呼び寄せる因子の発現の制御を行っており、ELF3不活化細胞では免疫細胞を呼び寄せるシグナルが欠如していることも明らかにしました。今回の成果により、ELF3に依存したがんの進展機構が明らかとなり、ELF3関連遺伝子を標的とした新規薬剤の開発が期待されます。
本研究成果は、米国専門誌「Cancer Research」に、12月8日(火)午後5時(日本時間)に公開されます。
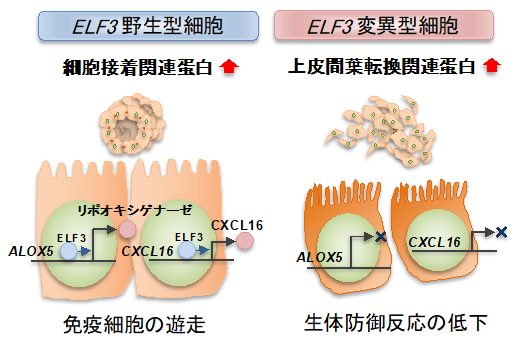
図1:ELF3に依存したがんの進展機構
正常な上皮細胞においてELF3は、細胞同士の接着を制御しています。ELF3が不活化した細胞では、上皮系から間葉系へと形態を変化させ、転移しやすい形質になっていることや、免疫細胞を呼び寄せるシグナル(リポオキシゲナーゼ、CXCL16)が欠如していることを明らかにしました。
研究の背景
2016年に谷内田 教授らの研究グループは、十二指腸乳頭部がんで大規模ゲノム解析を行い、転写因子であるELF3の不活化変異を見出し、ELF3が 新たな“がん抑制遺伝子” であることを世界で初めて報告しました。ELF3は以前より、上皮細胞の発生の最終段階でその発現を増加させ、正常な上皮組織の維持に重要な役割を担う転写因子であることが知られていました。一方、肺がんや大腸がんではELF3の発現は高く、がんの進展に関わることも明らかにされ、ELF3は臓器や細胞の種類に依存して、がんを抑制する機能と促進させる機能の両方を持つことが分かっていました。このようにELF3は、二面性の機能を有することが推察されるものの、ELF3がどのような遺伝子の発現を制御して、がんの進展に関わるかについては知られていませんでした。
本研究の成果
本研究では、ゲノム編集技術*3によりELF3の発現を調節した胆管上皮細胞を用いて網羅的な遺伝子発現解析とクロマチン免疫沈降シーケンス解析*4を行い、ELF3が直接的に転写を制御する遺伝子の探索を行いました。これらの解析から、ELF3のターゲット遺伝子として、上皮間葉転換を担う転写因子である ZEB2および細胞接着に関連する蛋白であるcingulin(シンギュリン)を同定し、ELF3の機能が低下した胆管上皮細胞では、細胞同士の接着を担う構造が乏しいことを電子顕微鏡レベルでも明らかにしました(図2)。またELF3の発現がない細胞では、細胞の浸潤する能力が高く、がんが転移しやすい細胞に形質変化することを示しました。
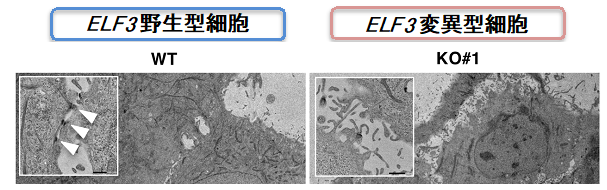
図2:ELF3野生型及び変異型細胞における細胞同士の接着構造
ELF3が発現する胆管上皮細胞では細胞同士の接着を担う構造(矢頭)が多数存在するのに対し、ELF3遺伝子が欠損した細胞では、その構造がほとんど見られないことを電子顕微鏡で明らかにしました。
さらにELF3が免疫細胞を組織に呼び寄せる機能を有するリポオキシゲナーゼという酵素やCXCL16 (chemokine (C-X-C motif) ligand 16) というケモカインの発現の制御を行うことも世界で初めて明らかにしました。実際に、ELF3を高発現させた細胞では、リポオキシゲナーゼやCXCL16の発現が高くなり、ナチュラルキラー細胞などの細胞障害性の免疫細胞を呼び寄せる能力も高いことがわかりました。さらにELF3を人工的に活性化させた細胞をマウスの皮下に移植した後、がん組織を解析すると、ELF3が活性化したがん組織では、リポオキシゲナーゼやCXCL16の発現増加に加えて、細胞接着を担う蛋白の発現も増加し、多数の明瞭な管腔様構造が認められました(図3)。
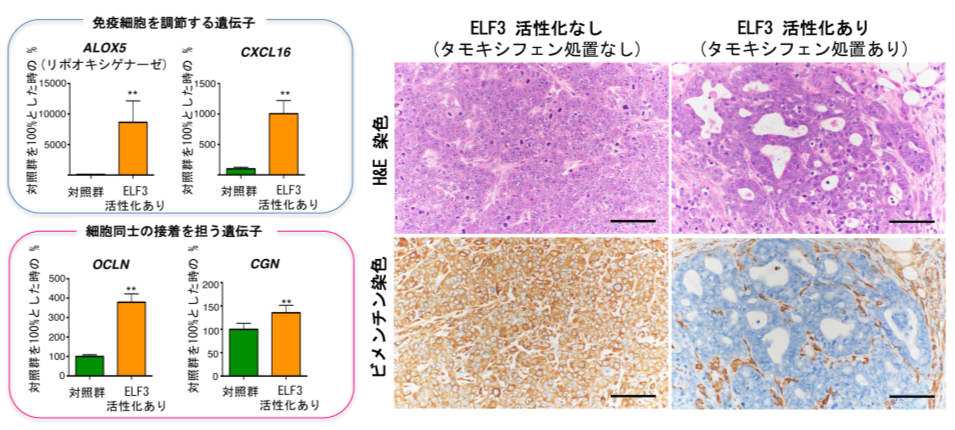
図3:ELF3を人工的に活性化させた細胞をマウスの皮下に移植したがん組織の解析
(左)関連遺伝子の遺伝子発現の変化
ELF3を薬剤(タモキシフェン)の処置により活性化した細胞を移植したがん組織では、免疫細胞を調節する遺伝子や細胞接着を担う遺伝子の発現が増加していた。
(右)がん組織の病理画像
ELF3の活性化により、ビメンチンの発現が欠如した明瞭な管腔構造が多数局在したのに対し、ELF3活性のないがん組織では、間葉系細胞のマーカーであるビメンチンの発現が高く、管腔構造がほとんど認められなかった。
一方、ELF3を活性化させていないがん組織では、管腔様構造はほとんど認められず、間葉系細胞のマーカーであるビメンチンの発現が高いことが明らかとなりました。これは、ELF3の活性化がないがん組織は、転移・浸潤しやすいことを示唆しています (図3)。また、本解析で明らかにしたELF3関連遺伝子ZEB2、cingulin、リポオキシゲナーゼ、CXCL16が、ヒト胆管がん組織においてもELF3の発現と相関することを明らかにしました。
本研究成果が社会に与える影響(本研究成果の意義)
ELF3は日本人に多い胆管系のがんに遺伝子異常が多く見られます。本研究成果により、ELF3の発現に依存したがんの進展機構が世界で初めて明らかとなりました。ELF3が不活化変異したがんやELF3の発現の低いがんは、転移浸潤しやすく、悪性度が高いことが示唆されます。このようながんに対して、リポオキシゲナーゼやCXCL16の阻害薬が奏効する可能性が考えられ、新規薬剤の開発が期待されます。
特記事項
本研究成果は、2020年12月8日(火)午前3時(米国東部時間)〔12月8日(火)午後5時(日本時間)〕に米国専門誌「Cancer Research」(オンライン)に掲載されます。
タイトル
E74-like factor 3 is a key regulator of epithelial integrity and immune response genes in biliary tract cancer
著者名
Masami Suzuki(1),Mihoko Saito-Adachi(2),Yasuhito Arai(2),Yuko Fujiwaea(2),Erina Takai(1),Shinsuke Shibata(3),Masahide Seki(4),Hirofumi Rokutan(2),Daichi Maeda(5),Masafumi Horie(1),Yutaka Suzuki(4)Tatsuhiro Shibata(2,6),Tohru Kiyono(7),and Shinichi Yachida(1)
所属
- 大阪大学 大学院医学系研究科 がんゲノム情報学
- 国立がん研究センター研究所 がんゲノミクス研究分野
- 慶應義塾大学 医学部 電子顕微鏡研究室
- 東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻 生命システム観測分野
- 大阪大学 大学院医学系研究科 先端ゲノム医療学共同研究講座
- 東京大学 医科学研究所ゲノム医科学分野
- 国立がん研究センター 先端医療開発センター HPV関連がん予防・治療プロジェクト
本研究は、日本学術振興会科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)、国立がん研究センター・がん研究開発費、公益財団法人武田科学振興財団 特定研究助成、公益財団法人ヤクルト・バイオサイエンス研究財団、公益財団法人 高松宮妃癌研究基金、大阪大学 先導的学際機構 生命医科学融合フロンティア研究、東京大学医科学国際共同利用・共同研究拠点事業 共同研究の一環として行われ、国立がん研究センター研究所 薄井梨佐 研究補助員、河野智穂 研究補助員、石山敬子 研究補助員、加藤 護 ユニット長、中村浩実 研究員、十時 泰 ユニット長、小山 正平 ユニット長、理研バイオリソースセンター 三好浩之 博士、の協力を得て行われました。
用語説明
*1 転写因子
DNAに結合し、遺伝子の転写(DNAの情報をもとにRNAが合成される)調節に関与するタンパク質
*2 上皮間葉転換
細胞が上皮系から間葉系へと形質転換すること
*3 ゲノム編集技術
人工的に作製したRNAを細胞に導入し、ある部分のゲノムを選択的に改変する手法
*4 クロマチン免疫沈降シーケンス解析
染色体を断片化し、目的とするタンパク質の抗体を使用してそのタンパク質を含む断片を濃縮する。その後、DNAの配列を次世代シーケンサ(DNA配列を大量に読み取る装置)で解析することによって、そのタンパク質の結合部位を網羅的に明らかにする方法
本件に関する問い合わせ先
報道に関すること
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
TEL:03-3542-2511(代表) FAX: 03-3542-2545
E-mail:ncc-admin@ncc.go.jp
