近赤外光を利用したハイパースペクトル画像から粘膜下腫瘍(GIST)を識別~GISTの早期発見、切除部位の最小化につながる画像識別手法の開発に成功~
2021年2月2日
東京理科大学
国立研究開発法人国立がん研究センター
理化学研究所
in English
研究の要旨とポイント
- 消化管間質腫瘍(GIST)は粘膜の下に生じるため、しばしば診断が難しく、簡便にGISTを識別できる手法の開発が待たれています。
- 本研究では、近赤外光を利用したハイパースペクトル画像を取得し、得られたデータを機械学習の訓練データとして用いることで、粘膜下の深部にあるGISTを高い精度で識別できる新たな技術を開発しました。
- 本研究を発展させることで、粘膜下腫瘍の鑑別診断、腫瘍の正確な範囲判断、早期発見、切除部位の最小化、術後のQOL向上につながると期待できます。
東京理科大学生命医科学研究所の高松利寛助教(東京理科大学・国立がん研究センタークロスアポイントメント)、同大学基礎工学部材料工学科の曽我公平教授、同大学理工学部機械工学科の竹村裕教授、国立がん研究センター東病院消化管内視鏡科の佐藤大幹氏、池松弘朗医長、故金子和弘氏、同病院遺伝子診療部門長(当時病理・臨床検査科長)の桑田健、理化学研究所光量子工学研究センターの横田秀夫チームリーダーらの研究グループは、近赤外光を利用したハイパースペクトル画像から消化管間質腫瘍(GIST)を識別する方法を開発しました。本研究を発展させることで、粘膜下腫瘍の鑑別診断、腫瘍の正確な範囲判断、早期発見、切除部位の最小化、術後のQOL向上につながると期待できます。
GISTは粘膜の下に生じるため、直接観察から診断することは難しい腫瘍です。また、確定診断のためには超音波内視鏡下穿刺吸引法 (EUS-FNA)という特殊な方法で組織を採取し、得られた組織を免疫組織化学法で染色する必要があるため、手間と時間がかかるという問題もあります。そのため、簡便にGISTを識別できる新たな手法の開発が望まれていました。
本研究グループは、近赤外光を利用したハイパースペクトル画像を取得し、得られたデータを機械学習の訓練データとして用いることで、粘膜下の深部にあるGISTを識別できる新たな技術を開発しました。今後さらなる研究の発展によって、粘膜深部に浸潤した腫瘍の範囲診断や腹腔鏡による腫瘍の識別が可能になると期待されます。
本研究は、2010年から続く本学、理化学研究所、国立がん研究センターの共同研究の成果第一号として位置付けられます。国立がん研究センター東病院の故金子和弘先生をはじめとする関係者の皆様の惜しみないご尽力で、医師と工学者の垣根は取り払われ、長く続く共同研究の礎が築かれました。盤石な体制のもと、本共同研究は着実に成果を積み上げており、今後も次々と研究成果が発表される予定です。本研究は、その第一歩としても非常に意義深い成果といえます。
本研究成果は、2020年12月14日(月曜日)に英国学術雑誌「Scientific Reports」にオンラインで掲載されました。
研究の背景
GISTは、消化管壁の粘膜下に生じる腫瘍で、胃と小腸によく発生します。痛みや消化管出血、腸閉塞などの初期症状がある場合もありますが、多くは無症状で、内視鏡検査などの消化管の検査で発見されます。胃GISTの場合、まず内視鏡検査で粘膜下腫瘍(SMT)として検出されます。SMTは粘膜下にあるため、直接観察のみからGISTかどうか診断することはできません。病変の一部を採取して顕微鏡で詳しく調べる検査(生体組織診断)を行なっても、多くの病変は粘膜深部に位置するため、正しく診断される確率は低いという問題があります。超音波で病変の位置を確認しながら針を刺して組織を採取する「超音波内視鏡下穿刺吸引法 (EUS-FNA)」は有効な生検方法ですが、技術の習得が必要です。さらに、確定診断のためには、得られた組織サンプルのどこに抗原物質が発現しているかを、抗原抗体反応を利用して調べる「免疫組織化学法」を行う必要がありますが、これは非常に時間と手間がかかります。
そこで研究グループは、粘膜下の深部にあるSMTの診断に有望な技術として、近赤外光を利用したハイパースペクトル画像に着目しました。
近赤外光はおよそ波長800nmから2500nmの光です。近赤外光は、紫外光や可視光よりも生体組織内における散乱が少なく、中赤外光よりもはるかに水中で吸収されにくいことから、生体試料の中を透過しやすく、生体イメージングに適しています。透過性が高いことは、生体組織を破壊したり傷つけたりすることなく検査できることも意味しています。さらに、生体分子の励起に必要な近赤外光強度は、中赤外光および可視光の100分の1であり、近赤外光を利用したイメージングは安全性が高く、生体内での直接観察が可能になります。
ハイパースペクトルイメージング(HSI)は、蛍光プローブを使用せずに高解像度の分光スペクトル情報を得ることができる撮影装置で、上皮性腫瘍や胃がんの診断など、さまざまな研究領域で応用されています。機械学習アルゴリズムを使用したHSIでは、画像データの各ピクセルの分光スペクトル情報を取得するだけでなく、大量のハイパースペクトル画像から重要なデータを抽出することもできます。しかしながら、GISTのように組織の深部に生じる病変の識別技術はまだあまり進歩しておらず、事例すらありません。
そこで研究グループは、近赤外光を利用したHSIからGISTを診断する技術を考案し、組織の深部に生じる病変の識別技術としてふさわしいかどうか検証しました。
研究結果の詳細
41歳から81歳のGIST患者12名(男性10名、女性2名)から切除した病変を対象に研究を行いました。患者の年齢の中央値は68歳、腫瘍サイズの中央値は41mmでした。切除された12の試料のうち、7個は病変が完全に粘膜によって覆われており、3個は部分的に粘膜に覆われていました。また、7個の試料ではGIST病変だけでなく正常部位も含まれていました。
採取した試料に粘膜側から近赤外光を照射し、HSI画像を得ました。試料は全て事前に正常部位と病変部位が識別されており、それぞれの部位から得られた画像を機械学習の訓練データとして用いました。この機械学習モデルの識別能力を評価するために、一個抜き交差検証を行いました。一個抜き交差検証は、まず訓練データの中から評価データとなる試料を選び、選んだデータを除いた訓練データで学習して最後に評価データを識別できるか評価します。
その結果、近赤外光を利用したHSI画像に基づく機械学習で予測されたGIST領域は、事前に病理学者が識別した領域とよく一致しました(図1)。機械学習アルゴリズムの評価指標である特異度(注1)、感度(注2)、正解率(注3)はそれぞれ73.0%、91.3%、86.1%と、高い値を示しました。これは、今回用いた方法でGISTと正常組織の違いを識別できることを示唆する結果です。
今回の研究から、近赤外光を利用したハイパースペクトル画像からGISTを識別できることが示されました。研究グループは、この技術の臨床応用を見据え、ハイパースペクトル画像を形成する波長を選定する特許を既に共同出願し、体内で近赤外ハイパースペクトル画像が撮影可能な装置を開発しています。今後さらなる研究の発展によって、粘膜深部に浸潤した腫瘍の範囲診断や腹腔鏡による腫瘍の識別が可能になり、早期発見、手術時の正確な範囲診断により切除部位の最小化することで機能を損なわないように手術できるようになり、術後のQOLの向上につながると期待されます。
本研究成果を診断機器として製品化することにより、GISTの早期診断を通じて社会に貢献いただける企業を募集しています。
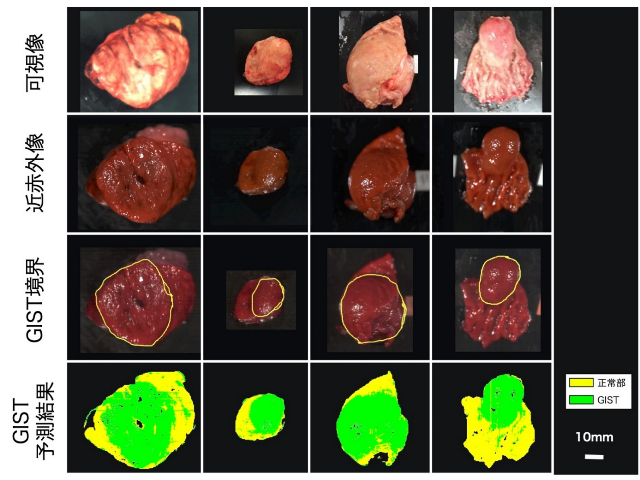
図1. 本研究に用いたGISTの可視像、近赤外像、病理学者が識別したGIST境界、機械学習によるGIST領域の予測結果。
用語
注1 特異度:陰性のデータを正しく陰性と予測した割合。
注2 感度:陽性のデータを正しく陽性と予測した割合。
注3 正解率:全ての事象の中で、診断結果が合っていた割合。
論文情報
雑誌名
Scientific Reports
論文タイトル
Distinction of surgically resected gastrointestinal stromal tumor by near‑infrared hyperspectral imaging
著者
Daiki Sato, Toshihiro Takamatsu, Masakazu Umezawa, Yuichi Kitagawa, Kosuke Maeda, Naoki Hosokawa, Kyohei Okubo, Masao Kamimura, Tomohiro Kadota, Tetsuo Akimoto, Takahiro Kinoshita, Tomonori Yano, Takeshi Kuwata, Hiroaki Ikematsu, Hiroshi Takemura, Hideo Yokota & Kohei Soga
DOI
10.1038/s41598-020-79021-7
発表者
- 高松利寛 東京理科大学 生命医科学研究所 助教 <責任著者>
(東京理科大学・国立がん研究センタークロスアポイントメント) - 曽我公平 東京理科大学 基礎工学部 材料工学科 教授
- 竹村裕 東京理科大学 理工学部 機械工学科 教授
- 佐藤大幹 国立がん研究センター東病院 消化管内視鏡科 <筆頭著者>
- 池松弘朗 国立がん研究センター東病院 消化管内視鏡科 医長
- 桑田健 国立がん研究センター東病院 遺伝子診療部門長(当時病理・臨床検査科長)
- 横田秀夫 理化学研究所 光量子工学研究センター チームリーダー
他
研究に関する問い合わせ先
東京理科大学
理工学部 機械工学科 教授
竹村 裕(たけむら ひろし)
E-mail:takemura@rs.tus.ac.jp
国立研究開発法人国立がん研究センター東病院
消化管内視鏡科 医長
池松 弘朗(いけまつ ひろあき)
E-mail:hikemats@east.ncc.go.jp
理化学研究所
光量子工学研究センター チームリーダー
横田 秀夫(よこた ひでお)
E-mail:hyokota@riken.jp
報道・広報に関する問い合わせ先
東京理科大学
広報部(担当:清水)
TEL:03-5228-8107 FAX:03-3260-5823
E-mail:koho@admin.tus.ac.jp
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
TEL:04-7133-1111(代表)FAX:04-7130-0195
Email:ncc-admin@ncc.go.jp
理化学研究所
広報室 報道担当
E-mail:ex-press@riken.jp
