希少かつ難治がんの神経内分泌がん(NEC)で大規模臨床試験が実現現在の化学療法が進行・再発例の標準治療として確立今後さらに有効な治療法の開発が期待
2022年8月24日
国立研究開発法人国立がん研究センター
地方独立行政法人神奈川県立病院機構神奈川県立がんセンター
日本臨床腫瘍研究グループ
発表のポイント
- 希少がんかつ難治がんである消化器原発神経内分泌がん(Neuroendocrine carcinoma:NEC)の進行期、再発の患者さんに対して、世界で初めてランダム化第III相試験*1を行いました。
- 日本臨床腫瘍研究グループの3グループ(肝胆膵、胃がん、食道がんグループ)が合同で実施し、国内50施設から患者さん170人が参加する世界でも類を見ない希少がんでの大規模な臨床試験が実現しました。
- 本試験の結果、神経内分泌がんの治療におけるエトポシド+シスプラチン(EP療法)、イリノテカン+シスプラチン(IP療法)はいずれも有効で標準治療として確立されました。
- 本成果を基に、神経内分泌がんでのさらに有効な治療法の開発と、他の希少がんでの研究開発の促進が期待されます。
概要
国立研究開発法人国立がん研究センター中央病院(病院長:島田和明、所在地:東京都中央区)が、中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
この度、JCOGの3グループ(肝胆膵、胃がん、食道がんグループ)が合同で、進行期または再発の消化器原発神経内分泌がん(NEC)の患者さん170人を対象に、一次治療として実施されているエトポシド+シスプラチン(EP療法)とイリノテカン+シスプラチン(IP療法)のどちらが優れているかを確認するため、両治療法の治療成績を比較するランダム化第III相試験(TOPIC-NEC試験)を実施しました。
神経内分泌がんは、希少であるため治療法を開発するための臨床試験の実施が難しく、その化学療法においては現在、がんの性質が比較的似ている小細胞肺がんの標準的な化学療法であるEP療法とIP療法が実施されています。しかし、神経内分泌がんにおいてどちらの化学療法がより優れているか分かっていませんでした。
本試験の結果、両治療法の効果に明らかな差はなくどちらの治療法も標準治療として勧められることが明らかとなりました。
本試験の成果は、米国学術雑誌「JAMA Oncology」に米国時間2022年8 月18日(日本時間8月19日)付で発表されました。
本成果を基に、神経内分泌がんでのさらに有効な治療法の開発と、他の希少がんでの研究開発の促進が期待されます。
背景
神経内分泌がんは、神経内分泌細胞に由来するがんで、膵臓や消化管、肺など全身のさまざまな部位から発生します。増殖速度が速く、早期に転移・再発を起こしやすい傾向があるため、有効な治療法の確立が強く望まれていますが、希少であるため臨床試験の実施が難しいことなどからその実現には至っていませんでした。
神経内分泌がんの治療は、腫瘍が局所に限局していて手術で完全に腫瘍を取り除くことが可能な場合は切除を検討しますが、増殖速度が速いため切除が可能な場合は少なく、多くの場合は病状制御を目的とした化学療法が行われます。
神経内分泌がんに対する化学療法は、性質が比較的類似している小細胞肺がんの化学療法に準じて、エトポシド+シスプラチン療法(EP療法)またはイリノテカン+シスプラチン療法(IP療法)が国内外で広く用いられてきました。しかし、神経内分泌がんの治療として、EP療法とIP療法のどちらがより効果が望める治療かは判明しておらず、科学的根拠に基づき治療を選択するには、ランダム化第III相試験(登録された患者さんをランダムに各治療群に割り付け、治療成績を比較する検証的な研究)で確認をする必要がありました。
しかし、ランダム化第III相試験を行うには多くの患者さんに参加いただく必要があり、希少がんである神経内分泌がんでは実施が困難と考えられ、世界中で今まで実施されたことは一度もありませんでした。
JCOGでは、神経内分泌がんが様々な臓器に発生し得るという特性に注目し、肝胆膵グループ、胃がんグループ、食道がんグループが合同で研究計画を立案し、神経内分泌がんに対するランダム化第III相試験を実現しました。
研究方法
神経内分泌がんの患者さんに対し、EP療法とIP療法のどちらがより延命効果が高いのかを検証する目的でランダム化第III相試験を実施しました。
本試験は組織学的に診断された、消化器原発の神経内分泌がんの患者さんを対象に行いました。年齢は20から75歳、全身状態のスコア(Performance status)が0か1と良好、規定の採血データで臓器機能障害がないなどの適格規準を満たす患者さんに参加いただきました。登録された患者さんは1:1にEP療法かIP療法に割り付けられ、どちらかの治療を受けていただきました。
神経内分泌がんは稀な腫瘍であるため、他の希少がんと同様、正確な病理診断が難しく、診断においては細胞増殖の指標、細胞形態、他のタイプの腫瘍の併存などの評価を行う必要があります。最終的に神経内分泌がんと診断されるか否かによって適する治療が異なるため、病理診断は非常に重要です。本試験では登録された患者さんの診断について消化器腫瘍を専門とする病理医による病理中央診断*2を行いました。

研究結果
2014年8月から2020年3月の期間に、消化器原発の神経内分泌がん(食道、胃、十二指腸、虫垂、結腸、直腸、胆嚢、肝外胆管、Vater膨大部、膵、肝)の患者さん170人が登録されました。
登録完了後、追跡期間を経て最終解析を実施した結果、生存期間中央値がEP療法群で12.5か月、IP療法群で10.9か月(EP療法群に対するIP療法群のハザード比*31.043、P値=0.80 〔両側検定〕)でした。生存期間の中央値だけをみるとEP療法群のほうが若干よく見えますが、全体として死亡リスクの比に有意差がなく、どちらかの治療がより有効性が高い、という結論にはなりません。原発臓器ごとや、病理学的な分類・特徴などにより、どちらかの治療がより適切な集団がないか、サブグループ解析を実施しましたが、事前に計画されたサブグループ解析ではそのような集団は特定されませんでした。
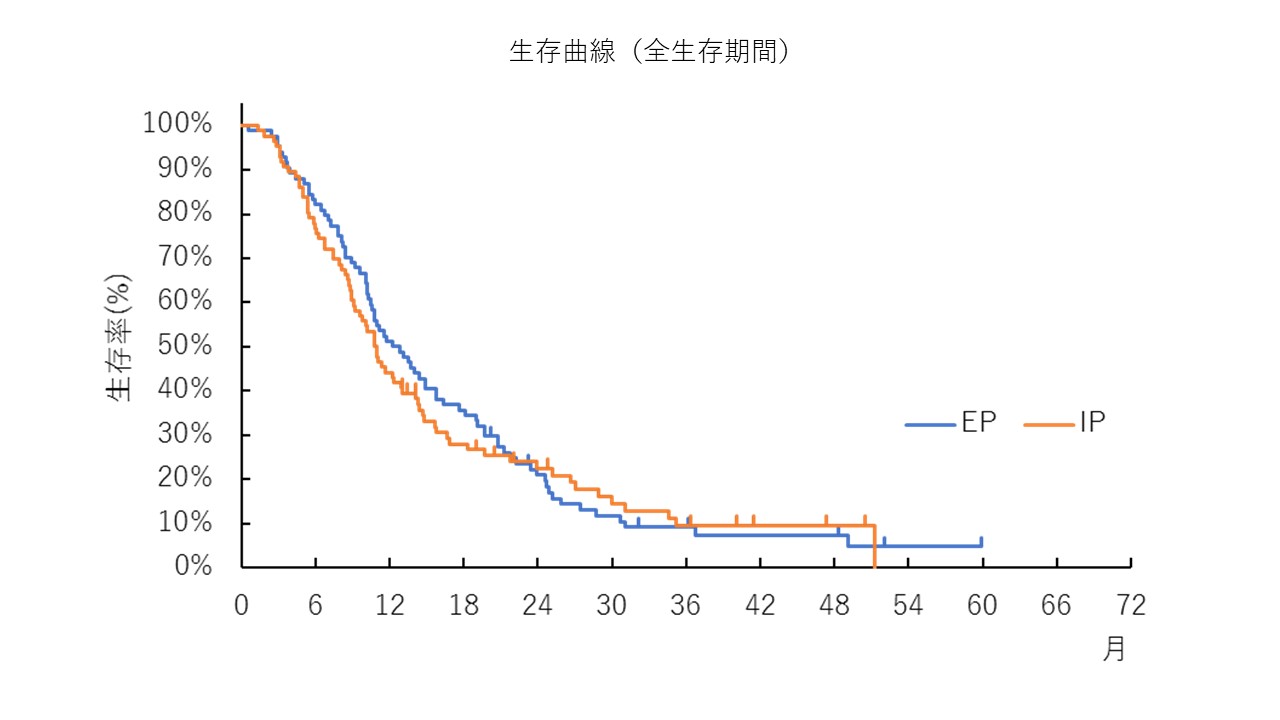
そのほか、無増悪生存期間の中央値がEP療法群で5.6か月、IP療法群で5.1か月、奏効割合はEP療法群で54.5%、IP療法群で52.5%でした。主なGrade 3以上の有害事象(%はEP療法群/IP療法群の順)は好中球減少(91.5%/53.7%)、白血球減少(61.0%/30.5%)、発熱性好中球減少*4(26.8%/12.2%)でした。発熱性好中球減少がEP療法群で高いことが研究の途中で判明したため、研究途中で、G-CSF*5製剤の予防投与を推奨するように研究計画書を改訂しました。それが功を奏したようで、研究終了後に解析したところ、EP療法群においても予防的に投与した場合は5.1%に発生割合を抑えられていることが分かりました。
また、本試験での病理中央診断では、9.5%の登録例が神経内分泌がんとは異なる診断となりました。この結果は神経内分泌がんの病理診断の難しさを示すとともに、病理中央診断の実施により、本試験がより適正な評価を行うことにつながったと考えられます。
以上のことを鑑み、今後、進行・再発の神経内分泌がんに対して抗がん剤を行う場合は、EP療法、IP療法いずれも遜色なく、両治療法が標準治療と考えてよい、という結論になります。また、EP療法を実施する場合はG-CSF製剤の予防投与が推奨されます。

本結果の詳細は以下からご覧いただけます。
臨床研究実施計画・研究概要公開システム
https://jrct.niph.go.jp/detail/573/jRCT/1(外部ページにリンクします)
展望
これまで、神経内分泌がんの治療においては、EP療法とIP療法のどちらが優れているか判明しておらず、診療の現場ではどちらを選択したらよいのかわからない、といった声が良く聞かれました。しかし、本試験によりどちらの治療も標準治療と位置付けられました。それによりどちらも「科学的根拠に基づいた選択肢」としたうえで、治療前の体調や予測される副作用などを踏まえて総合的に判断し、患者さんと担当医との相談で決定することができるようになりました。標準治療が確立するということは、さらなる研究の足掛かりとなり、とりわけ希少がんにおいては意義の大きい研究成果であるといえます。
JCOGでは、今回確立した標準治療をもとに、さらなる治療成績向上を目指して、次なる治療開発を計画しています。また、希少がんにもかかわらず、多くの患者さんに参加いただき大規模な臨床試験を実現し、治療効果を含む臨床情報が得られました。さらに病理中央診断による正確かつ詳細な病理情報が、治療効果などの臨床情報と紐づいたことで、今後附随研究などでさらなる病態解明とさらに有効な治療法の開発が期待されます。
本試験にご協力いただきました患者さんとご家族に心より感謝申し上げます。
発表論文
雑誌名
JAMA Oncology
タイトル
Etoposide+cisplatin versus irinotecan+cisplatin therapy for advanced neuroendocrine carcinoma of the digestive system: The TOPIC-NEC (JCOG1213) randomized phase III clinical trial
著者
Chigusa Morizane4 M.D., Ph.D., Nozomu Machida5 M.D., Ph.D., Yoshitaka Honma7 M.D., Takuji Okusaka1 M.D., Ph.D., Narikazu Boku2 M.D., Ph.D., Ken Kato3・6 M.D., Ph.D., Shogo Nomura Ph.D., Nobuyoshi Hiraoka M.D., Ph.D., Shigeki Sekine M.D., Ph.D., Hirokazu Taniguchi MD. PhD, Naohiro Okano M.D., Ph.D., Kensei Yamaguchi M.D., Takuji Sato M.D., Ph.D., Masafumi Ikeda M.D., Ph.D, Nobumasa Mizuno M.D., Ph.D., Masato Ozaka M.D., Tomoko Kataoka DDS, Ph.D., Makoto Ueno M.D., Ph.D., Yuko Kitagawa M.D., Ph.D., Masanori Terashima M.D., PhD, Junji Furuse M.D., Ph.D., Japan Clinical Oncology Group (JCOG)
1:研究代表者(肝胆膵グループ) 国立がん研究センター中央病院 奥坂 拓志
2:研究代表者(胃がんグループ) 東京大学医科学研究所附属病院 朴 成和
3:研究代表者(食道がんグループ) 国立がん研究センター中央病院 加藤 健
4:研究事務局(肝胆膵グループ) 国立がん研究センター中央病院 森實千種
5:研究事務局(胃がんグループ) 神奈川県立がんセンター 町田 望
6:研究事務局(食道がんグループ) 国立がん研究センター中央病院 加藤 健
7:研究事務局(食道がんグループ) 国立がん研究センター中央病院 本間 義崇
掲載日
米国時間2022年8月18日(日本時間2022年8月19日)
DOI
10.1001/jamaoncol.2022.3395
URL
https://jamanetwork.com/journals/jamaoncology/fullarticle/2795418(外部サイトにリンクします)
研究費
国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業
消化器神経内分泌癌に対する標準治療の確立に関する研究
国立がん研究センター研究開発費
26-A-4「成人固形がんに対する標準治療確立のための基盤研究」
29-A-3「成人固形がんに対する標準治療確立のための基盤研究(JCOG)」
2020-J-3「成人固形がんに対する標準治療確立のための基盤研究(JCOG)」
日本臨床腫瘍研究グループ(JCOG)の概要
日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)は、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立することを目的として研究活動を行っています。各種がんの治癒率の向上とがん治療の質の向上を図ることを目標としています。
JCOGは国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センターが管轄する各種委員会、中央支援機構(国立がん研究センター中央病院臨床研究支援部門)から構成されており、法人格を有さない任意団体です。
JCOG website: http://www.jcog.jp/index.htm(外部サイトにリンクします)
用語解説
*1 ランダム化第III相試験
登録された患者さんをランダムに各治療群に割り付け、治療成績を比較する検証的な研究
*2 病理中央診断
登録された患者さんの病理組織をエキスパートの病理医(この研究で消化管3人、肝胆膵3人の合計6人のチーム編成でした)で、議論をしながら診断を確認します。これによって、研究のデータの質がより高まります。
*3 ハザード比
時間当たりの死亡のリスクの比
*4 発熱性好中球減少
細菌と戦う好中球が減少している最中に起こる発熱で、重篤な感染につながり得る、注意が必要な病態といえます。
*5 G-CSF製剤
白血球・好中球の増殖を刺激する薬剤。抗がん剤を投与後に白血球や好中球が下がりすぎてしまった場合に、その病態を改善させるために投与する「治療的投与」と、もともと過去のデータから発熱性好中球減少が起こりやすいことが分かっている治療を行う場合に、あらかじめ抗がん剤投与直後にG-CSF製剤を投与する「予防的投与」があります。この研究では、発熱性好中球減少が最初の想定よりも高頻度で起こることが分かったため、途中で研究計画書を改訂し、G-CSF製剤を予防投与することを推奨しました。
お問い合わせ先
研究に関する問い合わせ
日本臨床腫瘍研究グループ(JCOG)
国立研究開発法人 国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 多施設研究支援室
Eメール:webmaster●ml.jcog.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表) Eメール:ncc-admin●ncc.go.jp
関連ファイル
関連リンク
- 中央病院 肝胆膵内科
- JCOG(日本臨床腫瘍研究グループ) (外部サイトにリンクします)
- 希少がんセンター さまざまな希少がんの解説 神経内分泌がん (外部サイトにリンクします)
