世界最大の胃がんゲノム解析により日本人胃がんの治療標的を同定 飲酒との関連もゲノム解析から初めて発見し新たな予防法の開発が期待
2023年3月14日
国立研究開発法人国立がん研究センター
国立大学法人東京大学医科学研究所
In English
発表のポイント
- 国際共同研究によって日本人胃がん症例697症例を含む総計1,457例の世界最大となる胃がんゲノム解析を行いました。
- 予後不良であるびまん型胃がんについてゲノム解析から飲酒との関連を初めて発見しました。さらにその発生機序を解明することで予防につなげることが期待されます。
- 免疫療法を含め日本人胃がんにおける治療標的・バイオマーカーの全体像を解明し、今後の新たな胃がん治療法開発や予後改善に貢献することが期待されます。
概要
国立研究開発法人国立がん研究センター (理事長:中釜 斉、東京都中央区) 研究所(所長:間野博行) がんゲノミクス研究分野分野長 柴田龍弘(国立大学法人東京大学医科学研究所附属ヒトゲノム解析センターゲノム医科学分野教授兼任)を中心とする研究チームは、国際がんゲノムコンソーシアム (ICGC-ARGO)(注1)における国際共同研究として、日本人胃がん症例697症例を含む総計1,457例の世界最大となる胃がんゲノム解析を行い、新たな治療標的として有望なものも含めこれまでで最大の75個のドライバー遺伝子(注2)を発見しました。またこれまで原因不明であったびまん型胃がん(注3)について、飲酒に関連したゲノム異常がその発症に関連することを初めて明らかにした。また胃がんに対する免疫治療(注4)における新たなゲノムバイオマーカーも16個同定しました。
びまん型胃がんを含め、日本人胃がんにおける治療標的となるドライバー遺伝子や免疫療法の予測因子となりうるゲノムバイオマーカーの全体像を解明し、これらのデータは、今後本邦における胃がん治療法開発や予後改善に貢献することが期待されます。
本研究成果は、米国科学雑誌「Nature Genetics」に、米国時間2023年3月13日(日本時間3月14日午前1時)付で掲載されました。
本研究は、国立がん研究センター、東京大学医科学研究所・先端科学技術研究センター、東京大学、公立大学法人横浜市立大学、Duke-NUS Medical School Singaporeとの共同研究によって行われました。
背景
胃がんは、日本における罹患者数 (2019年)と死亡数 (2021年)がともに3位と上位に位置する対策が極めて重要ながんです。(出典:国立がん研究センターがん情報サービス●)
胃がんは病理組織学的には、大きく腸型(intestinal type)とびまん型(diffuse-type)に分類されます。胃がんの治療は、内視鏡や手術による切除・細胞障害性抗がん剤治療に加えて、HER2といったがん遺伝子を標的とした分子標的治療薬やゲノム変異が多い症例(高度変異胃がん)に対する免疫チェックポイント阻害剤によって、年々予後は改善しているものの、スキルス胃がんに代表されるようなびまん型胃がんについては未だに予後が不良で、有効な治療法の開発が望まれています。
また胃がんの発生要因としては、ピロリ菌感染並びにEBウイルス (Epstein-Barr virus: EBV)感染が重要なリスク因子で、特にピロリ菌感染を契機とした慢性胃炎は発がんの温床となり、炎症に伴う再生性変化が腸型胃がんの発症と強く関連しています。一方でびまん型胃がんについては発症要因については未解明であり、予防に向けた原因解明が強く期待されています。
国際コンソーシアム(国際がんゲノムコンソーシアム:ICGC-ARGO)では、大規模ながんゲノム解析によって、新たな治療薬や発がん要因の同定を進める研究が行われており、日本やアジアに多いがん(胃がん・肝臓がん・胆道がん)については、これまで日本の研究チームから多くの研究成果を発表しています。
研究方法・研究結果
世界最大の胃がんゲノム解析
国際がんゲノムコンソーシアムにおける国際共同研究により、日本人胃がん症例697症例と、米国 (442症例)・中国 (217症例)・韓国 (52症例)・シンガポール(49症例)における胃がんゲノムデータと合わせて総計1,457例となる世界最大の症例コホートを用いて全エクソン解読 (1,271症例)並びに全ゲノム(172症例)解読、RNAシークエンス解析 (895症例)解析を実施しました。
表1:本研究で解析した胃がん症例数
| 日本人コホート(国立がん研究センター・東京大学・横浜市立大学) | 697症例 |
|---|---|
| 米国TCGA(注5)コホート | 442症例 |
| 中国コホート | 217症例 |
| 韓国コホート | 52症例 |
| シンガポールコホート | 49症例 |
| 合計 | 1,457症例 |
| 全ゲノム解析 | 172症例 |
|---|---|
| 全エクソン解析 | 1,271症例 |
| RNAシークエンス解析(注) | 895症例 |
(注)RNAシークエンス解析のみの症例もあり。またRNAシークエンスは高品質RNAが得られた症例のみで実施。
びまん型胃がんにおける発症要因の同定
喫煙や紫外線などがんの発生要因は、細胞のDNAに特徴的な変異(変異シグネチャー(注6))を起こすことが知られています。そのため、がん細胞に生じた変異シグネチャーを解析することで、そのがんの発生要因を推定することが可能です。今回の胃がんのゲノム解析においては、14種類の変異シグネチャーが同定され、中でもSBS16という変異シグネチャーは、びまん型胃がん・東アジア人種に多く、また男性、飲酒量、アルコールを代謝しにくい体質(分解能が弱いゲノム多型(注7) (ADH1B/ALDH2))と有意な相関を示しました。更にびまん型胃がんの発症において鍵となるドライバー遺伝子であるRHOA遺伝子の変異がSBS16で誘発されることが示され、飲酒に関連したゲノム異常がRHOAドライバー変異を誘発し、びまん型胃がんを発症することをゲノム解析から明らかにしました。
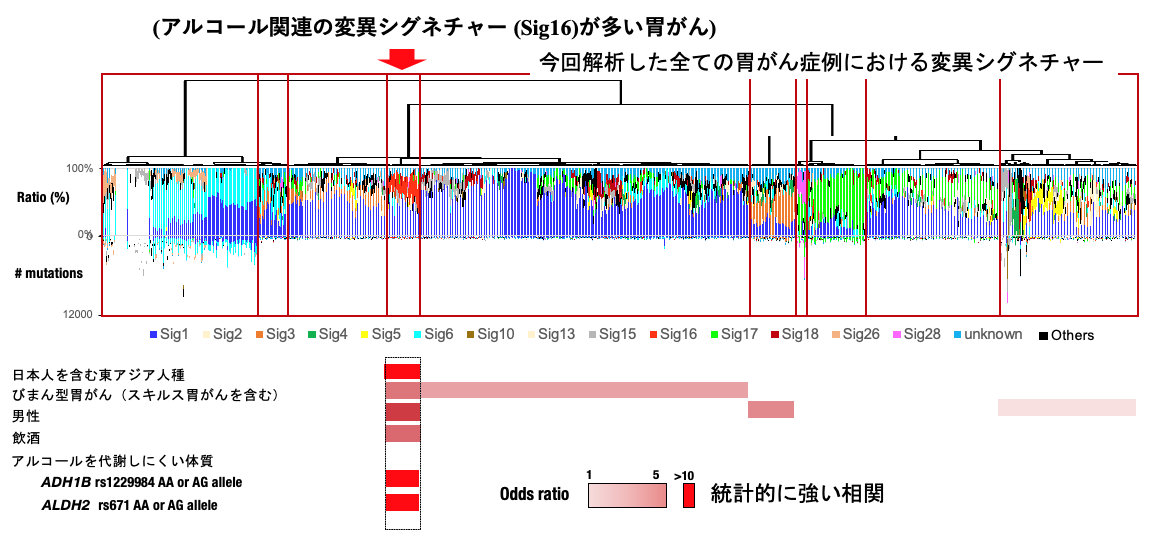
図1:アルコール関連の変異シグネチャーが多い胃がんのゲノム解析結果
同定された14種類の変異シグネチャーの中でもSBS16はびまん型胃がん・東アジア人種に多く、また男性、飲酒量やアルコール分解能が弱いゲノム多型(注7) (ADH1B/ALDH2)と有意な相関を示した。
胃がんにおけるドライバー遺伝子の全貌解明
今回の解析から、胃がんにおけるドライバー遺伝子を新規含め全部で75個発見しました。これはこれまでの米国TCGAの報告である25個を大きく上回る結果です。何らかの治療法が知られているドライバー遺伝子を一つ以上持っている症例は全体の約25% (24.6%)に認められ、すでに胃がんに対して臨床で使用可能な治療薬がある症例は全体の約10%(9.6%)でした。治療標的としては、VEGFA, FGFR2キナーゼ、PD-L1/L2といった免疫チェックポイント分子のゲノム異常(3’UTR構造異常や遺伝子増幅)、NRG 1/ 2やRETなど複数のキナーゼ融合遺伝子が同定でき、新たな治療標的として有望と考えられました。
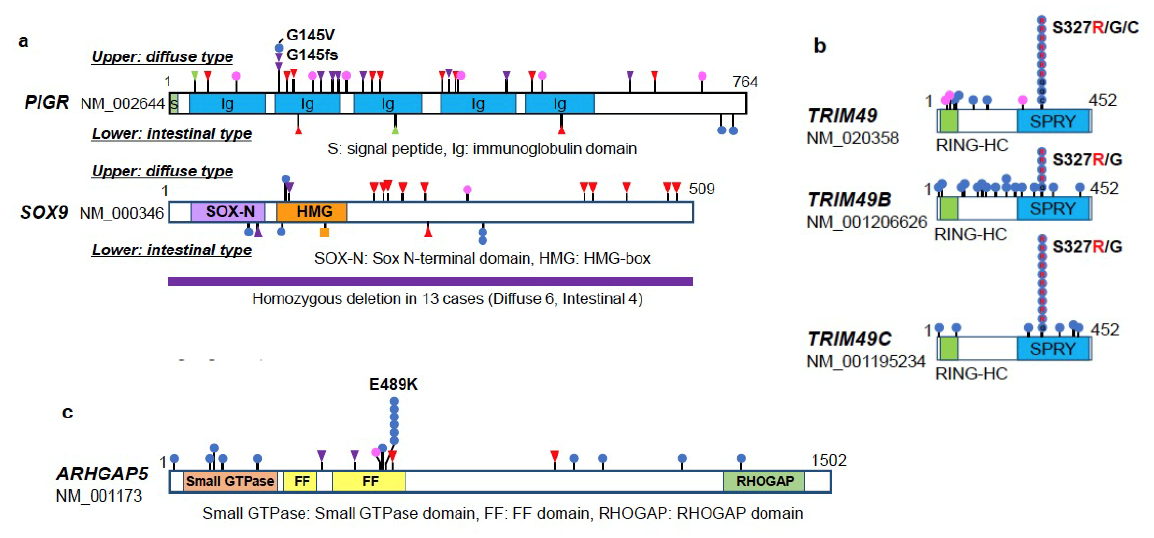
図2:本研究で発見された新たな胃がんドライバー遺伝子
- びまん型胃がんで有意に異常が多い新規ドライバー遺伝子 (PIGR並びにSOX9)
- 特徴的なホットスポット変異を示す新規ドライバー遺伝子 (TRIM49)
- ARHGAP5では489番目のアミノ酸に変異が集中しており、この変異とEGFR遺伝子増幅が共存していた。
最近注目されているRNAスプライシング異常(注8)について、今回の大規模なゲノムデータと発現データを組み合わせることで、網羅的な解析を行いました。その結果、胃がんにおけるスプライシング異常はがん抑制遺伝子であるTP53とCDH1に最も高頻度に起こっていることが明らかとなりました(図3上)。更にびまん型胃がんにおけるCDH1のスプライシング異常が特定の部位に集中していることを見出し、びまん型胃がんの発症においてCDH1変異はドミナントネガティブ(優性阻害(注9))として作用する可能性を明らかにしました。(図3下)
図3:胃がんにおけるスプライシング異常の全体像

胃がんにおける免疫療法バイオマーカーの同定
免疫細胞はがん抗原を認識し、サイトカインであるインターフェロンガンマを放出して、がん細胞を攻撃することが知られています。インターフェロンガンマの刺激はがん細胞上の受容体(インターフェロンガンマ受容体:INFGR1 /2)とその下流シグナル分子 (JAK1 /2)によって伝達されます(下図)。高度変異胃がんでは、HLA遺伝子やB2M遺伝子といったがん抗原提示に関わる分子、更にはこうしたインターフェロンガンマ経路分子における機能喪失型変異やゲノム異常を70%以上の症例で認め、こうした症例では免疫チェックポイント阻害剤の効果が低い可能性が考えられました(図4)。更に発現解析データを用いて腫瘍内における免疫細胞の量や活性化について評価した結果、HER2遺伝子増幅、KRAS変異、TP53変異、WNT経路異常といったドライバー遺伝子が低免疫活性状態(免疫療法が効きにくい可能性)と相関し、一方でPIK3CA変異やクロマチン制御分子 (ARID1A, ARID2, BAP1など)異常が高免疫活性化状態(免疫活性が高い状態)と相関することを明らかにしました。全部で16個のドライバー異常が免疫状態と相関しており、これらは胃がんに対する免疫治療における新たなゲノムバイオマーカーとなる可能性があります。(図5)
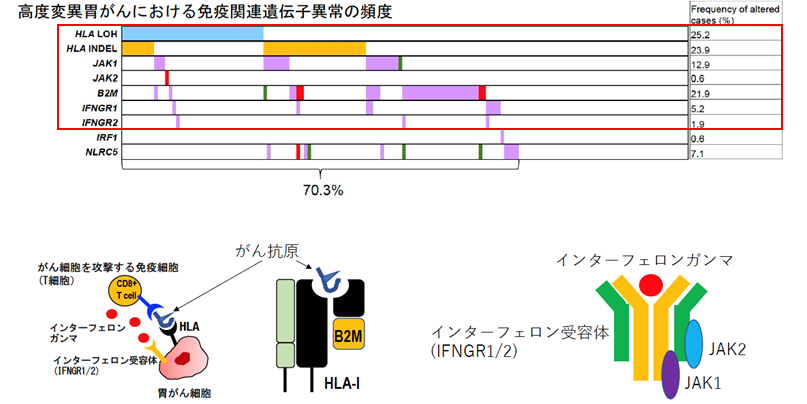
図4:高度変異胃がんにおける免疫関連遺伝子異常の頻度
図上:がん抗原の提示(HLA)やがん免疫反応(IFNG/JAK)に重要な遺伝子の異常が高度変異胃がんの約70%の症例で見られた。(水色:コピー数欠失、オレンジ:フレームシフト変異、紫:ミスセンス変異、緑:ナンセンス変異、赤:スプライシング異常)
図下:胃がん細胞における免疫応答 抗原提示とIFNガンマとその受容体の構造模式図
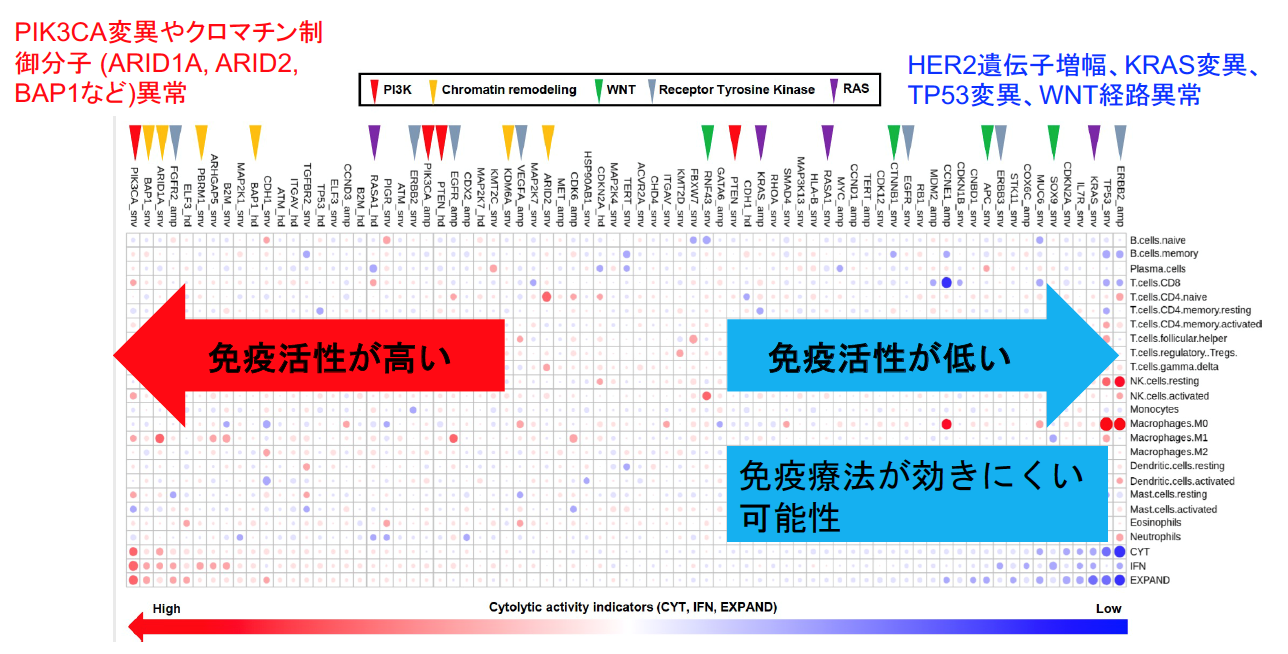
図5:免疫活性と胃がんドライバー遺伝子の関連
免疫活性が低い症例ではHER2, KRAS, TP53といったドライバー遺伝子の異常が多く、一方で免疫活性が高い症例ではPIK3CAやクロマチン制御分子の異常が多い。
展望
本研究によって、これまで発症要因が不明であった予後不良なびまん型胃がんについて飲酒並びにアルコール代謝関連酵素の遺伝子多型が重要な危険因子であることを初めて明らかにしました。今後飲酒に関連するゲノム異常がどのように発生するのかを詳細に検討することで、びまん型胃がんの予防につなげていくことが期待されます。また、びまん型胃がんを含め、日本人胃がんにおける治療標的となるドライバー遺伝子や免疫療法の予測因子となりうるゲノムバイオマーカーの全体像を解明しました。これらのデータは、今後日本人における胃がん治療法開発や予後改善に貢献することが期待されます。
発表論文
雑誌名
Nature Genetics
タイトル
Multi-ancestral genomic and transcriptomic analyses of gastric cancer
著者
Yasushi Totoki, Mihoko Saito-Adachi, Yuichi Shiraishi, Daisuke Komura, Hiromi Nakamura, Akihiro Suzuki, Kenji Tatsuno, Hirofumi Rokutan, Natsuko Hama, Shogo Yamamoto, Hanako Ono, Yasuhito Arai, Fumie Hosoda, Hiroto Katoh, Kenichi Chiba, Naoko Iida, Genta Nagae, Hiroki Ueda, Chen Shihang, Shigeki Sekine, Hiroyuki Abe, Sachiyo Nomura, Tetsuya Matsuura, Eiji Sakai, Takashi Ohshima, Yasushi Rino, Khay Guan Yeoh, Jimmy So, Kaushal Sanghvi, Richie Soong, Akihiko Fukagawa, Shinichi Yachida, Mamoru Kato, Yasuyuki Seto, Tetsuo Ushiku, Atsushi Nakajima, Hitoshi Katai, Patrick Tan, Shumpei Ishikawa, Hiroyuki Aburatani, Tatsuhiro Shibata
掲載日
2023年3月13日付(日本時間3月14日午前1時)
DOI
10.1038/s41588-023-01333-x
URL
https://www.nature.com/articles/s41588-023-01333-x(外部サイトにリンクします)
研究費
- 革新的がん医療実用化研究事業 (国立研究開発法人日本医療研究開発機構):国際共同研究に資する大規模日本人がんゲノム・オミックス・臨床データ統合解析とゲノム医療推進に向けた知識基盤構築
- 国立がん研究センターがん研究開発費 (2020-A7)
- 戦略的創造研究推進事業 (国立研究開発法人 科学技術振興機構)
主な共同研究機関
東京大学 医科学研究所
ゲノム医科学分野
東京大学 先端科学技術研究センター
ゲノムサイエンス&メディシン分野 油谷 浩幸 シニアリサーチフェロー
東京大学 大学院医学系研究科
消化管外科学分野:瀬戸 泰之 教授 (医学部附属病院 胃・食道外科)
衛生学分野:石川 俊平 教授 (医学部附属病院 病理部)
人体病理学・病理診断学分野:牛久 哲男 教授 (医学部附属病院 病理部)
横浜市立大学 大学院医学研究科
肝胆膵消化器病学教室 中島 淳 教授
Duke-NUS Medical School Singapore
Cancer and Stem Cell Biology Patrick Tan教授
用語解説
(注1)国際がんゲノムコンソーシアム (ICGC-ARGO)
2008年から開始された世界最大のがんゲノムに関する国際研究共同体 (ICGC: International Cancer Genome Consortium)。現在2期目のICGC-ARGO (International Cancer Genome Consortium-Accelerating Research in Genomic Oncology)は、全部で100,000症例のがんのゲノムデータを集積し、かつ同時に豊富な臨床情報とともに解析を行うことによって、がん撲滅に向けた重要かつ未解決の課題の解決に取り組んでいる。
(注2)ドライバー遺伝子
異常を起こすことによってがんの発生や進展に寄与する遺伝子を総称してがんドライバー遺伝子と呼ぶ。がん細胞の増殖や転移を促進する「がん遺伝子」とそれらを抑制する「がん抑制遺伝子」がある。がんドライバー遺伝子を標的とした診断(パネル遺伝子診断)や治療(分子標的薬治療)が現在ゲノム医療として進められている。
(注3)びまん型胃がん
がん細胞同士の接着が乏しく、バラバラになりながら浸潤するタイプの胃がん。間質の線維化が強い症例はスキルス胃がんとして知られる。低分化で予後不良である。
(注4)免疫治療
がん細胞を攻撃する免疫細胞を活性化するがん治療法。がん細胞が免疫細胞の機能を弱めるために使っている分子(免疫チェックポイント分子)を標的として、免疫チェックポイント阻害剤が胃がんでは臨床で使われている。
(注5)米国TCGA (The Cancer Genome Atlas)
米国で行われた大規模ながんゲノム解析プロジェクト。胃がんを含む33種類のがんについて、ゲノム・RNA・エピゲノム・プロテオームといったオミックス解析を行い、そのデータを広く公開している。
(注6)変異シグネチャー
がん細胞のゲノムに発生する様々な変異には、その要因によって異なったパターンを示すことが知られており、そうしたパターンを変異シグネチャーと呼ぶ。これまでヒトのがんにおいては50種類以上のパターンがあることが知られており、そのうち3分の1はゲノム修復の異常、3分の1は環境要因によるものであることが判明しているが、残り3分の1は未だ原因不明である。
(注7)アルコール分解能が弱いゲノム多型
1B型アルコール脱水素酵素 (ADH1B)とは、エタノールをアセトアルデヒドに酸化する酵素の一つで、アルデヒドデヒドロゲナーゼ2(ALDH2)は、このアセトアルデヒドを酸化して代謝する酵素です。これらは遺伝子の点突然変異により働きの弱い酵素と強い酵素があります。
(注8)RNAスプライシング異常
タンパク質はメッセンジャーRNA(mRNA)の情報を元に作られる。RNAスプライシングとは、mRNAの前駆体である pre-mRNAからintronと呼ばれる部分を除去してmRNAを生成する過程である。がん細胞では、ゲノム異常やスプライシングに関わる分子の異常などの様々な要因によって、スプライシングの異常が起こり、異常なタンパク質が作られることが知られており、こうしたスプライシング異常を標的とした治療開発が進められている。
(注9)ドミナントネガティブ(優性阻害)
遺伝子の変異産物が正常産物に対してドミナント(優位)に働いて,正常産物の作用を阻害する(ネガティブな効果)作用のこと。例えばCDH1のように二量体を形成して機能する場合,不活性型の変異体が正常体と複合体を形成することにより正常体の作用を阻害することで癌抑制遺伝子としての機能を示す。
問い合わせ先
研究に関する問い合わせ
国立がん研究センター研究所
がんゲノミクス研究分野 分野長 柴田 龍弘
(東京大学医科学研究所附属ヒトゲノム解析センターゲノム医科学分野教授兼任)
Eメール:tashibat●ncc.go.jp
広報窓口
国立がん研究センター 企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
東京大学医科学研究所 国際学術連携室(広報)
電話番号:090-9832-9760
Eメール:koho●ims.u-tokyo.ac.jp
