非小細胞肺がんを対象としたニボルマブ+イピリムマブ併用療法の多施設共同臨床試験に係る現状と重要な注意事項について
2023年4月28日
国立研究開発法人国立がん研究センター
日本臨床腫瘍研究グループ
発表のポイント
- 未治療進行・再発非小細胞肺がんを対象とした多施設共同臨床試験において、免疫チェックポイント阻害薬の併用療法であるニボルマブ+イピリムマブ併用療法を行った患者さんで、治療との因果関係を否定できない死亡が予期された範囲を超えて認められましたので試験を中止しました。
- 現在、本試験以外でニボルマブ+イピリムマブ併用療法を受けている未治療進行・再発非小細胞肺がんの患者さんは、治療の効果や副作用を勘案した慎重な判断が必要なため、自己判断で治療を中断せず、主治医と相談してください。
- 今回、亡くなった患者さんの副作用の傾向や対応方法、注意点を報告しますので、関係する医療従事者と患者さんは注意してください。
概要
日本臨床腫瘍研究グループ(JCOG)は、未治療進行・再発非小細胞肺がんに対する有効性が認められ保険が適用されている化学療法(注1)と免疫チェクポイント阻害薬の併用療法であるペムブロリズマブ療法(2018年12月保険適用)とニボルマブ+イピリムマブ併用療法(2020年11月保険適用)について、どちらの治療効果が優れているかを評価するため両併用療法の有効性を比較する第III相試験(JCOG2007試験、特定臨床研究)を全国59施設と共同で2021年4月より実施しておりましたが、ニボルマブ+イピリムマブ併用療法を行った患者さんで予期していた範囲を超える約7.4%(148人のうち11人)の治療関連死亡(治療との因果関係を否定できない死亡)が認められました。そのため、患者さんの安全性を担保して本試験を継続することは困難と判断し、2023年3月30日に本試験を中止しました。
現時点で、原因は分かっていませんが、イピリムマブの影響が強い可能性が考えられるため、本試験でニボルマブ+イピリムマブ併用療法を行っていた患者さんにはイピリムマブを中止し、ニボルマブのみで継続することをお奨めしています。
現在、本試験以外でニボルマブ+イピリムマブ併用療法を受けている未治療進行・再発非小細胞肺がんの患者さんは、治療の効果や副作用を勘案した慎重な判断が必要なため、自己判断で治療を中断せず、必ず主治医と相談してください。治療の効果や副作用を加味した判断が必要です。また、本試験で認められた副作用には対応に注意が必要なものや鑑別が難しいものがありますので、今回、亡くなった患者さんの副作用(肺臓炎、サイトカイン放出症候群、敗血症、心筋炎、血球貧食症候群)の傾向や対応方法、注意点を報告しますので、関係する医療従事者や患者さんは、十分に注意してください。
注1 肺がんの組織亜型毎に異なり、非扁平上皮がんの場合はカルボプラチン+ペメトレキセド療法、扁平上皮がんの場合はカルボプラチン+パクリタキセル療法
背景
国内で年間概ね1.7万人が診断されていると推測される未治療進行・再発非小細胞肺がんの患者さんに対しては、いくつかの種類の「化学療法+免疫チェックポイント阻害薬」の併用治療が厚生労働省より承認され、標準治療として広く行われています。その中で免疫チェックポイント阻害薬の1つであるペムブロリズマブを用いた「化学療法+ペムブロリズマブ療法」は2018年12月に保険が適用され、最も広く用いられている治療法です。2020年11月に2種類の作用の異なる免疫チェックポイント阻害薬であるニボルマブとイピリムマブを用いた「化学療法+ニボルマブ+イピリムマブ療法」が新たに保険適用されました。しかし、どちらの併用療法を第一選択とするのが良いか分かっていませんでした。2種類の免疫チェックポイント阻害薬を併用する「化学療法+ニボルマブ+イピリムマブ療法」はこれまでの臨床試験の結果から、より高い効果が得られるのではないかと期待されていました。
本試験の概要
JCOGの肺がん内科グループでは未治療の進行・再発非小細胞肺がんと診断された患者さんを対象として、「化学療法+ペムブロリズマブ療法」(A群)に比べて「化学療法+ニボルマブ+イピリムマブ療法」(B群)の治療効果が優れているかどうかを調べるために、このJCOG2007試験を計画し、全国59施設の参加の下で実施しました(図1)。詳細につきましては臨床研究実施計画・研究概要公開システム(jRCT)(https://jrct.niph.go.jp/latest-detail/jRCTs031210013)でご覧いただけます。
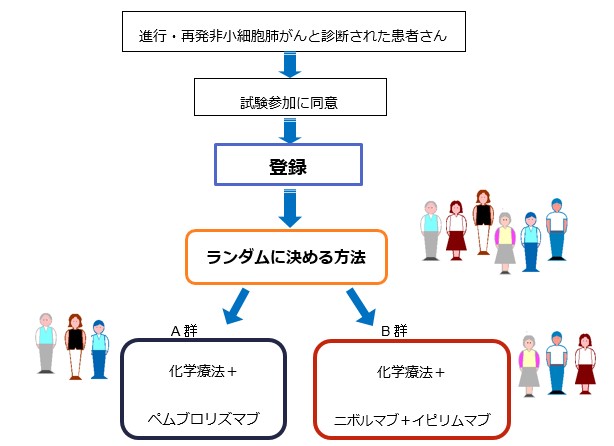
図1:JCOG2007の試験デザイン
本試験は2021年4月に開始され、2022年4月までに全体で261人(A群130名、B群131名)の患者さんに参加いただきましたが、B群「化学療法+ニボルマブ+イピリムマブ療法」において、9人(6.9%)の患者さんに治療の副作用による死亡(治療関連死亡:肺臓炎*1 3人、サイトカイン放出症候群*2 2人、敗血症*3 1人、心筋炎*4 2人、血球貪食症候群*5 1人)が起きました。この死亡数は、予期していた範囲である5%を超えていたことから、2022年4月28日に登録を一時停止しました。この試験に参加している施設の医師の間で死亡となった患者さんの詳細な経過を検討し、患者さんの安全性を確保するための方策を議論するとともに、患者さんへの説明文書の改訂や、患者さん用の臨床試験参加カードの作成、医師に対する副作用対策の講習、この試験以外での「化学療法+ニボルマブ+イピリムマブ」の副作用情報の収集などの取り組みを行いました。登録停止中にさらなる治療関連死亡は起きておりませんでした。
検討の結果、治療関連死亡で亡くなられた患者さんに多く見られた特徴を見出し(注:2)、その特徴をもった患者さんが試験に登録されないように規準を変更し、安全性を高めた上で2022年10月3日に登録を再開いたしました。注:2 白血球数が多く(>8,600/mm3)かつ好中球数とリンパ球数の比が大きい(>5)
登録再開後はさらに34人の患者さんに参加いただき、全体では295人(A群147名、B群148名)となりました。2023年3月16日にB群「化学療法+ニボルマブ+イピリムマブ療法」で治療された患者さんに10人目の治療関連死亡が起きました。しかもこの患者さんは、1年以上安定して治療が継続できていたにもかかわらず急激な経過でお亡くなりになりました。また、先述した注:2の条件に合致していなかったことから、安全性を高めたはずの変更後の登録の規準をもってしても防げなかった治療関連死亡と考えられました。私たちはこのことを重く受け止め、2023年3月30日にこの試験の中止を決定いたしました。
さらに2023年4月1日に肺臓炎のために11人目の治療関連死亡が報告されました。現時点までに、B群「化学療法+ニボルマブ+イピリムマブ療法」に登録された患者さん148人のうち11人(7.4%)の患者さんで治療関連死亡が起きたことになります(表1)。
表1:治療関連死亡一覧
|
年齢 |
性別 |
施設 |
事象名 |
治療開始から発症までの期間 |
治療開始から死亡までの期間 |
|
60歳代 |
女性 |
A |
肺臓炎 |
11日 |
73日 |
|
70歳代 |
男性 |
B |
心筋炎 |
102日 |
104日 |
|
60歳代 |
男性 |
C |
肺臓炎 |
43日 |
63日 |
|
70歳代 |
女性 |
D |
サイトカイン放出症候群(第1報では敗血症) |
5日 |
8日 |
|
60歳代 |
女性 |
A |
敗血症 |
75日 |
78日 |
|
50歳代 |
男性 |
E |
死亡NOS(心筋炎疑い)(第1報では死因NOSのみ) |
184日 |
184日 |
|
70歳代 |
男性 |
A |
サイトカイン放出症候群 |
180日 |
182日 |
|
60歳代 |
男性 |
F |
血球貪食症候群(第1報では多臓器不全) |
101日 |
105日 |
|
60歳代 |
男性 |
G |
肺臓炎 |
40日 |
62日 |
|
70歳代 |
女性 |
H |
サイトカイン放出症候群 |
391日 |
391日 |
|
60歳代 |
女性 |
F |
肺臓炎 |
129日 |
154日 |
今後の治療方針および注意事項
B群「化学療法+ニボルマブ+イピリムマブ療法」で治療関連死亡が予想を超えて多く発生した原因は現時点ではわかっていませんが、「イピリムマブ」の影響が強い可能性が考えられましたので、本試験でB群の治療を継続中の患者さんには「イピリムマブ」を中止して「ニボルマブのみ」を継続することをお奨めしております。ただし、これまでの一人一人の患者さんにおける治療の効果や副作用を勘案した慎重な判断が必要なため、それらを熟知している担当医と患者さんの間でよく相談して治療を行っていただくよう周知しているところです。
現在、本試験以外でニボルマブ+イピリムマブ併用療法を受けている未治療進行・再発非小細胞肺がんの患者さんにおいても、自己判断で治療を中断せず、必ず主治医と相談してください。
また、本試験で得られた経験に基づき、治療関連死亡の原因となったそれぞれの副作用について、以下のような点にご注意いただく必要があると考えています。
肺臓炎
肺の組織が炎症を起こし、風邪と似た咳・息切れ・発熱などの症状が見られます。初期症状が風邪によく似ていますが、風邪と異なり進行すると致命的になることがあります。
副作用時の注意点
肺臓炎での死亡は、本試験登録時点で肺機能が低い患者さん(腫瘍による無気肺を合併、右中下葉切除後など)に起きており、そのような患者さんが肺臓炎を発症した場合は死亡リスクが高い可能性があることを念頭に置いて治療(ステロイド治療、抗菌薬、全身管理)を行うことを推奨します。サイトカイン放出症候群
血中にさまざまな炎症を起こす液性因子(=サイトカイン)が放出され、悪寒、悪心、倦怠感、頭痛、発熱、頻脈、血圧変動等の種々の症状が起こる病態です。軽症ではインフルエンザや新型コロナウイルス感染様の症状が出現し、重症の場合には高熱、頻脈、血圧低下といったことから致命的になることがあります。
副作用時の注意点
- インフルエンザや敗血症との鑑別が難しいため、インフルエンザ様の症状があったり、敗血症が疑われるような場合には、本症の可能性も考慮して、一般採血検査(血算、生化学)、血液培養に加えてIL-6の測定を行うことを推奨します。
- 日本臨床腫瘍学会のがん免疫療法ガイドライン第2版を参照し、抗サイトカイン療法(全身性ステロイド、トシリズマブ)を開始する時期を逸しないようにすることを推奨します。
敗血症
感染を身体が制御できず血中に細菌が廻って、ショック、多臓器不全を起こします。副作用時の注意点
サイトカイン放出症候群と同様、インフルエンザ等との鑑別が難しいため、導入療法中か維持療法中かを問わず、敗血症を疑う症状が出現した場合には、速やかに一般採血検査(血算、生化学)に加えて血液培養を行い、抗菌薬の全身投与を開始することを推奨します。サイトカイン放出症候群の可能性も念頭に置く必要があります。
心筋炎
免疫細胞が心筋細胞を攻撃することで心臓に障害が起き、不整脈や心不全を起こします。動悸、息切れ、胸部圧迫感などの一般的な胸部症状に加え、脈拍異常(頻脈、徐脈、不整)、心不全症状として全身倦怠感、下腿浮腫、低血圧などが見られることがあります。いったん発症すると急速に悪化し死亡されることもあります。
副作用時の注意点
心筋炎発症直前のCPKが上昇していた患者さんが居られましたので、心筋炎発症の早期発見を目的として、各コース開始時にCPKを測定することを推奨します。CPK上昇がある場合には、CK-MBやトロポニンTなどを追加で測定して、循環器内科にコンサルテーションすることを推奨します。
血球貪食症候群
本来人間を守るべきマクロファージや好中球といった免疫細胞が暴走し、自らの赤血球や血小板を食べてしまう病態です。
副作用時の注意点
サイトカイン放出症候群、敗血症など、発熱を伴う病態との鑑別が難しく、検査所見として白血球、赤血球、血小板の1系統もしくは複数系統の減少、播種性血管内凝固症候群、フェリチンの異常高値などが出現します。ステロイドを中心とした免疫抑制療法が推奨されていますが、敗血症も想定して抗菌薬の全身投与を併用することを推奨します。
今後の対応
「化学療法+ニボルマブ+イピリムマブ療法」において、治療との因果関係を否定できない死亡が予期された範囲を超えて確認されたことを受け、本試験は中止となりましたが、これまでに本試験に参加いただいた患者さんの治療経過や副作用に関するデータは、最終的に「化学療法+ニボルマブ+イピリムマブ療法」の有効性と安全性を判断する上での大変重要な情報であり、今後も引き続き情報を集めさせていただきたいと考えております。
なお、本試験の結果は、今後の国内外の学会、学術雑誌で発表する予定です。
研究費
- 国立がん研究センター研究開発費
成人固形がんに対する標準治療確立のための基盤研究(29-A-3, 2020-J-3、2023-J-03)
- 国立研究開発法人日本医療研究開発機構(AMED)
革新的がん医療実用化研究事業(21ck0106669h0001, 22ck0106669h0002, 23ck0106669h0003)
「進行非小細胞肺癌に対する複合免疫療法の標準治療確立のためのランダム化比較第III相試験」
日本臨床腫瘍研究グループ(JCOG)の概要
日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)は、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立することを目的として研究活動を行っています。各種がんの治癒率の向上とがん治療の質の向上を図ることを目標としています。
JCOGは国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センター中央病院(病院長:島田和明、東京都中央区)臨床研究支援部門が管轄する中央支援機構(JCOGデータセンター、JCOG運営事務局)および各種委員会から構成されており、法人格を有さない任意団体です。
http://www.jcog.jp/index.htm(外部サイトにリンクします)
お問い合わせ先
- 研究・治療に関するお問い合わせ
研究代表医師
九州大学病院 呼吸器科 岡本 勇
電話番号:092-642-5378
Eメール :okamoto.isamu.290●m.kyushu-u.ac.jp
- 研究事務局
九州大学病院 呼吸器科 白石 祥理
電話番号:092-642-5378(内線 7745)
Eメール :shiraishi.yoshimasa.258●m.kyushu-u.ac.jp
- JCOGに関するお問い合わせ
国立がん研究センター中央病院
臨床研究支援部門 研究企画推進部 多施設研究支援室(JCOG運営事務局)
Eメール: webmaster●ml.jcog.jp
- 広報窓口
国立がん研究センター企画戦略局 広報企画室
電話番号: 03-3542-2511(代表)
Eメール: ncc-admin●ncc.go.jp
