国際共同研究により大腸がんの全ゲノム解析を実施し日本人症例を解析日本人大腸がん患者さんの5割に特徴的な腸内細菌による発がん要因を発見
国立研究開発法人国立がん研究センター
国立大学法人東京大学医科学研究所
【訂正】図7のコリバクチン毒素の構造式に誤りがございましたので訂正いたしました。(2025年7月14日)
発表のポイント
- 日本を含む11か国の国際共同研究により981症例の大腸がんを対象とした全ゲノム解析が行われました。
- 解析の結果、日本人症例の5割に、一部の腸内細菌から分泌されるコリバクチン毒素による変異パターンが存在することが明らかになりました。
- コリバクチン毒素による変異パターンは、高齢者症例(70歳以上)と比べて若年者症例(50歳未満、大腸がん全体の約10%を占める)に3倍多い傾向がみられ、日本をはじめ世界的に問題視されている若年者大腸がんの重要な発症要因である可能性が示唆されました。
- さらに、大腸がん初期段階に起こるドライバー異常であるAPC変異の15%がコリバクチン毒素による変異であることが分かり、コリバクチン毒素によるDNA変異が大腸がん発症早期から関与していることも示されました。
- 大腸がんにおけるコリバクチン毒素による変異パターンは、その時に存在しているコリバクチン毒素産生菌の量とは関連しないことから、早期から持続的に暴露していることが大腸がん発症に寄与するのではないかと推定されます。
- 今後、日本人若年者大腸がん症例についてさらに研究を進め、コリバクチン毒素による変異の影響による国内の患者増加の背景、それ以外の発がん要因や特徴的なドライバー異常のメカニズムを解明することで、大腸がんに対する新たな予防法や治療法の開発が期待されます。
概要
国立研究開発法人国立がん研究センター (東京都中央区、理事長:間野博行) 研究所 がんゲノミクス研究分野分野長 柴田龍弘(国立大学法人東京大学医科学研究所附属ヒトゲノム解析センターゲノム医科学分野教授)は、米国カルフォルニア大学サンディエゴ校、英国サンガー研究所ならびにWHO国際がん研究機関との国際共同研究に参画し、日本を含む発症頻度の異なる世界11か国の大腸がん981症例の全ゲノム解析から発がん要因の解析を行いました。
その結果、他の地域と比較して日本人大腸がん症例には、腸内細菌由来のコリバクチン毒素による変異パターン(変異シグネチャー)がより多く(全体の5割)存在することが明らかとなりました。また、コリバクチン毒素による変異パターンは、高齢者症例(70歳以上)と比較して若年者症例(50歳未満)に3.3倍多くみられ、特に若年者大腸がんの発症に強く関連していることが示されました。コリバクチン毒素による変異は最も早期に起こるドライバー異常であるAPC変異の15%にみられ、若年期からの暴露が大腸がんの発症リスクと相関する可能性が示唆されました。
今後さらに若年者を含めた大規模な日本人大腸がん症例における研究を進めることで、日本人大腸がんに対する新たな予防法や治療法の開発が期待されます。
本研究は、英国王立がん研究基金(Cancer Research UK)ならびに米国がん研究所によって設立されたCancer Grand Challenge注1が進める国際共同研究(Mutographs project注2)で、世界の様々な地域における悪性腫瘍の全ゲノム解析を行うことで、人種や生活習慣の異なる地域ごとに発症頻度に差がある原因を解明し、地球規模でがんの新たな予防戦略を進めることを目的として実施されているがん疫学研究です。大腸がんの解析は、全悪性腫瘍を通して食道扁平上皮がん注3、 腎臓がん注4に次いて実施されました。また国内では、国立研究開発法人日本医療研究開発機構(AMED)の支援を受けています。
研究成果は英国専門誌「Nature」に英国時間2025年4月23日付で発表されました。なお、本データは広く研究者が利用できるよう、国際がんゲノムコンソーシアム(ICGC-ARGO)注5に登録され、公開されます。
背景
大腸がんについて
大腸がんは日本において年間罹患者数は14万人を超え(全がん種で第1位,2020年)、死亡数も年間53,000人以上(全がん種で第2位,2023年)と、保健衛生上非常に重要ながん種です(がん情報サービス)。大腸がんの発生には、生活習慣が深く関わっていることが知られており、喫煙、飲酒、肥満、欧米型食生活などにより大腸がんが発生する危険性が高まります(がん情報サービス)。
国際的には若年者大腸がんの増加が大きな問題となっています(文献1-4)。日本では、大腸がんの罹患者数は継続して増加傾向にあり、最近の疫学研究の結果では、世界の中でも欧米諸国を超えてトップクラス(50歳未満で世界5位、50歳以上で世界3位)であり(文献1)、若年者症例も年々増加しています(文献4)。日本における大腸がんの予防に向けて、なぜ欧米と比較して急増しているのか、その原因の解明が強く求められています。
文献1:Sung H, Siegel RL, et al. Colorectal cancer incidence trends in younger versus older adults: an analysis of population-based cancer registry data. Lancet Oncol. 26:51-63 (2025).
文献2:Meng, Y., Tan, Z., Zhen, J. et al. Global, regional, and national burden of early-onset colorectal cancer from 1990 to 2021: a systematic analysis based on the global burden of disease study 2021. BMC Med 23, 34 (2025).
文献3:Siegel RL, Wagle NS, Cercek A, Smith RA, Jemal A. Colorectal cancer statistics, 2023. CA Cancer J Clin. 2023 May-Jun;73(3):233-254.
文献4:Ueno A, Yokota M, Ueno M, Kawamoto K. Colorectal cancer in adolescent and young adults: epidemiology in Japan and narrative review. J Gastrointest Oncol. 14時18分56-1868 (2023).
変異シグネチャーと発がん要因の関係
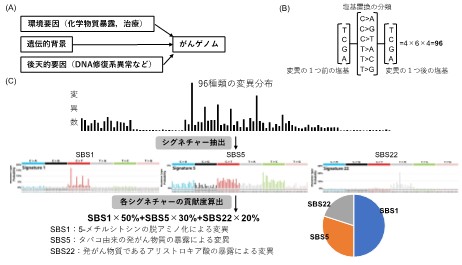
がんは様々な要因によって正常細胞のゲノムに異常が蓄積して発症することが分かっています。点変異のような突然変異はがんドライバー遺伝子注6の活性化や不活性化を来す主要なゲノム異常の一つですが、近年の大規模ながんゲノム解析から、突然変異の起こり方には一定のパターンがあることが明らかになってきました。こうしたパターンは変異シグネチャー注7と呼ばれ、喫煙や紫外線暴露といった様々な環境要因と遺伝的背景によって異なることも知られています。変異シグネチャー解析(図1)のためには全ゲノム解読が必要で、解析によって得られる点変異のシグネチャーはSingle Base Substitution Signature (SBS)、微小な欠失や挿入 (insertion/deletion)のシグネチャーはInsertion/Deletion Signature (ID) と呼ばれています。がんゲノムデータから変異シグネチャーを抽出することで、そのがんがどういった原因の組み合わせによって発がんに至ったのかという原因を追跡することが可能です(図1)。
図1 変異シグネチャー(Single Base Substitution Signature)解析の仕組み
腸内細菌と大腸がんの関わりについて
腸内細菌とは、私たちの腸の中に棲む様々な細菌の総称です。各個人の腸内には数百種類以上、100兆個以上の細菌が存在しており、消化や免疫、ビタミンの合成など生理的に重要な機能に関与しています。一方で、一部の腸内細菌は大腸がんの発生や悪性化と関連していることが、これまでの多くの研究によって示されています。
コリバクチン毒素について
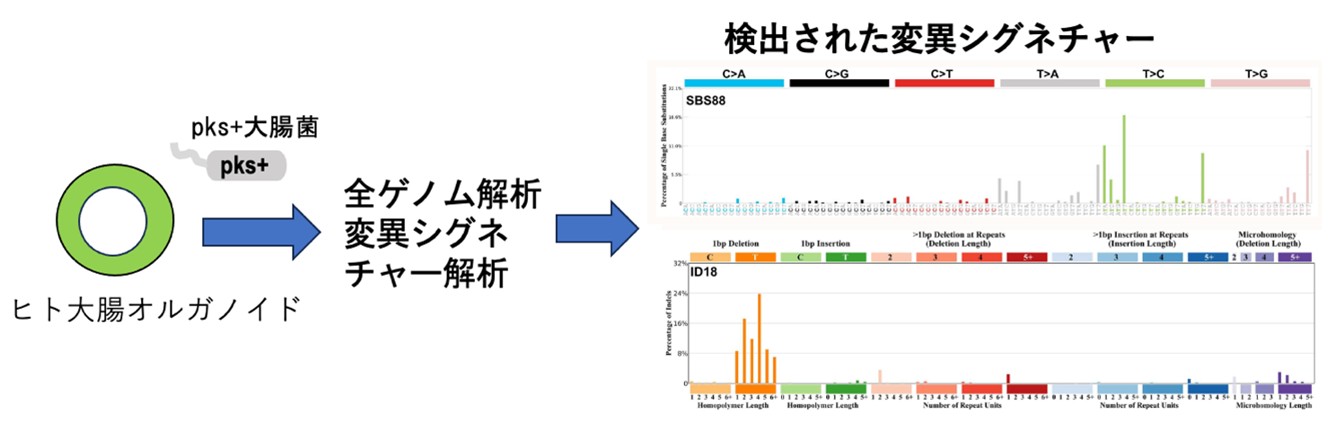
コリバクチン(colibactin)毒素は、大腸菌やその他の腸内細菌によって生産・分泌される2次性代謝産物であり、DNAに傷(2重鎖切断)を起こすことが知られています。コリバクチン毒素はポリケチド合成酵素 (polyketide synthase) ゲノムアイランドを持つ(pks+と呼ばれる)細菌株によって産出され、特にDNA障害性 (genotoxic) pks+大腸菌がよく知られています。 ヒト大腸オルガノイド細胞にpks+大腸菌を暴露することによって特徴的な変異パターン(SBS88/ID18)が誘発されることが報告されています(図2,文献5)。
文献5:Pleguezuelos-Manzano C, Puschhof J, Rosendahl Huber A, et al. Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature. 580; 269-273 (2020).
研究方法
サンプル収集
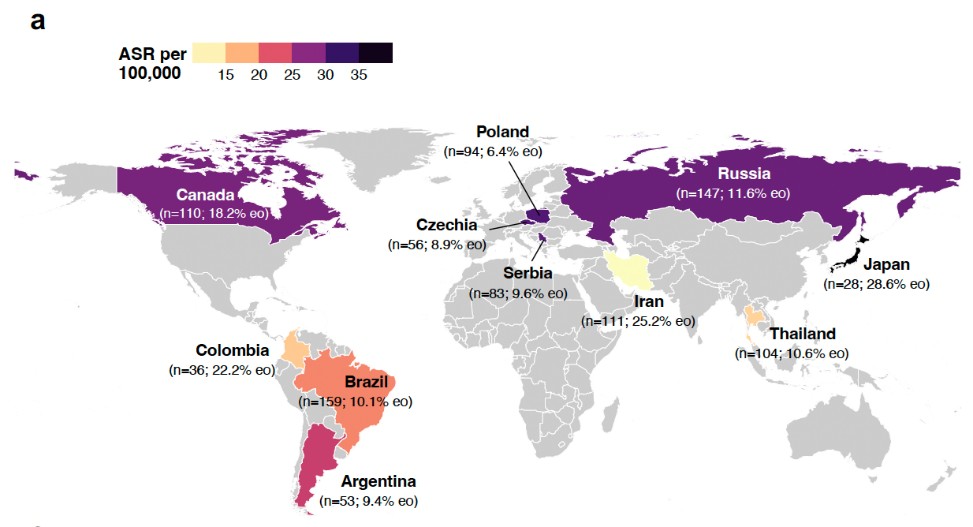
大腸がんの発症頻度の異なる11か国から981症例のサンプルを収集し、全ゲノム解析を行いました。症例数の内訳は、日本28症例、ブラジル159症例、ロシア147症例、イラン111症例、カナダ110症例、タイ104症例、ポーランド94症例、セルビア83症例、チェコ56症例、アルゼンチン53症例、コロンビア36症例です(図3)。日本人症例の内訳は、性別:男性18例、女性10例、年齢:50歳未満8例、50歳以上20例です。
図3 参加した国々と収集したサンプル数、各地域における大腸がんの発症頻度(年齢調整後の10万人当たりの発症数 (ASR)を色で示す)
変異シグネチャー解析
全ゲノム解析データから突然変異を検出し、複数の解析ツールを用いて変異シグネチャーを抽出しました。その後、地域ごと、臨床背景ごとに変異シグネチャーの分布に有意差があるかについて検討を行いました。なお、DNA修復系異常による大腸がん (マイクロサテライト異常 (Microsatellite Instability)大腸がん、大腸がん全体の約6%を占める)については、発症原因がすでに解明されており、その変異パターンも異なることから、以下の解析には含めていません。
研究結果
1. 国別における大腸がんの変異シグネチャーについての比較検討
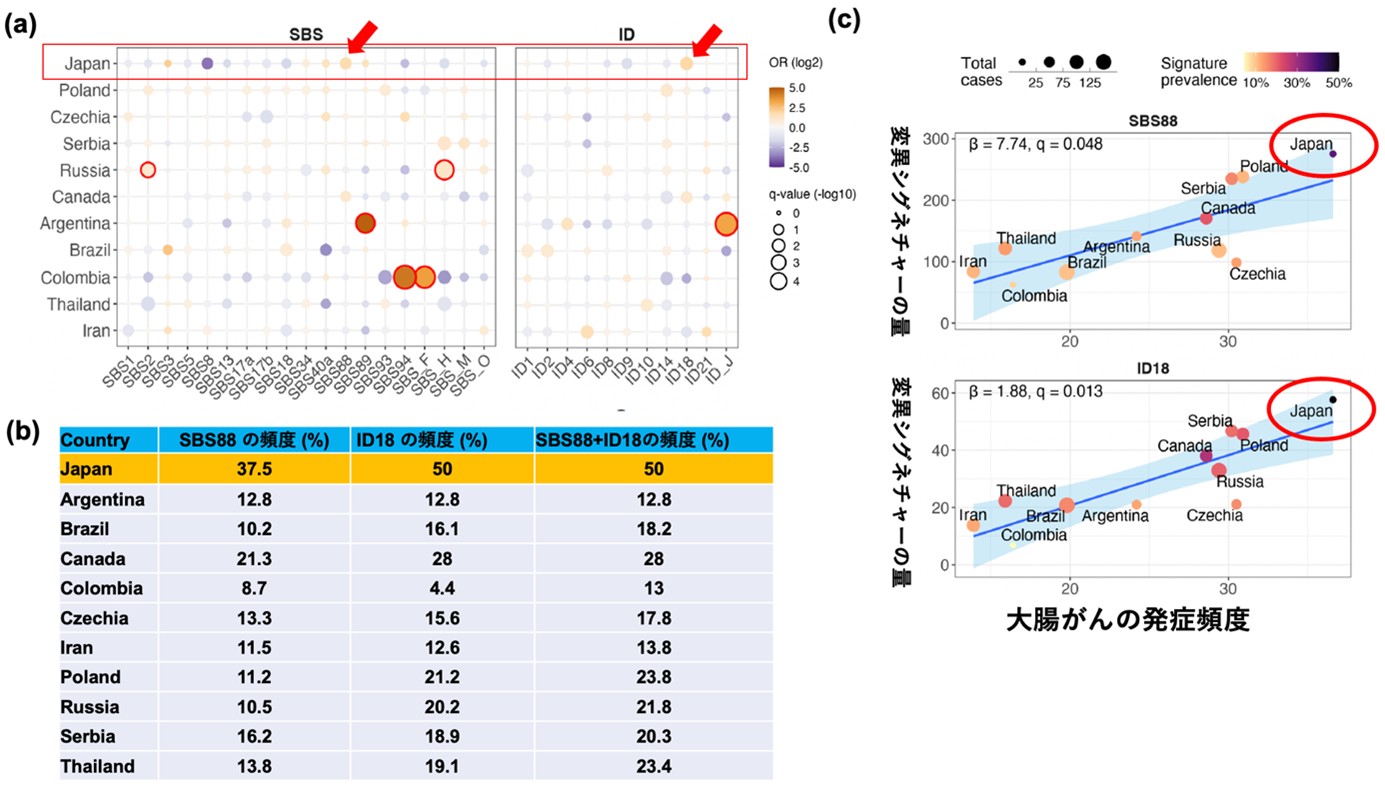
まず、国別の症例における変異シグネチャーの比較を行いました。図4に示すように、日本人症例ではSBS88ならびにID18の頻度が他の国と比較して多いことが明らかになりました(図4a赤矢印)。日本人症例のうち、SBS88は37.5%、ID18は50%の症例に検出され、SBS88あるいはID18のいずれかが検出された(つまりコリバクチン毒素による変異が関与していると考えられる)症例は、日本人で50%と他の地域の平均 (19%)と比較して2.6倍以上高いことが示されました(図4b)。国別の大腸がん発症頻度は、SBS88ならびID18の量と有意な相関を示し、今回の11カ国で最も発症頻度が高い日本の症例でコリバクチン毒素による変異が最も多いという結果でした(図4c).
図4. 各国の大腸がんサンプルにおける変異シグネチャーの比較
(a)丸の大きさは統計的な有意差(大きいほど有意に多い)、色はオッズ比 (OR)(赤いほど有意に多い)を示す。
(b)国別のSBS88、ID18の頻度(%)
(c)国別の大腸がん発症頻度とSBS88、 ID18の量との関連
2. コリバクチン毒素による変異シグネチャー(SBS88/ID18)は若年者症例に多く、大腸がんの発症早期に起こるAPCドライバー異常を起こしていた
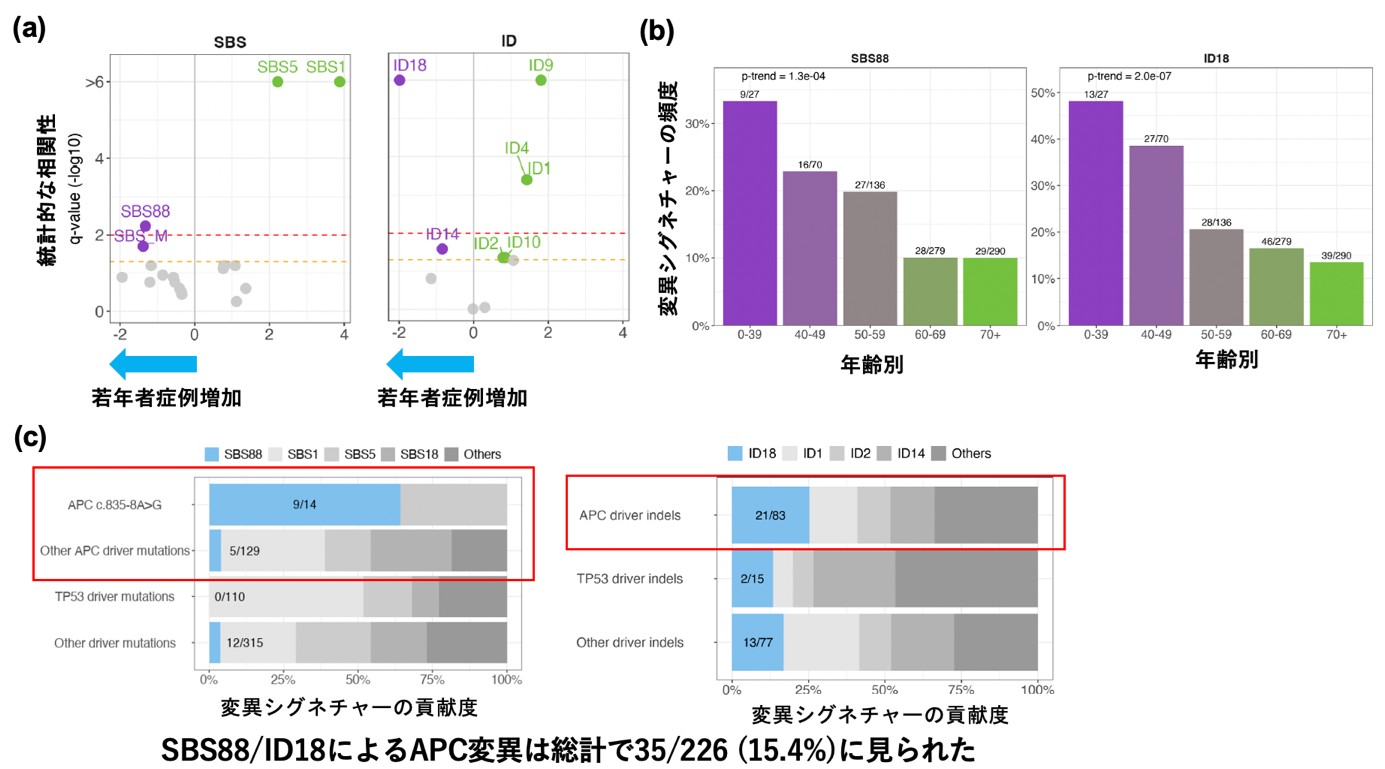
変異シグネチャーと年齢との相関について解析した結果、若年者症例にはSBS88, SBS_M, ID18が多く、高齢者症例にはSBS5. SBS1(いずれも加齢と相関することが報告されている)、ID9, ID4, ID1, ID2, ID10が多いことが明らかとなりました(図5a)。コリバクチン毒素による変異シグネチャーであるSBS88ならびにID18は年齢別にみても50歳未満の若年者症例に特に多く、70歳以上の高齢者症例と比較すると3.3倍多いという結果でした(図5b)。
さらに、大腸がんにおけるドライバー変異と変異シグネチャーとの関連について検討したところ、大腸がんにおいて最も早期に起こるドライバー異常であるAPC変異について全体の15.5%がSBS88あるいはID18のパターンと一致しており(図5c)、コリバクチン毒素によるDNA変異が大腸がんの発症早期から関与していることが示されました。
図5. 変異シグネチャーと年齢、ドライバー異常との関係
(a) 若年者症例に多い変異シグネチャーはSBS88、 SBS_M、 ID18であった。
(b) コリバクチン毒素による変異シグネチャーであるSBS88ならびにID18は50歳未満の症例に多い。
(c) コリバクチン毒素による変異シグネチャーはAPC変異を誘発する。
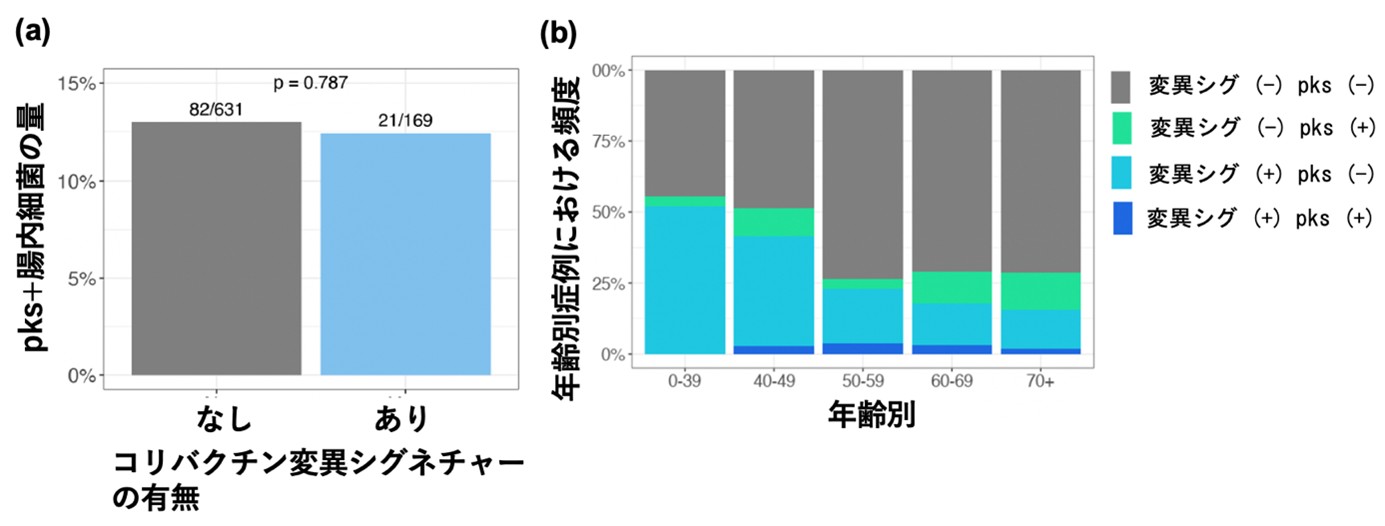
3. 大腸がんにおけるコリバクチン毒素による変異シグネチャー(SBS88/ID18)は、その時に存在しているpks+腸内細菌の量とは関連しない
最後に、コリバクチン毒素を産生するpks+腸内細菌とSBS88/ID18変異シグネチャーとの関連について検討を行いました。図6aに示すように、SBS88/ID18変異シグネチャーとの有無によってpks+腸内細菌の量には有意な差はみられませんでした。さらに年齢別に検討した結果、若年者症例のがんにおいてSBS88/ID18変異シグネチャーがみられるもののpks+腸内細菌は検出できない症例(図6b 変異シグ (+) pks (-))が多いことが分かりました。この理由として、コリバクチン毒素暴露からDNA変異誘発には時間がかかるため、手術時に存在している腸内細菌ではなく、もっと早期から持続的にpks+腸内細菌に暴露していることが大腸がん発症に寄与すると推定されます。
図6 pks+腸内細菌とコリバクチン毒素による変異シグネチャー(SBS88/ID18)の関連
展望
本研究は、食道扁平上皮がん、腎臓がんに次いで行われた大腸がんに対する全ゲノム解析を用いた国際的な大規模がん疫学研究であり、各国の大腸発がん要因の違いが明らかになり、疫学研究における全ゲノム解析の有用性を改めて示しました(図7)。
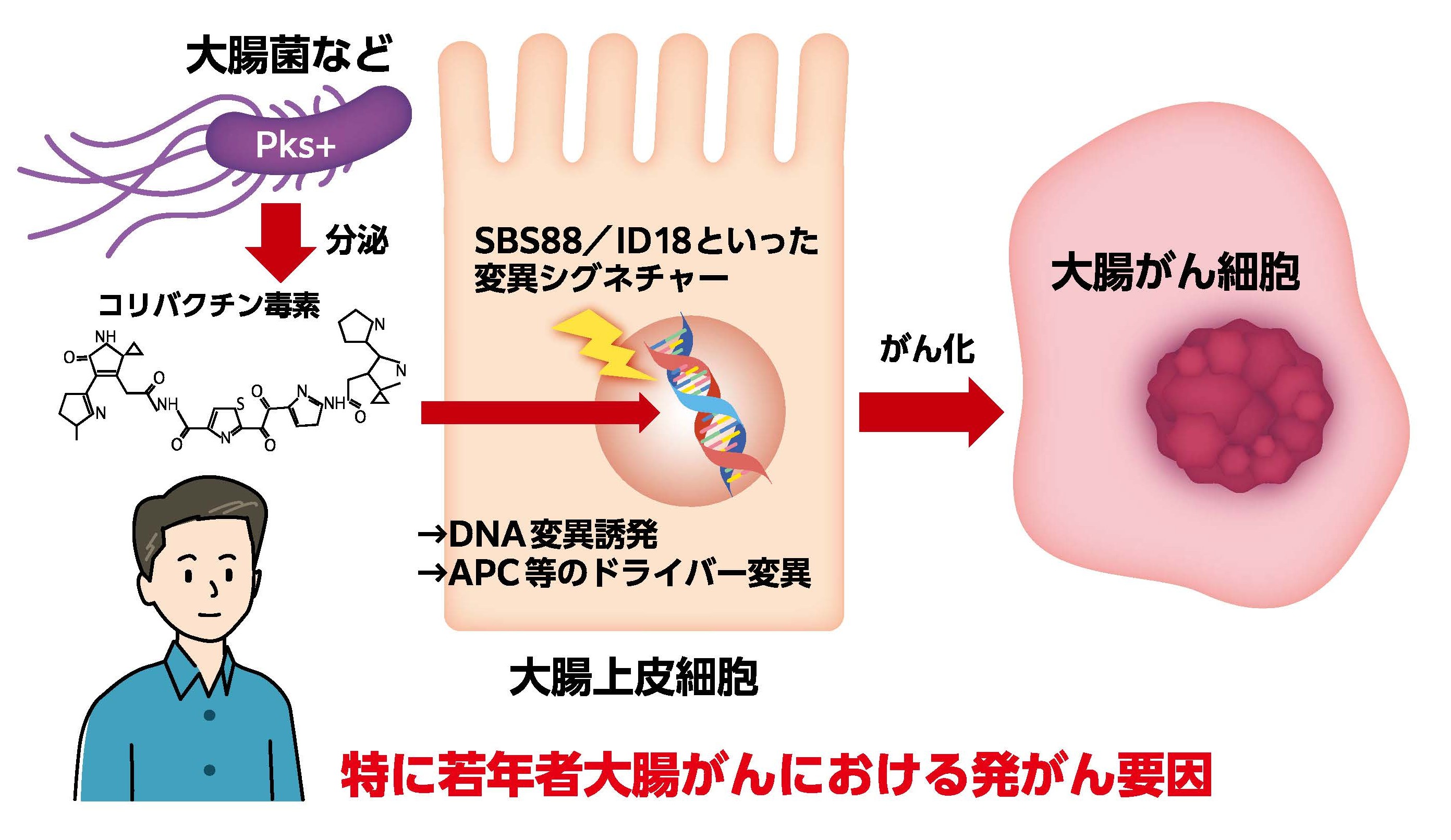
特に世界的にも患者数が急増している日本人症例からコリバクチン毒素による変異シグネチャーが最も高頻度に確認され、この変異シグネチャーの量が国別の発症頻度と相関していることからも、日本における大腸がん増加の重要な要因であることが示唆されました。また、コリバクチン毒素による変異シグネチャーが若年者症例に多いことから、国際的にも問題となっている若年者大腸がんの大きな要因の一つであると考えられます。
一方で、若年者大腸がんにはコリバクチン毒素以外の未知の要因による変異シグネチャーもみられること、今回解析された日本人症例は少ないことなど、新たな課題も見つかっており、その解明に向け、若年者大腸がんを中心とした大規模な多施設共同研究によって国内の各地域からサンプルを集め、全ゲノム解析を行う研究計画を進めています。今後の研究で、コリバクチン毒素による大腸発がんの国内における広がりや若年者症例の発症要因の全貌、ドライバー異常の全体像が明らかになれば、日本における大腸がんの新たな予防法や治療法の開発につながると期待されます。
また、これまで行ってきた国際共同研究の結果から、食道がん・腎臓がん・大腸がんのいずれにおいても、日本人症例には世界の他の地域と比較して特徴的な発がん要因がそれぞれ存在していることが明らかになりました。
現在、国内では全ゲノム解析等実行計画注8を推進するための国立研究開発法人日本医療研究開発機構(AMED)プロジェクトが開始され、多くのがん種について日本人症例の大規模な全ゲノムデータが集積されています。これらの研究においても変異シグネチャー解析を用いることで、日本における様々ながん種の発がん分子機構の解明とがん予防への応用が期待されます。
発表論文
雑誌名
Nature
タイトル
Geographic and age variations in mutational processes in colorectal cancer
著者
Díaz-Gay M, Dos Santos W, Moody S, Kazachkova M, Abbasi A, Steele CD, Vangara R, Senkin S, Wang J, Fitzgerald S, Bergstrom EN, Khandekar A, Otlu B, Abedi-Ardekani B, de Carvalho AC, Cattiaux T, Penha RCC, Gaborieau V, Chopard P, Carreira C, Cheema S, Latimer C, Teague JW, Mukeriya A, Zaridze D, Cox R, Albert M, Phouthavongsy L, Gallinger S, Malekzadeh R, Niavarani A, Miladinov M, Erić K, Milosavljevic S, Sangrajrang S, Curado MP, Aguiar S, Reis RM, Reis MT, Romagnolo LG, Guimarães DP, Holcatova I, Kalvach J, Vaccaro CA, Piñero TA, Świątkowska B, Lissowska J, Roszkowska-Purska K, Huertas-Salgado A, Shibata T, Shiba S, Sangkhathat S, Chitapanarux T, Roshandel G, Ashton-Prolla P, Damin DC, de Oliveira FH, Humphreys L, Lawley TD, Perdomo S, Stratton MR, Brennan P, Alexandrov LB.
掲載日
2025年4月23日(英国時間)付
DOI
10.1038/s41586-025-09025-8
URL
https://www.nature.com/articles/s41586-025-09025-8(外部サイトにリンクします)
研究費
- 革新的がん医療実用化研究事業(国立研究開発法人日本医療研究開発機構):国際共同研究に資する大規模日本人がんゲノム・オミックス・臨床データ統合解析とゲノム予防・医療推進
- 国立がん研究センターがん研究開発費(2020-A7)
発表者
国立研究開発法人国立がん研究センター研究所がんゲノミクス研究分野 分野長 柴田 龍弘
(国立大学法人東京大学医科学研究所附属ヒトゲノム解析センターゲノム医科学分野教授)
用語解説
注1 Cancer Grand Challenge
英国王立がん研究基金 (Cancer Research UK)ならびに米国がん研究所 (National Cancer Institute)によって設立されたグローバルな資金配分プラットフォーム。がん研究における最も複雑な課題に取り組み、新たな知見を広げ、研究のさらなる進展や科学的な創造性を高めることを目的としている。
https://cancergrandchallenges.org(外部サイトにリンクします)
注2 Mutographs project
Cancer Grand Challengeで進められているプロジェクトの一つであり、多様な発がん要因に応じてどのようにゲノム変異のパターンが変わるのかについて、地球規模で解明し、新たな予防法につなげていく国際共同研究である。主任研究者は、英国サンガー研究所所長のSir Michael Stratton博士。日本からは国立がん研究センターが協力機関として参加している。
https://www.mutographs.org(外部サイトにリンクします)
注3 Cancer Grand Challenge “Mutographs project” 食道扁平上皮がんプロジェクト
Cancer Grand Challenge “Mutographs project”として実施された、発症頻度の異なる8か国(日本・中国・イラン・英国・ケニア・タンザニア・マラウイ・ブラジル)における食道がん(食道扁平上皮がん)552症例の全ゲノム解析プロジェクトで、世界で初めての全ゲノム解析を用いた国際的ながん疫学研究。同研究で、日本人は飲酒に伴う遺伝子変異機構が強くはたらき、食道がんが発症するという詳細なメカニズムが明らかになった。
2021年10月27日 国立がん研究センタープレスリリース
国際共同研究による食道がん全ゲノム解析 日本人食道がんに特徴的な発がんメカニズムを発見
https://www.ncc.go.jp/jp/information/pr_release/2021/1027/index.html
注4 Cancer Grand Challenge “Mutographs project” 腎臓がんプロジェクト
Cancer Grand Challenge “Mutographs project”として実施された、発症頻度の異なる日本を含む11か国の国際共同研究により過去最大の962症例の腎細胞がんの全ゲノム解析を実施し、日本人の腎細胞がんの7割に、他国ではほとんどみられない未知の発がん要因が存在することを明らかにした。
2024年5月14日 国立がん研究センタープレスリリース
国際共同研究により世界最大規模の腎臓がんの全ゲノム解析を実施: 日本人の7割に未知の発がん要因を発見
https://www.ncc.go.jp/jp/information/pr_release/2024/0514/index.html
注5 国際がんゲノムコンソーシアム(ICGC-ARGO)
ゲノム情報の利活用により、がん患者さんにおける治療効果・予後の改善を目指した国際がんゲノムコンソーシアム (International Cancer Genome Consortium, ICGC)のプロジェクト。ICGC-ARGO (Accelerating Research in Genomic Oncology, ARGO) はICGC 25k Initiative およびPan-Cancer Analysis of Whole Genomes (PCAWG)に続く、ICGCの第3フェーズ。2025年5月現在、日本をはじめ、米国・カナダ・英国(イングランド・スコットランド)・ドイツ・フランス・イタリア・スイス・韓国・中国・香港・サウジアラビアの13か国が参加し、26のプロジェクトを進めている。日本からは国立研究開発法人 日本医療研究開発機構(AMED)が支援する研究班(Genome Medicine for Asia-Prevalent Cancers)ならびに国立がん研究センターが主導する全国がん遺伝子診断ネットワーク(MONSTAR-SCREEN)が参加し、臨床情報の紐付いたがんゲノム情報の登録・共有を開始している。
注6 がんドライバー遺伝子
異常を起こすことによってがんの発生や進展に寄与する遺伝子を総称してがんドライバー遺伝子と呼ぶ。がん細胞の増殖や転移を促進する「がん遺伝子」とそれらを抑制する「がん抑制遺伝子」がある。がんドライバー遺伝子を標的とした診断(パネル遺伝子診断)や治療(分子標的薬治療)が現在ゲノム医療として進められている。
注7 変異シグネチャー
がん細胞のゲノムに発生する様々な変異には、その要因によって異なったパターンを示すことが知られており、そうしたパターンを変異シグネチャーと呼ぶ。これまでヒトのがんにおいては50種類以上のパターンがあることが知られており、そのうち3分の1はゲノム修復の異常、3分の1は環境要因によるものであることが判明しているが、残り3分の1は未だ原因不明である。
注8 全ゲノム解析等実行計画
がんや難病等の医療の発展や個別化医療の推進等を目的として、2019(令和元)年12月に厚生労働省によって策定された。がん領域については、2021(令和3)年度からAMED革新的がん医療実用化研究事業において全ゲノム解析等実行計画を推進するプロジェクトが開始されている。この実行計画に基づき、全ゲノム解析等により明らかとなった当該疾患の治療等のために有益な情報等を患者さんに還元するとともに、研究・創薬などに向けた利活用を進め、新たな個別化医療等を患者さんに届けることを目指している。
問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立がん研究センター 研究所
がんゲノミクス分野 分野長 柴田龍弘
(国立大学法人東京大学医科学研究所附属ヒトゲノム解析センターゲノム医科学分野教授)
Eメール:tashibat●ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
東京大学医科学研究所 プロジェクトコーディネーター室(広報)
電話番号:090-9832-9760
Eメール:koho●ims.u-tokyo.ac.jp
