腸内細菌は樹状細胞を介して腸から離れたがんの免疫環境に影響する 免疫チェックポイント阻害薬の作用に関与する新たな腸内細菌を同定-英国科学雑誌「Nature」で発表-
国立大学法人東海国立大学機構名古屋大学
国立大学法人京都大学
国立大学法人大阪大学
国立研究開発法人理化学研究所
国立研究開発法人産業技術総合研究所
発表のポイント
- 現在、さまざまながんで免疫チェックポイント阻害薬を用いた治療が実施されていますが、長期間にわたり治療効果が得られる患者さんは20%程度に限られており、治療成績のさらなる改善が求められています。
- 免疫チェックポイント阻害薬の治療効果には、腸の細菌(腸内細菌)が関係することが報告されていますが、腸に存在する細菌がなぜ腸ではない臓器 (肺など) に発生したがんに影響を及ぼすのか等の詳細な機序は分かっていませんでした。
- 本研究チームは、免疫チェックポイント阻害薬の作用に関与する新たな腸内細菌としてルミノコッカス科に属するYB328株を同定、さらにその培養に成功し、作用メカニズムを解明しました。
- YB328株が腸内で免疫応答の司令塔である樹状細胞を活性化し、その樹状細胞ががん組織まで移動することで免疫効果を発揮するとともに、腸内細菌叢の多様化を通じた樹状細胞のさらなる活性化により、免疫チェックポイント阻害薬の効果を高める可能性が示されました。
- 本研究成果により、YB328株が、免疫チェックポイント阻害薬だけでなく免疫細胞療法などでもがん免疫療法の作用を高める可能性が示唆され、次世代のがん免疫療法への応用が期待されます。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:間野 博行)研究所 腫瘍免疫研究分野を中心とする研究チームは、免疫チェックポイント阻害薬の治療効果を高める新たな腸内細菌としてルミノコッカス科に属するYB328株を同定し、その培養と作用メカニズムの解明に成功しました。
YB328株が腸内で免疫応答の司令塔である樹状細胞注1を活性化し、その樹状細胞ががん組織まで移動することで免疫効果を発揮するとともに、腸内細菌叢の多様化を通じた樹状細胞のさらなる活性化により、免疫チェックポイント阻害薬の効果を高める可能性が示されました。さらに、YB328株はがん治療薬PD-1阻害薬注2が効いた患者さんの腸内に特に豊富に見られ、治療の効果や、がんを攻撃する免疫細胞(PD-1陽性CD8陽性T細胞注3)ががんの中に多く存在することと強く関係する腸内細菌であることが明らかになりました。
本研究は、腸内細菌が腸から離れた臓器に存在するがんの免疫環境に影響を及ぼす仕組みを世界で初めて可視化して明らかにし、特定の細菌の投与によってPD-1阻害薬の効果が改善される分子メカニズムの詳細を解明したものです。
本研究成果により、免疫チェックポイント阻害薬では十分な効果が得られない患者さんにおいても、YB328株を投与することで腸内細菌叢注4の構成が変化し、免疫チェックポイント阻害薬に反応しやすい腸内環境へと整えることができる可能性が示唆されました。今後YB328株は、がん免疫療法の効果を高める新たな免疫賦活化剤注5としての可能性を持ち、今後の臨床応用が期待されます。
本研究は、国立研究開発法人国立がん研究センター研究所 腫瘍免疫研究分野 西川 博嘉分野長(名古屋大学大学院医学系研究科 微生物・免疫学講座 分子細胞免疫学教授、京都大学大学院医学研究科附属がん免疫総合研究センターがん免疫多細胞システム制御部門教授)、小山 正平研究員(現 国立がん研究センター研究所 免疫ゲノム解析部門長、元大阪大学大学院医学系研究科 呼吸器免疫内科学 特任准教授)、辨野 義己腸内フローラ研究所理事長(元理化学研究所 科技ハブ産連本部 バトンゾーン研究推進プログラム 辨野特別研究室 特別招聘研究員)らの研究チームで実施し、本成果は英国科学雑誌 「Nature」 に英国時間2025年7月14日(日本時間7月15日)に掲載されました。
背景
がんに対する免疫チェックポイント阻害薬(ICI)を用いた治療は、さまざまながん種に対して標準治療の一つとして広く用いられるようになりました。現在では、ICIと他の薬剤を組み合わせた免疫複合治療も一般的に実施されています。しかしながら、免疫複合治療を行っても過半数の患者さんでは十分な治療効果が得られず、長期間にわたり効果が持続するケースは20%程度に限られているのが現状です。その治療効果の差を生む重要な要因の一つとして、活性化したCD8陽性T細胞(特にPD-1陽性CD8陽性T細胞)ががん組織内にどれだけ存在しているかが挙げられます。最近の研究では、がん組織の免疫環境の違いにより、ICIの効果に大きな差が生じることが明らかになってきました。具体的には、炎症性のがんではCD8陽性T細胞が多く集積しておりICIが効果を示しやすいのに対し、非炎症性のがんではこれらのT細胞が少なく、ICIの効果が得られにくい傾向があります。
さらに、近年の研究で注目されているのが腸内細菌叢の影響です。腸内細菌の多様性や、特定の菌を保有しているかどうかが、がん免疫療法の効果を左右することが多数報告されています。しかしながら、腸に存在する細菌が、なぜ腸以外の臓器に発生したがん組織の免疫状態にまで影響を及ぼすのか、また、どのようにして活性化CD8陽性T細胞の存在量を変化させるのかについては、これまで明確なメカニズムは解明されていませんでした。
研究成果
1.免疫チェックポイント阻害薬の効果に関わる腸内細菌の特徴:治療奏効例ではルミノコッカス科が増加

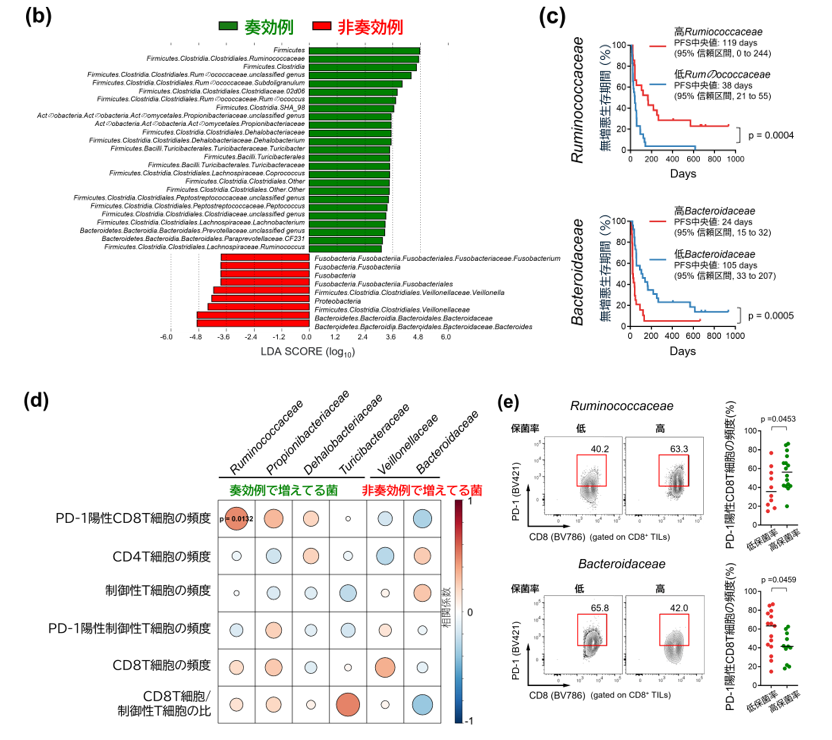
非小細胞肺がんおよび胃がんの患者さん計50名を対象に、がん免疫療法(抗PD-1抗体)の効果と腸内細菌叢との関係について解析を行いました。本研究では、治療開始前に回収したがん組織および便検体を用いて、フローサイトメトリー注6による免疫細胞の網羅的解析と、16S rRNA遺伝子シークエン スによる腸内細菌叢の構成評価を実施しました(図1a)。特に、治療効果と関連する腸内細菌の違いや、腫瘍内に浸潤するT細胞の特徴に着目して検討を進めたところ、治療に奏効した患者群ではルミノコッカス科(Ruminococcaceae)に属する細菌が顕著に増加しており、逆に治療が奏効しなかった患者群ではバクテロイデス科(Bacteroidaceae)の細菌が有意に多く存在していることが明らかになりました(図1b)。
さらに、ルミノコッカス科細菌の保菌率が高い患者さんは、低い患者さんに比べて無増悪生存期間(PFS)が有意に長く、一方でバクテロイデス科の保菌率が高い患者さんではPFSが短い傾向にあることも確認されました(図1c)。加えて、腸内細菌叢と腫瘍浸潤リンパ球の関連を調べた解析では、ルミノコッカス科細菌の保菌率が高い患者さんほど、PD-1陽性CD8陽性T細胞の腫瘍内浸潤頻度が高いことが明らかとなりました(図1d, e)。以上の結果から、腸内細菌叢の構成ががん免疫療法の効果やがん組織内の免疫状態と密接に関係していることが示唆されました。
2.免疫チェックポイント阻害薬の効果に関与する新たな腸内細菌「YB328」を発見
抗PD-1抗体の奏効例と非奏効例それぞれの患者便検体から、免疫原性に関与する可能性のあるルミノコッカス科(Ruminococcaceae)の細菌を分離・同定することを試みました。その結果、奏効例の便から、これまでに報告のない新規細菌株「YB328」の単離および培養に世界で初めて成功しました(図2a)。電子顕微鏡による観察では、YB328株が膜小胞を多数分泌している様子が確認され、免疫活性化に関与する可能性が示唆されました。また、非奏効例の便からはPhocaeicola vulgatus(P. vulgatus)を同様に単離し、本細菌株を以降の実験の比較対照として用いました(図2b, 2c)。抗PD-1抗体との併用効果を調べるために、抗生剤で腸内細菌を除去したSPFマウスにYB328株と抗PD-1抗体を併用投与したところ、YB328株を投与した群でのみ腫瘍縮小効果が認められました(図2d)。また、YB328株を投与したマウスでは、腸管内のPD-1陽性CD8陽性T細胞が有意に増加し(図2e)、加えて樹状細胞の活性化マーカー(CD86およびMHC-I)の発現増加も確認されました(図2f)。さらに、非奏効例の便とともにYB328株またはP. vulgatusを投与した場合の治療効果を比較したところ、YB328株を投与したマウスでは非奏効例の便を同時に投与しても治療効果を認められることが分かりました(図2g)。加えて、T細胞受容体(TCR)のレパートリー解析では、YB328投与群でより多様なTCRレパートリーが誘導されていることが分かりました(図2h)。
以上の結果から、YB328株が樹状細胞の活性化を介してPD-1陽性CD8陽性T細胞の浸潤を促し、腸内環境を免疫応答に有利な状態へと変化させることで、抗腫瘍免疫を強化している可能性を示されました。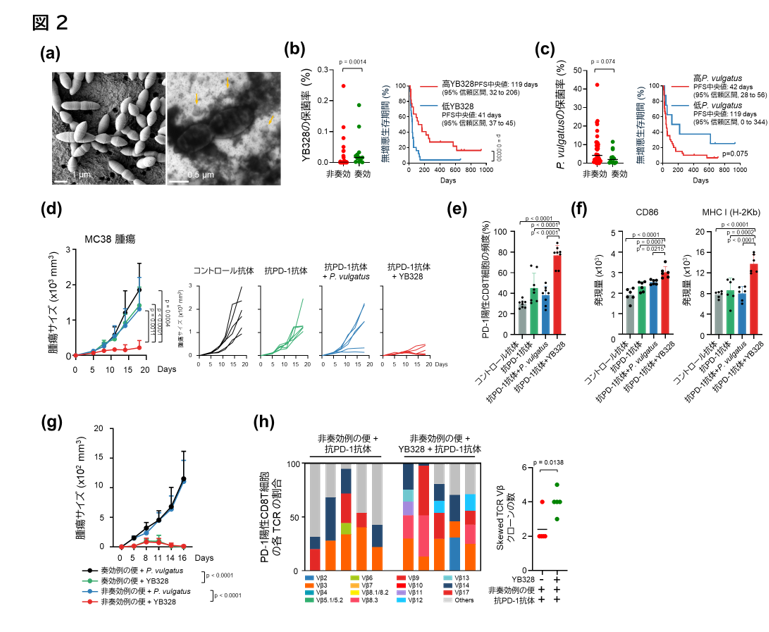
3.YB328株は樹状細胞の分化・活性化を促進し、T細胞応答を高める
これまでの結果から、YB328株が樹状細胞を活性化する可能性が示唆されたため、自然免疫応答注7におけるより詳細なメカニズムの解明を目的に、骨髄由来の樹状細胞(BMDC)を用いた実験を行いました。YB328株またはP. vulgatusで刺激した際の免疫応答を比較したところ、YB328株で刺激した場合に特に樹状細胞の分化マーカーであるCD86の発現が上昇することが確認されました(図3a)。さらに、YB328刺激によって、抗原提示機能やT細胞の遊走を促進するサイトカイン注8であるIL-12p70やCXCL9の産生が顕著に亢進することも明らかになりました(図3b)。また、YB328株またはP. vulgatusで刺激したBMDCに、OVA (オボアルブミン) およびOT-Iマウス由来のCD8陽性T細胞を共培養したところ、YB328株で刺激されたBMDCはより多くの樹状突起を形成し、OVA特異的T細胞との相互作用が長時間維持されることが観察されました(図3c)。加えて、TCRに対する親和性が異なるOVAペプチド(高親和性:N4、低親和性:Q4H7)を用いて刺激条件を変化させた実験では、高親和性ペプチドではYB328株刺激下でごく低濃度でもT細胞活性化に関わる転写因子NFATc1の核内移行およびPD-1陽性CD8陽性T細胞の誘導が確認される一方、P. vulgatusでは同様の反応は認められませんでした(図3d,e)。一方で、低親和性ペプチドを用いた場合には、ペプチド濃度の上昇に応じてNFATc1の核移行およびPD-1陽性CD8陽性T細胞の誘導がより強くなることも示されました(図3d,e)。
以上から、YB328株が自然免疫細胞である樹状細胞を高効率に活性化し、T細胞応答の質と量の両面において強化する能力を持つことが示されました。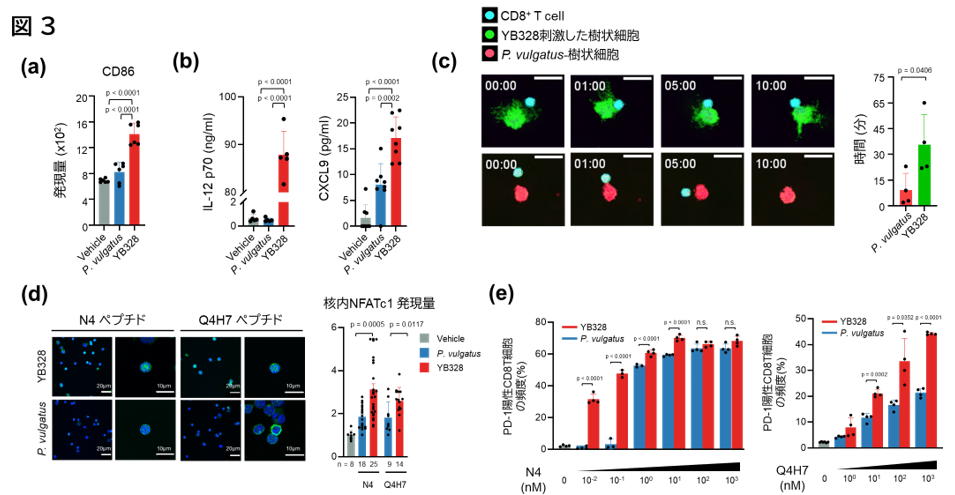
4.YB328株はCD103陽性樹状細胞を誘導・活性化し、その抗腫瘍効果にToll様受容体(TLR)注9シグナルが不可欠であることを解明
YB328株で刺激した骨髄由来の樹状細胞(BMDC)が、P. vulgatusと比較して著しく強力なCD8陽性T細胞応答を誘導する理由を明らかにするため、研究チームはRNAシークエンスによる網羅的な遺伝子発現解析を行いました。その結果、YB328株刺激群において、Batf3やIrf8など、conventional type 1 dendritic cells(cDC1;CD103陽性樹状細胞)の分化誘導に関わる特異的な転写因子の発現が顕著に亢進していることが明らかになりました(図4a)。このcDC1は、特にクロスプレゼンテーション注10によってCD8陽性T細胞の活性化に関わることが知られています。またこれらの変化はタンパク質レベルでの発現(図4b, 4c)や前駆細胞注11の誘導(図4d)でも確認されました。さらに、YB328株による抗腫瘍効果にCD103陽性樹状細胞がどの程度寄与しているかを検証するため、Batf3欠損マウス(CD103陽性樹状細胞欠如)を用いて同様のin vivo治療実験を行ったところ、YB328株の抗腫瘍効果は完全に消失することが分かりました(図4e)。次に、YB328株によって活性化された樹状細胞において特に高発現していた遺伝子群に注目したところ、複数のToll様受容体(TLRs)の発現が増加していることが確認されました(図4f)。これにより、CD103陽性樹状細胞の活性化にはTLRシグナルが重要な役割を果たしていることが示唆されました。そこで、MyD88ノックアウトマウス(主要なTLRシグナル伝達因子)およびTLR7/TLR9ダブルノックアウトマウスを用いた同様の刺激実験を行ったところ、いずれのモデルにおいてもCD103陽性樹状細胞の誘導は消失し、YB328株の抗腫瘍効果も完全に失われることが明らかとなりました(図4g–j)。さらに、YB328株の代わりに複数のTLRリガンド(TLR7/9など)を用いた治療実験を行ったところ、YB328株と同様の治療効果が得られることも確認されました(図4k)。
以上の結果から、YB328株の抗腫瘍効果の発現にはCD103陽性樹状細胞の誘導と活性化が不可欠であり、これにはTLRシグナル経路が中心的な役割を果たしていることが明らかとなりました。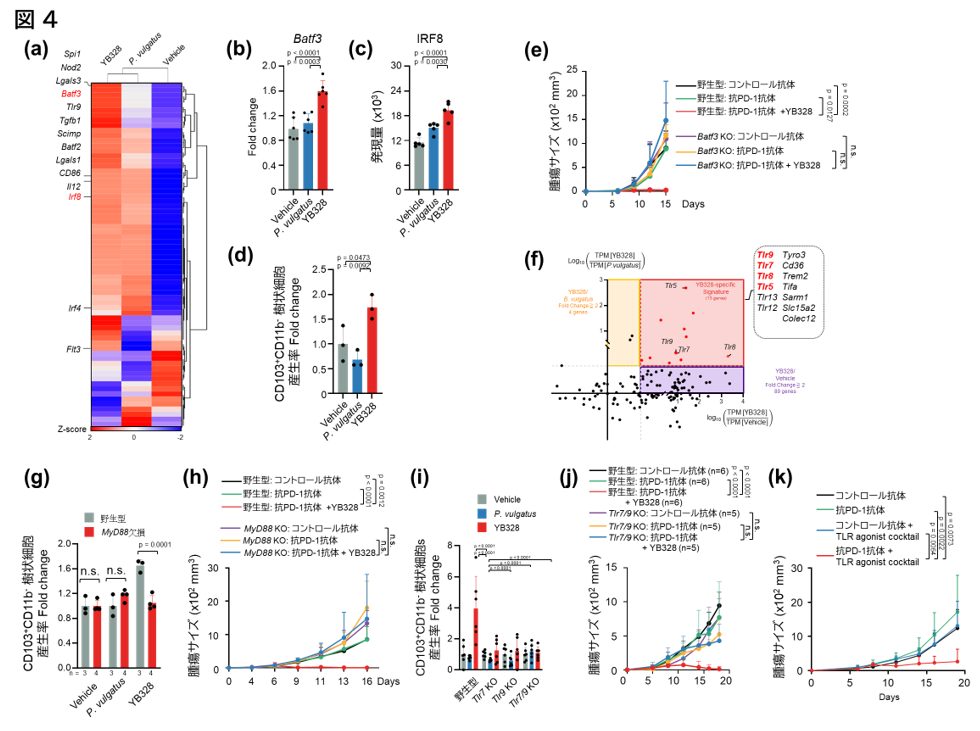
5.YB328株が誘導するCD103陽性樹状細胞の全身分布とその動態の可視化
これまでの結果から、YB328株による治療効果の中核となる細胞として、CD103陽性樹状細胞が見出されました。そこで研究チームは、YB328株投与時に生体内でCD103陽性樹状細胞がどのように誘導・活性化されるかを、マウスモデルを用いて全身のリンパ組織(粘膜固有層、パイエル板、所属リンパ節、腫瘍内)の解析により評価しました。その結果、YB328株で治療したマウスにおいて、粘膜固有層(図5a)、パイエル板(図5b)、所属リンパ節(draining lymph node: dLN)(図5c)、および腫瘍内(図5d)で、CD103陽性樹状細胞の浸潤が有意に増加していることが確認され、各組織においてCD103陰性のミエロイド細胞の増加は認められませんでした。さらに、経口投与されたYB328株が、腸とは離れた腫瘍や所属リンパ節でCD103陽性樹状細胞を増加させた理由を視覚的に解明するため、細胞の蛍光色が局所的なUV照射により緑(G)から赤(R)に変わるKikume GRマウスを用いた検証を実施しました(図5e)。マウスに麻酔下で手術を行い、腸だけにUV照射した後、従来通りYB328株を経口投与しました。その後、腫瘍治療効果を評価したところ、緑から赤に変化したCD103陽性樹状細胞(KikR⁺)が所属リンパ節(図5f, g)および腫瘍内(図5h)で有意に増加していることが確認されました。
これらの知見は、YB328株が腸内で活性化されたCD103陽性樹状細胞を誘導し、これらの細胞がリンパ組織や腫瘍部位へと移動することで、抗腫瘍免疫応答を強化していることを明確に示しています。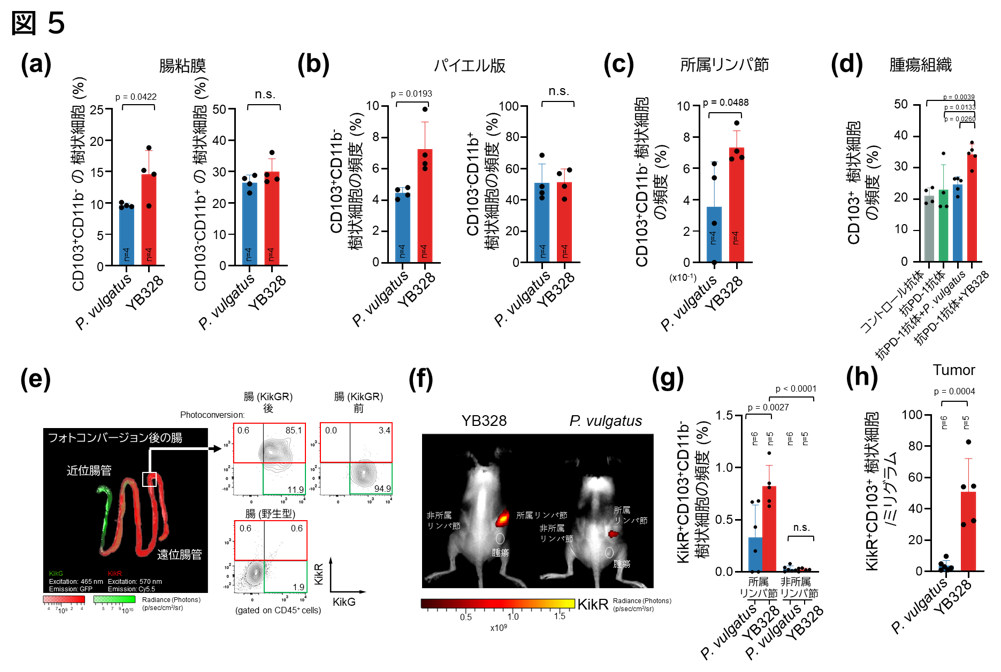
6.マウスで得られた知見をヒト腫瘍組織で検証:YB328株の保菌率と免疫細胞浸潤の関連を確認
最後に、マウスモデルを用いた機能解析で得られた知見を、実際のがん患者由来の臨床検体で検証することを目的に、今回のコホートに含まれる治療開始前の腫瘍組織(FFPE標本)を対象として、多重免疫蛍光染色による解析を行いました。マウスにおいて抗腫瘍免疫の誘導に重要とされたCD103陽性樹状細胞に対応する細胞は、ヒト組織ではCLEC9A陽性かつIRF8陽性の樹状細胞として定義されました。このヒト腫瘍組織に対して、腸内細菌叢のプロファイル、腫瘍内に浸潤するPD-1陽性CD8陽性T細胞、およびCLEC9A陽性IRF8陽性樹状細胞の分布について統合的な解析を実施したところ、YB328株の保菌率が高い患者さんでは、PD-1陽性CD8陽性T細胞およびCLEC9A陽性IRF8陽性樹状細胞の腫瘍内浸潤が有意に多いことが明らかとなりました(図6a, b)。
これらの結果は、YB328株が腸内で樹状細胞を活性化し、それにより誘導される抗腫瘍免疫応答が実際のヒト腫瘍組織でも再現されていること示しています。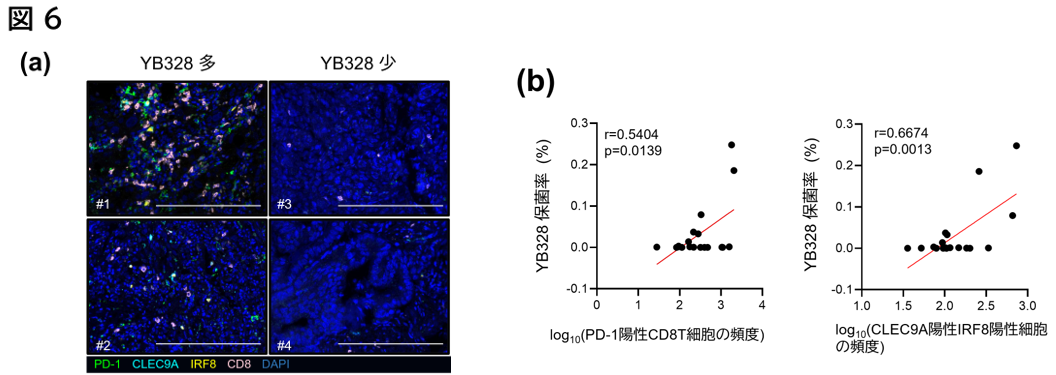
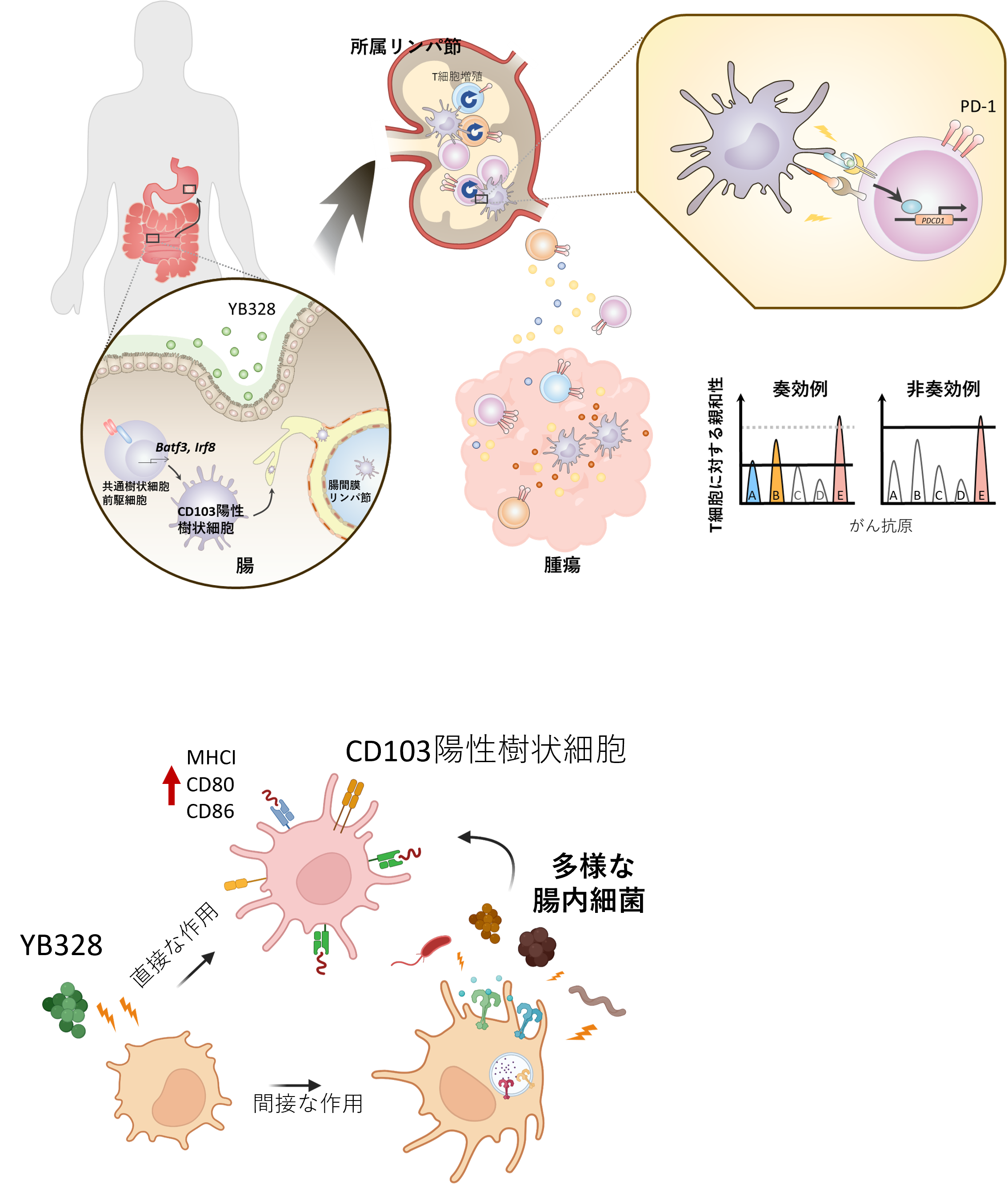
本研究により、YB328株を経口投与すると、腸内でCD103陽性樹状細胞が誘導・活性化され、この活性化された樹状細胞が腫瘍局所に移動し、CD8陽性T細胞の活性化を促進することが明らかになりました。
これにより、抗原性の低い腫瘍に対しても有効なT細胞応答が誘導されることが示されました。さらに、YB328株の投与によりCD103陽性樹状細胞のTLR発現が亢進し、YB328株以外の腸内細菌叢に対する感受性が増加すること、またYB328株自体が腸内細菌叢の多様性を改善することも同時に確認されました。
展望
これらの結果から、経口投与された腸内細菌が、腸とは離れたがん組織にも免疫効果を発揮する仕組みが明らかとなりました。また、非炎症性のがんにおいても、より高い反応性を持つCD8陽性T細胞の誘導が可能になる可能性が示されました。加えて、免疫チェックポイント阻害薬が効きにくい患者さんにおいても、YB328株を投与することで腸内細菌叢の構成が変化し、免疫チェックポイント阻害薬に反応しやすい腸内環境へと整える可能性があることが示唆されました。YB328株は、公開データの解析により日本人のおよそ20%が自然に保菌している菌株であることが確認されており、安全な菌であることが示唆されます。
以上の成果から、YB328株は詳細な作用機序に裏付けられた、がん免疫応答を高める新たな経口アジュバント(免疫賦活化剤)として、次世代のがん免疫療法への応用が期待されます。
論文情報
雑誌名
Nature
タイトル
Microbiota-driven antitumour immunity mediated by dendritic cell migration
著者
Nina Yi-Tzu Lin1,2,*, Shota Fukuoka1,*, Shohei Koyama1,3,*, Daisuke Motooka4,
Dieter M. Tourlousse5, Yuko Shigeno6, Yuki Matsumoto4, Hiroyuki Yamano4,
Kazutoshi Murotomi5, Hideyuki Tamaki7, Takuma Irie1, Eri Sugiyama1,8,
Shogo Kumagai1,9, Kota Itahashi1, Tokiyoshi Tanegashima1, Kaori Fujimaki2,
Sachiko Ito2, Mariko Shindo10, Takahiro Tsuji10, Hiroaki Wake10, Keisuke Watanabe1,
Yuka Maeda1, Tomohiro Enokida11, Makoto Tahara11, Riu Yamashita12,
Takao Fujisawa11,13, Motoo Nomura14, Akihito Kawazoe15, Koichi Goto8,
Toshihiko Doi15, Kohei Shitara15, Hiroyuki Mano9, Yuji Sekiguchi5, Shota Nakamura4,
Yoshimi Benno6,16,#, Hiroyoshi Nishikawa1,2,17,18,#,+
所属
1Division of Cancer Immunology, Research Institute/Exploratory Oncology Research & Clinical Trial Center (EPOC), National Cancer Center, Tokyo 104-0045/Chiba 277-8577, Japan
2Department of Immunology, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan
3Department of Respiratory Medicine and Clinical Immunology, The University of Osaka Graduate School of Medicine, Osaka 565-0871, Japan
4Department of Infection Metagenomics, Genome Information Research Center, Research Institute for Microbial Diseases, The University of Osaka, Osaka 565-0871, Japan
5Molecular Biosystems Research Institute, National Institute of Advanced Industrial Science and Technology (AIST), Ibaraki 305-8566, Japan
6Benno Laboratory, RIKEN Baton Zone Program, RIKEN Cluster for Science Technology and Innovation Lab, Saitama 351-0198, Japan
7Biomanufacturing Process Research Center, National Institute of Advanced Industrial Science and Technology (AIST), Ibaraki 305-8566, Japan
8Department of Thoracic Oncology, National Cancer Center Hospital East, Chiba 277-8577, Japan
9Division of Cellular Signaling, National Cancer Center Research Institute, Tokyo 104-0045, Japan
10Department of Anatomy and Molecular Cell Biology, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan
11Department of Head and Neck Medical Oncology, National Cancer Center Hospital East, Chiba 277-8577, Japan
12Division of Translational Informatics, Exploratory Oncology Research & Clinical Trial Center (EPOC), National Cancer Center, Chiba 277-8577, Japan
13Translational Research Support Office, National Cancer Center Hospital East, Chiba 277-8577, Japan
14Department of Head and Neck Oncology and Innovative Treatment, Graduate School of Medicine, Kyoto University, Kyoto 606-8501, Japan
15Department of Gastroenterology and Gastrointestinal Oncology, National Cancer Center Hospital East, Chiba 277-8577, Japan
16Benno Institute for Gut Microflora (BIGM), Saitama Industrial Technology Center, Saitama 333-0844, Japan
17Division of Cancer Immune Multicellular System Regulation, Center for Cancer Immunotherapy and Immunobiology, Kyoto University Graduate School of Medicine, Kyoto 606-8501, Japan
18Kindai University Faculty of Medicine, Osaka-sayama 589-8511, Japan.
*These authors contributed equally to this study.
#Corresponding author+Lead contact
掲載日
英国時間2025年7月14日(日本時間7月15日)付
DOI
10.1038/s41586-025-09249-8
URL
https://www.nature.com/articles/s41586-025-09249-8(外部サイトにリンクします)
研究費
国立研究開発法人日本医療研究開発機構(AMED)
- 次世代治療・診断実現のための創薬基盤技術開発事業 「腸内マイクロバイオーム制御による次世代創薬技術の開発」
- 革新的先端研究開発支援事業 「腸内細菌叢のがん免疫応答への関わりの解明によるがん治療への展開」
- ムーンショット目標7 日米連携による 「がんゼロ社会」 に向けた研究開発 慢性炎症の制御によるがん発症ゼロ社会の実現
国立がん研究センター研究開発費
- 2024-A-03 「先進的免疫ゲノム解析確立に向けた検体バンキングと網羅解析基盤の樹立」
用語解説
注1 樹状細胞
体内の「監視役」であり、異物を見つけ出して免疫の働きを始動させる重要な細胞。がん細胞や細菌・ウイルス、などの異物を取り込み、その特徴(抗原)をT細胞に見せて「この異物を攻撃せよ」と指令を出す。
注2 PD-1阻害薬(抗PD-1抗体)
がん細胞が免疫の攻撃から逃れようとする仕組みを解除する薬のこと。PD-1はT細胞の表面にある分子で、免疫の働きにブレーキをかける役割をしている。このブレーキがあることで、体の免疫は暴走せずにすんでいる。しかし、がん細胞はこの仕組みを悪用し、自分への攻撃を防いでいる。PD-1阻害薬はそのブレーキを外し、T細胞が本来の力を発揮してがん細胞を攻撃できるようにする薬である。
注3 CD8陽性T細胞
がん細胞やウイルス感染細胞を直接攻撃して排除する免疫細胞。異物の情報を受け取ると、標的に正確に向かい、攻撃を行う。攻撃の際にはIFN-γやグランザイムBなどの細胞を傷害する顆粒を発現してがん細胞を直接攻撃・死滅させる。獲得免疫応答の中心的な役割を果たし、キラーT細胞とも呼ばれる。
注4 腸内細菌叢
私たちの腸の中にすんでいるたくさんの細菌の集まりのこと。人の腸内には、100兆個以上の細菌が存在している。近年、これらの腸内細菌がさまざまな病気のかかりやすさや治療効果の違いに関わっている可能性が、研究によって明らかになってきている。
注5 アジュバント(免疫賦活化剤)
免疫をつけたい抗原だけでは十分な免疫反応が起こらない場合に、抗原と同時に投与することで免疫細胞を強く刺激し、免疫記憶をつくりやすくする成分。
注6 フローサイトメトリー
サンプル溶液中の細胞を流し、一つ一つ整列させてレーザーを当てることによって細胞表面分子や細胞内分子の発現を解析する実験手法である。
注7 自然免疫応答
病原体などが外部から侵入してきた際にその成分に反応して速やかに排除する応答のこと。
注8 サイトカイン
免疫細胞などから分泌されるタンパク質で、極めて微量で標的細胞に対して作用を示して細胞間の情報伝達を担う。
注9 Toll様受容体(TLRs)
細菌やウイルスなどの特徴的な構造を見分ける受容体で樹状細胞などの自然免疫系の細胞表面上に発現している。
注10 クロスプレゼンテーション
自分の細胞の中で作られたもの(自己たんぱく質)ではない異物(がん細胞やウイルスのかけらなど)を、主に樹状細胞が特殊な仕組みで処理し、CD8⁺T細胞に「外来たんぱく質」として提示すること。
注11 前駆細胞
特定の種類の細胞に分化する途中の段階にある細胞のこと。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター研究所
腫瘍免疫研究分野/先端医療開発センター 免疫TR分野 西川 博嘉
電話番号:03-3542-2511(代表) Eメール:hnishika●ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表) Eメール:ncc-admin●ncc.go.jp
国立大学法人大阪大学
大学院医学系研究科 広報室
電話番号:06-6879-3387 Eメール:medpr●office.med.osaka-u.ac.jp
国立大学法人京都大学
広報室 国際広報班
電話番号:075-753-5729 Eメール:comms●mail2.adm.kyoto-u.ac.jp
国立大学法人東海国立大学機構名古屋大学
医学部・医学系研究科 総務課
電話番号:052-744-2228 Eメール:iga-sous●t.mail.nagoya-u.ac.jp
国立研究開発法人理化学研究所
広報部 報道担当
電話番号:0050-3495-0247 Eメール:ex-press●ml.riken.jp
国立研究開発法人産業技術総合研究所
ブランディング広報部・報道室
電話番号:029-862-6216 Eメール:press-ml●aist.go.jp
