トリプルネガティブ乳がんの浸潤・転移機構の一端を解明~トリプルネガティブ乳がんの新たな診断・治療法の開発に期待~
2024年2月15日
東京薬科大学
国立がん研究センター
新潟大学
東京医科歯科大学
発表のポイント
- トリプルネガティブタイプとよばれる悪性度の高い乳がんにおいて微小管-アクチン結合タンパク質MAP1Bが高発現しており、予後増悪と深い関係があることを発見しました。
- MAP1Bは、浸潤突起とよばれるがん細胞がもつ特殊な構造の形成に関わるタンパク質Tks5をオートファジーによる分解から守ることでがん細胞の浸潤・転移能を高めていることが明らかになりました。
- これらの成果は、トリプルネガティブ乳がんに対する新たな診断薬・治療薬の開発に役立つことが期待されます。
概要
東京薬科大学 生命科学部 分子細胞生物学研究室の井上弘樹講師、国立がん研究センター中央病院 病理診断科の吉田正行医員、新潟大学 大学院医歯学総合研究科 薬理学分野の吉松康裕准教授、東京医科歯科大学 大学院医歯学総合研究科 病態生化学分野の渡部徹郎教授、国立がん研究センター臨床検査科の松下弘道教授(研究当時、現:慶應義塾大学医学部臨床検査医学教室)らの研究グループは、トリプルネガティブ乳がん(TNBC)注1においてMAP1B(Microtubule-Associated Protein 1B)とよばれるタンパク質ががん細胞の転移・浸潤を促進していることを発見しました。本研究の成果は、TNBC 悪性化の分子機構の一端を明らかにするとともに、この機構を標的としたTNBCの診断薬・治療薬の開発に繋がることが期待されます。この成果は、2024年2月14日(米国東部時間10時、日本時間2月15日0時)の米国科学誌「Journal of Cell Biology」に掲載されました。
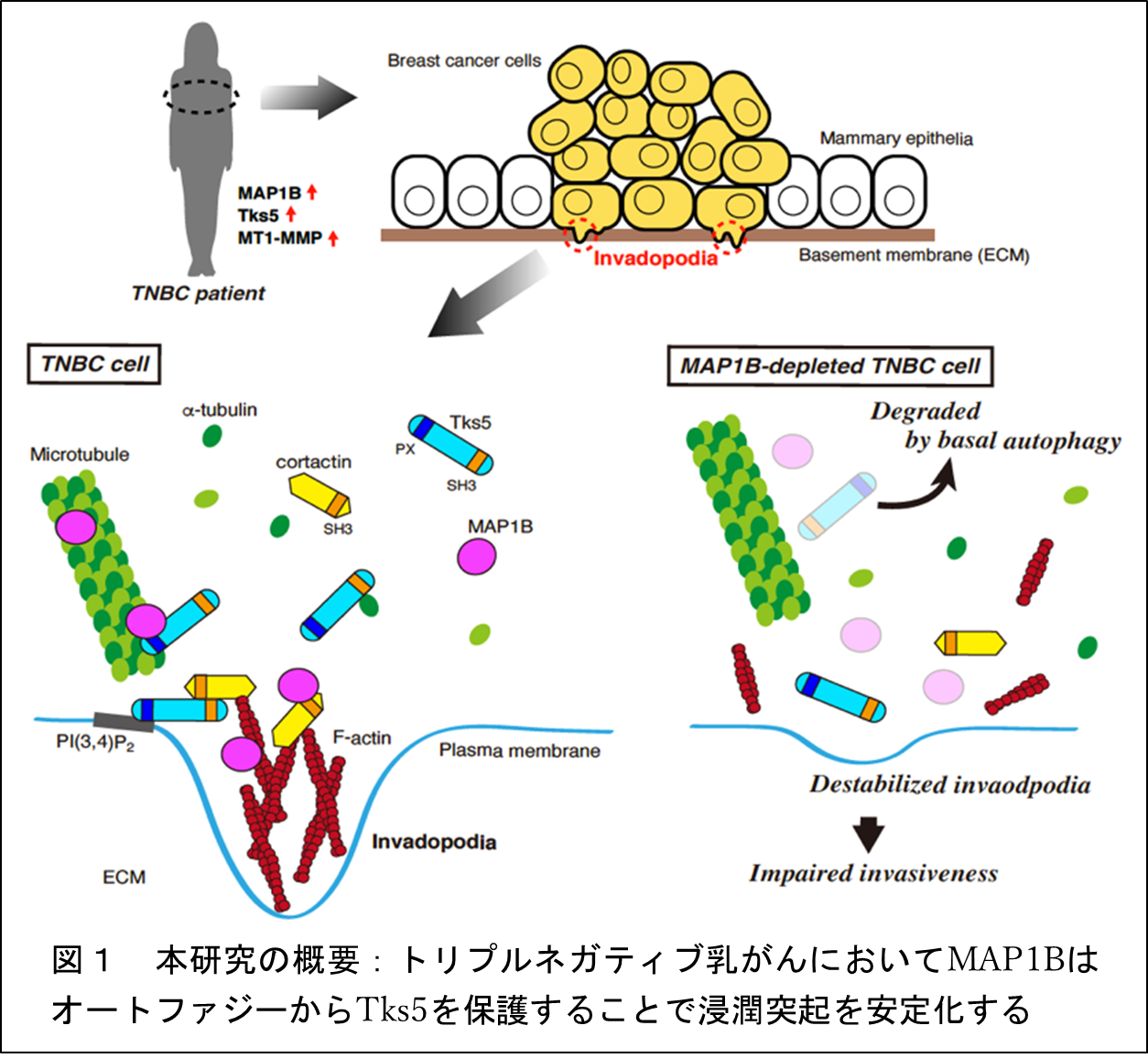
図1 本研究の概要
背景
乳がんは、女性が罹患するがんの中で最も数が多く、日本では毎年9万人以上が新たに診断されます。乳がんは、その特徴から大きくLuminal A、Luminal B、HER2+、トリプルネガティブ(TNBC)の4つのタイプに分けられます。そのうち、TNBCでは、がん細胞の増殖が速く、細胞が周辺の組織や他の臓器に広がる「浸潤」や「転移」に至る可能性が高いと言われています。最近では、いくつかのがんで「分子標的薬」とよばれる副作用の少ない有効な薬が開発されてきていますが、TNBCでは有効な分子標的薬が少なく、治療の選択肢が限られていることから、その性質を遺伝子やタンパク質といった分子のレベルで理解し、新たな診断薬や治療薬の開発に繋げることが望まれています。
がん細胞が周辺組織に浸潤していく際には、「浸潤突起」とよばれる細胞膜の微細な突起状構造を形成し、この浸潤突起に集積した細胞外基質分解酵素ががん細胞の周りのコラーゲンなどの細胞外基質を分解することで浸潤が進行します。浸潤突起は、細胞骨格タンパク質アクチン注2がcortactinなどの種々のアクチン制御タンパク質とともにドット状の構造体を形成し、細胞膜の特定の脂質(ここでは、ホスファチジルイノシトール 3,4-二リン酸、PI(3,4)P注3)に結合するタンパク質Tks5を介してそのドット状の構造体が細胞膜に繋留されることで形成されます。新たに形成された浸潤突起には、細胞骨格の微小管を介した小胞輸送によりMT1-MMPなどの細胞外基質分解酵素が輸送され、浸潤突起が成熟します。
MAP1Bは発生中の脳などの中枢神経系で多く発現しているタンパク質で、アクチンと微小管注4の両方に結合することが知られています。この性質により、MAP1Bは神経細胞の軸索や樹状突起といった神経突起の伸長と安定化に関わっていることが知られています。しかしながら、がんとの関連についてはこれまであまり知られておらず、発現が認められるいくつかのがん細胞においてもその機能の詳細は明らかになっていませんでした。
研究成果
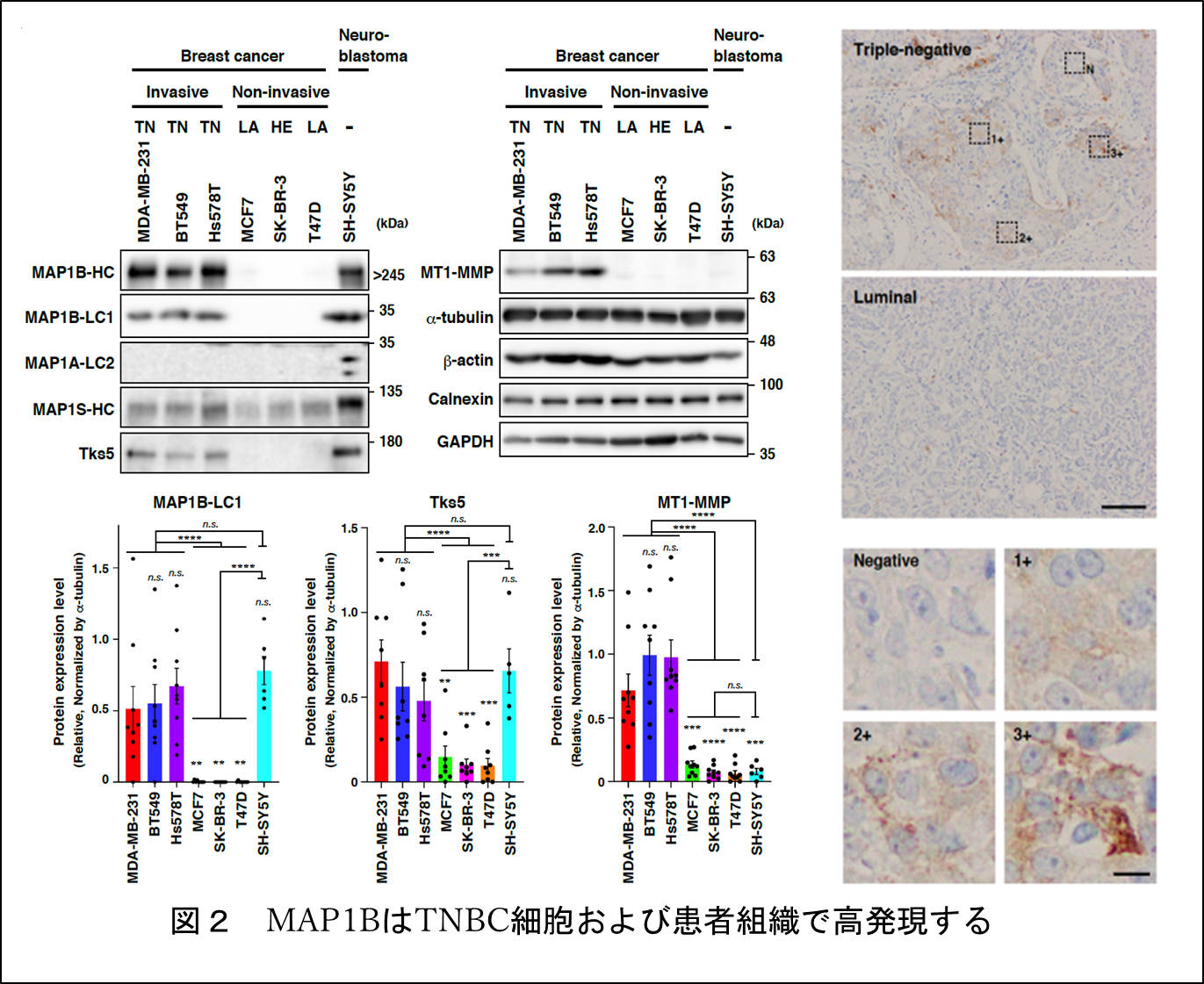
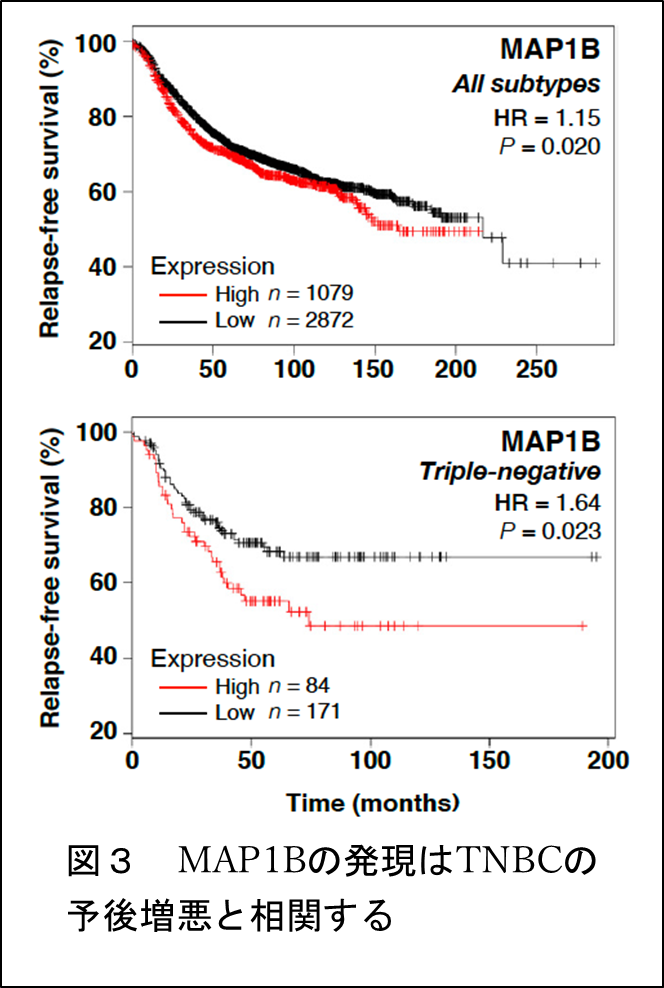
本研究では、まず、公的データベースのRNA-seq注5などの情報をもとに、MAP1BがTNBC患者のがん組織やTNBC細胞株で高発現していることを見出しました。実際にこれらの患者のがん組織や細胞株でMAP1BがmRNA、タンパク質レベルで高発現していることを確認しました(図2)。MAP1Bの発現が多いTNBC患者のグループでは、低いグループと比べて、予後が悪いことも分かりました(図3)。
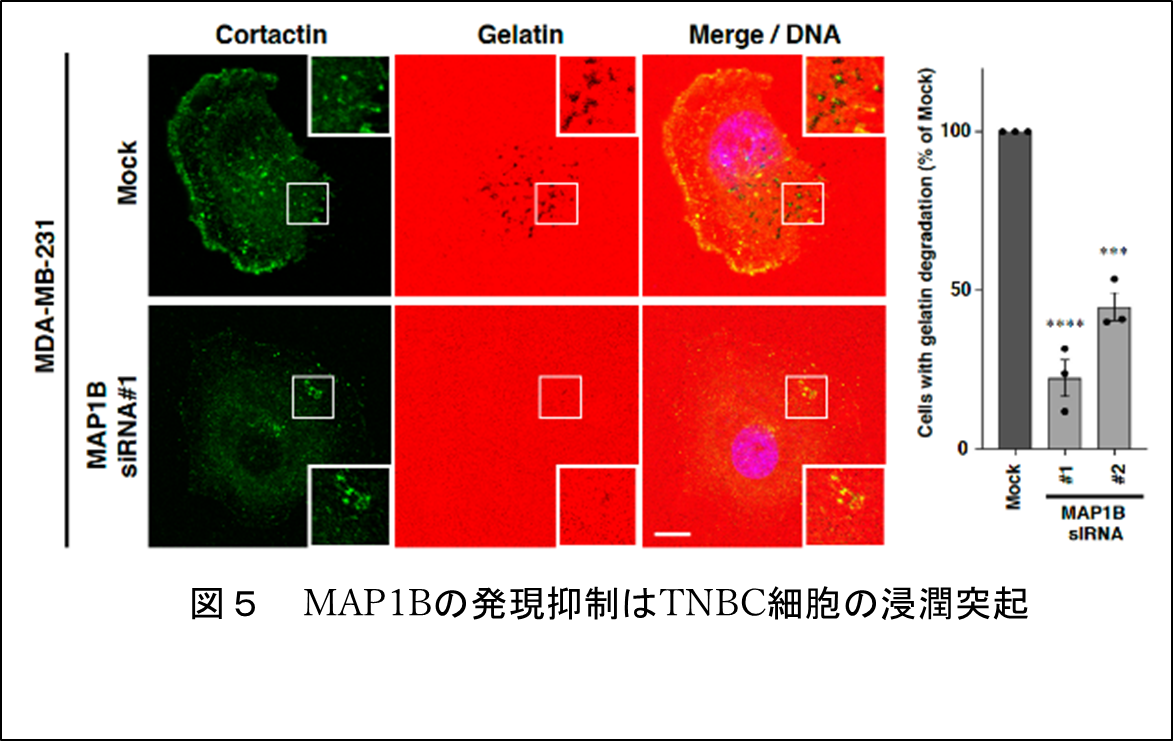
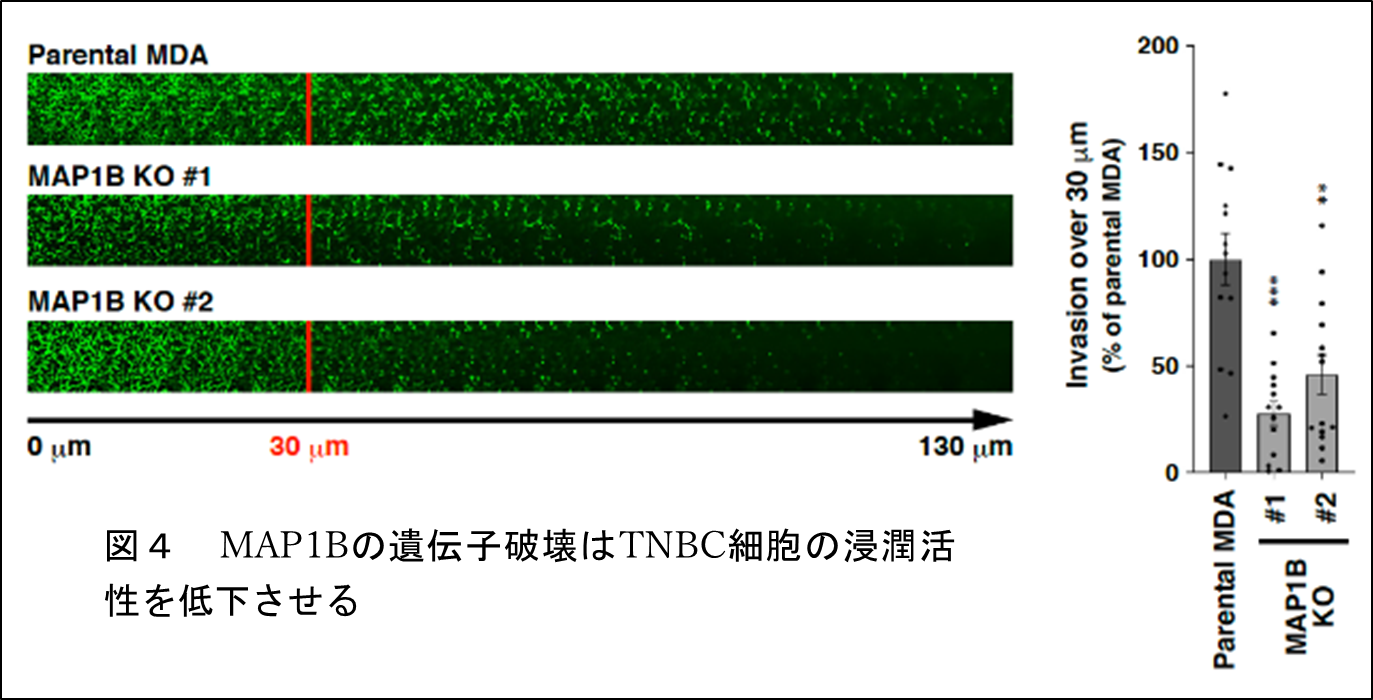
RNAi注6やゲノム編集注7によりMAP1Bの発現を抑制したTNBC細胞では、in vitroやマウスモデルにおいて腫瘍の形成や浸潤活性が有意に低下しました(図4)。このとき、MAP1Bの発現を抑制したTNBC細胞では、浸潤突起の形成、成熟も合わせて低下していました(図5)。
MAP1Bの一部は浸潤突起に局在しており、浸潤突起を構成するタンパク質cortactinやTks5と複合体を形成していました。MAP1BはcortactinやTks5がもつSH3ドメイン注8に直接結合しました。それら複合体の形成は、アクチン繊維や微小管の重合を阻害する薬剤で阻害されたことから、これら細胞骨格依存的であることが示唆されました。
これまでTks5が浸潤突起においてアクチンの構造体と結合することは知られていましたが、本研究で初めて、Tks5が微小管にも結合すること、また、PI(3,4)Pに対する結合活性を欠いたTks5(スプライシングバリアント注9の一つであるTks5βと相同)が微小管を束化する活性を持つことが示されました。Tks5とMAP1Bの微小管への結合は相互に依存的であることも併せて明らかにしました。
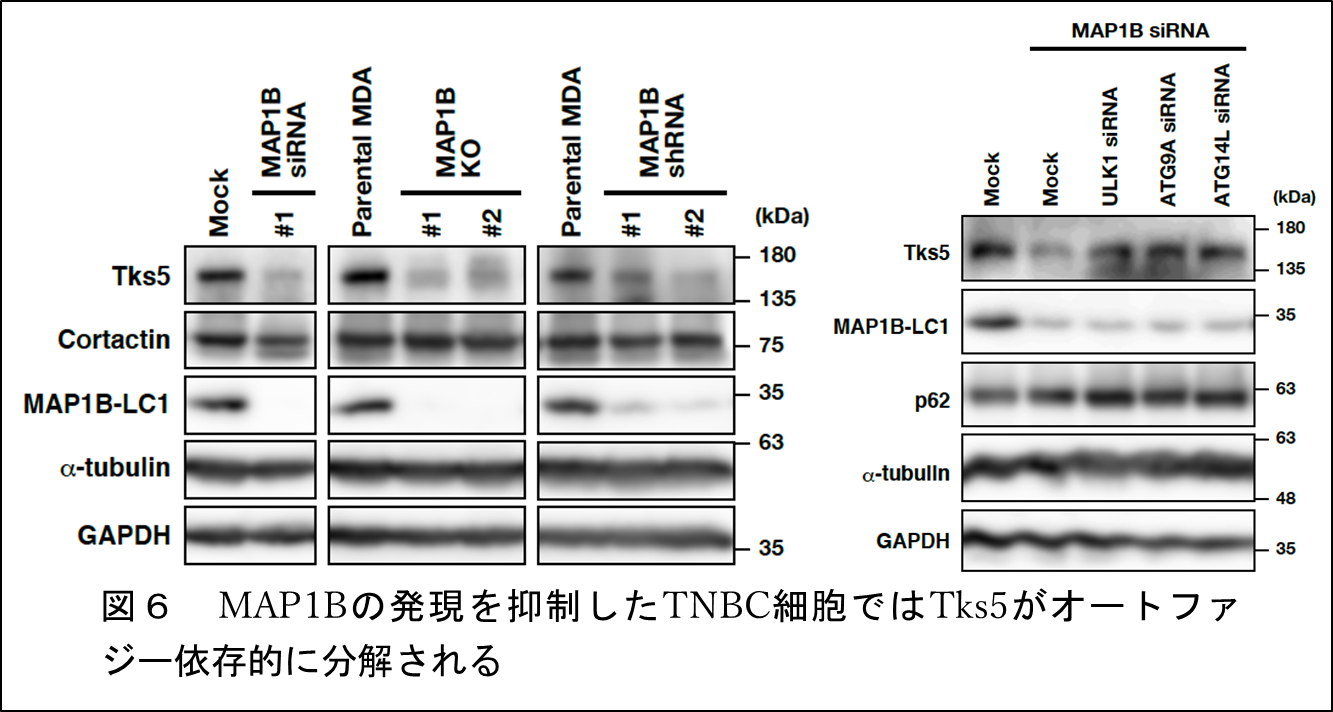
さらに、MAP1Bの発現を抑制したTNBC細胞ではTks5がオートファジー注10依存的に分解されることも明らかになりました(図6)。
以上の結果から、MAP1Bは、TNBC細胞においてcortactinやTks5との相互作用を介して浸潤突起を正に制御しており、がんの浸潤転移を促進することが示唆されました。
展望
予備的な実験結果から、MAP1BやTks5は今回明らかにした浸潤転移のみならず、TNBC細胞の増殖や腫瘍形成能にも関わる結果が得られており、それらの機構についても今後詳細を明らかにしていく予定です。また、これら機構を標的とした薬物スクリーニングを行なっていきます。これにより、難治性TNBCの発症・病態の分子機構の一端が明らかとなり、新たな診断薬・治療薬開発に繋がることが期待されます。
発表論文
雑誌名
Journal of Cell Biology
タイトル
A MAP1B-cortactin-Tks5 axis regulates TNBC invasion and tumorigenesis
著者
井上弘樹1、神田拓1、林楽人1、棟長遼太1、吉田正行2、長谷川花奈1、宮川拓也1、車田征哉1、長谷川純平1、和田朋之1、堀内基1、吉松康裕3,4、伊東史子1、前本佑樹1、新崎恒平1、若菜裕一1、渡部徹郎4、松下弘道5、原田浩徳1、多賀谷光男1
(所属)1 東京薬科大学・生命科学部、2 国立がん研究センター中央病院・病理診断科、3 新潟大学・大学院医歯学総合研究科、4 東京医科歯科大学・大学院医歯学総合研究科、5 慶應義塾大学・医学部
DOI
10.1083/jcb.202303102
掲載日
2024年2月14日10時(米国東部時間)
用語解説
注1 トリプルネガティブ乳がん(TNBC)
乳がん細胞の増殖に関係する3つのタンパク質(エストロゲン受容体、プロゲステロン受容体、HER2)をもたないことからこう呼ばれる。TNBC以外のタイプの乳がんではこれらタンパク質を標的とした治療が可能であるが、これらを発現しないTNBCは一般に予後が悪い。
注2 アクチン
細胞骨格の一種。通常の細胞(心筋や骨格筋以外の細胞)では、βアクチンとよばれるタンパク質がポリマー(多量体)を形成することにより、繊維状の構造体を作り、細胞の運動や分裂など様々な現象に関与する。
注3 ホスファチジルイノシトール 3,4-二リン酸、PI(3,4)P2
細胞膜を構成する脂質の一種で、ホスファチジルイノシトールとよばれる脂質が特異的な酵素によりリン酸化されることにより形成される。主に、シグナル伝達分子として機能する。
注4 微小管
細胞骨格の一種。αとβの2種類のチューブリンとよばれるタンパク質がポリマー(多量体)を形成することにより、管状の構造体を作り、細胞の分裂や物質輸送など様々な現象に関与する。
注5 RNA-seq
ある組織や細胞で発現するすべてのRNAの塩基配列を次世代シークエンサーとよばれる塩基配列決定装置によって網羅的に決定する技術。現在では、比較的安価に高速でRNA-seq解析ができるようになってきており、種々の疾患などに伴う遺伝子発現変化が盛んに調べられている。
注6 RNAi
RNA干渉法。低分子のRNAを細胞内に導入することにより、その配列と相補的な配列をもつmRNAの特異的な分解を促進する方法。mRNAが分解された結果、それがコードするタンパク質の量も減るため、そのタンパク質の機能を調べるのに用いられる。
注7 ゲノム編集
染色体DNA(ゲノム)の中の特定の遺伝子を破壊したり、外来の遺伝子を挿入したりする手法。2020年にドイツのCharpentier博士と米国のDoudna博士がノーベル化学賞を受賞したCRISPR-Cas9とよばれるゲノム編集技術が発明されたことで研究や産業で一気に広まった。
注8 SH3ドメイン
タンパク質の中に含まれる部分構造の一つで、プロリンとよばれるアミノ酸が多く存在する配列に結合する性質をもつ。シグナル伝達に関わるタンパク質でよく見られる。
注9 スプライシングバリアント
塩基配列が部分的に異なるmRNA。スプライシングとよばれる現象を経てmRNAが作られる際に、スプライシングのパターンの違いにより作られる。
注10 オートファジー
細胞内で起こる自食作用。細胞が飢餓状態になった際、自身を構成する細胞内の成分を細胞が分解する現象。飢餓状態以外でも機能不全になった一部のタンパク質や細胞小器官はオートファジーにより分解される。がんや神経変性疾患をはじめ多くの病気との関わりが明らかになっている。オートファジーの機構解明により、2016年、日本の大隅良典博士がノーベル生理学・医学賞を受賞した。
研究支援
日本学術振興会 科学研究費助成事業 基盤研究(B)21H02432 (代表者:井上弘樹)
発表者・機関窓口
発表者
東京薬科大学 生命科学部
分子細胞生物学研究室 講師 井上弘樹
電話番号:042-676-7110
国立がん研究センター中央病院
病理診断科 吉田正行
新潟大学 大学院医歯学総合研究科
薬理学分野 准教授 吉松康裕
東京医科歯科大学 大学院医歯学総合研究科
病態生化学分野 教授 渡部徹郎
慶應義塾大学 医学部
臨床検査医学教室 教授 松下弘道
機関窓口
東京薬科大学 広報課
電話番号:042-676-6711
Eメール:kouhouka●toyaku.ac.jp
国立がん研究センター 企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール: ncc-admin●ncc.go.jp
新潟大学 広報事務室
電話番号: 025-262-7000
Eメール: pr-office●adm.niigata-u.ac.jp
東京医科歯科大学 総務秘書課広報係
電話番号: 03-5803-5011
Eメール: kouhou.adm●tmd.ac.jp