特発性肺線維症に対する新たな治療標的PAK2を発見~シングルセルRNA-seq解析および空間トランスクリプトーム解析技術を統合した最先端の手法により解明~
2025年7月22日
東京慈恵会医科大学
国立研究開発法人国立がん研究センター
埼玉県立循環器・呼吸器病センター
東京慈恵会医科大学総合医科学研究センター次世代創薬研究部の藤田雄准教授、同大学内科学講座呼吸器内科の渡邉直昭助教、平野悠太助教、吉田昌弘講師、荒屋潤教授、国立がん研究センター研究所病態情報学ユニットの山本雄介ユニット長、および埼玉県立循環器・呼吸器病センター呼吸器内科の石黒卓副部長、呼吸器外科の高橋伸政科長、病理診断科の清水禎彦医師らの研究グループは、特発性肺線維症(IPF)注1患者の肺組織を対象に、シングルセルRNA-seq解析注2と空間トランスクリプトーム解析注3技術を用いて、IPFの進行に関わる病的線維芽細胞の分子的特徴と空間分布を明らかにしました。IPFでは、上皮の再生障害により、線維芽細胞巣注4(Fibroblastic foci, FF)周囲に異常上皮細胞(aberrant basaloid cell注5)が出現し、進行病変(Dense Fibrosis, DF)への移行に関与します。本研究では、これらFFおよびDFに局在しaberrant basaloid cellと相互作用しながら線維化を促進するニッチ注6を形成するWNT5A+ CTHRC1+線維芽細胞を同定し、これらの細胞で活性化されているPAK2というキナーゼ注7が新たな治療標的であることを示しました。さらにPAK2阻害剤よる線維化抑制効果をマウスモデルで実証しました。本研究によりIPF病態の詳細な解明につながり、ひいては新たな治療法開発への貢献が期待されます。この研究成果は、欧州呼吸器学会雑誌「European Respiratory Journal」にオンライン版に掲載されました。(日本時間 2025年7月17日公開)
概要
- シングルセルRNA-seqと空間トランスクリプトーム解析を併用し、IPF患者由来の肺組織における細胞種と遺伝子発現の空間的な特徴を包括的に解析しました。
- 線維化病態に関わる新規の線維芽細胞(WNT5A+CTHRC1+myofibroblast)を同定しました。
- WNT5A+CTHRC1+myofibroblast含む線維化領域にPAK2が活性化していることが判明し、新規治療標的を同定しました。
- PAK2阻害剤を用いたin vitro, in vivoにおける実証実験で、高い抗線維化効果を確認しました。
- 本研究がIPF病態のより詳細な解明につながり、新たな治療開発へと繋がることが期待されます。
本研究の概要図
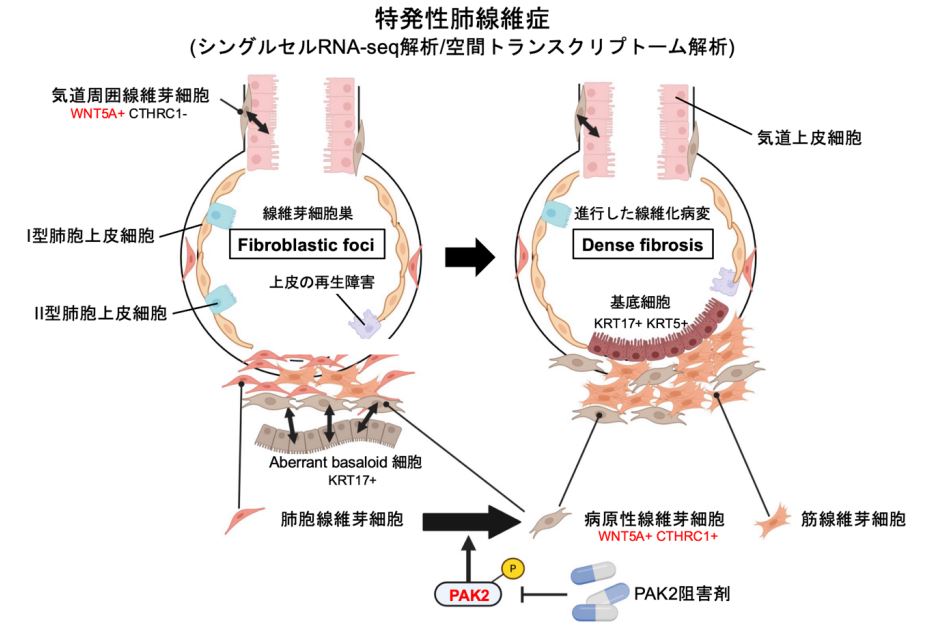
1. 背景
IPFは原因不明の慢性呼吸器疾患で、肺組織が不可逆に線維化し、進行性の呼吸不全を引き起こす難病です。診断からの中央値生存期間は約3-5年であり、また急性増悪を来すと約50%以上が死亡に至るとされ、非常に予後不良な疾患として知られています。現時点では根治的な治療法は存在せず、病態解明や新規治療標的の探索が求められています。線維芽細胞の異常な活性化が病態進行の中心であり、特にIPFの肺組織では「線維芽細胞巣(Fibroblastic foci, FF)」と呼ばれる線維芽細胞の集簇が特徴的にみられ、病態の中心と考えられていますが、その細胞レベル・分子レベルでの詳細は不明でした。1細胞レベルでの遺伝子発現解析を可能としたシングルセルRAN-seq解析と、遺伝子発現に組織内の遺伝子発現を空間的に解析できる空間トランスクリプトーム解析を統合することで、線維化病態進行の分子メカニズムの解明を試みました。
2.研究手法・成果
空間トランスクリプトーム解析では、線維芽細胞巣(Fibroblastic Foci: FF)と、より構造改変の進行した線維化部位(Dense Fibrosis, DF)に注目し解析しました。シングルセルRNA-seq解析では、IPF患者と健常者の肺組織を比較し、肺の間質に存在する線維芽細胞の特徴を詳細に解析しました。その結果、WNT5AとCTHRC1の高い遺伝子発現を特徴とする新規の線維芽細胞集団(WNT5A+CTHRC1+myofibroblast)を同定しました(図1)。また線維芽細胞の時間的な分化の流れを解析したところ(Psuedotime trajectory解析注8)、肺胞の線維芽細胞がWNT5A+CTHRC1+myofibroblastへ分化する過程で、線維化促進に関わる遺伝子発現の増加(TAGLN, ACTA2)が特徴的にみられました。この細胞はFFのみならず、より線維化の進行したDF領域にも集まっていることが空間トランスクリプトーム解析により明らかになりました(図2)。加えて、この細胞はIPFで特徴的に出現する異常な上皮細胞(aberrant basaloid cell)と強い相互作用を有しており、線維化進行に中心的な役割を果たしていると考えられます。
パスウェイ解析により、FFとDFに関わる遺伝子群を制御する因子として、PAK2を見出しました。さらにPAK2がWNT5A+CTHRC1+myofibroblastに高発現していることから(図2)、治療標的として有望であると考えられました。このPAK2を阻害する薬剤(FRAX486, FRAX597)による抗線維化効果を検証するため、In vitroではTGF-βにより活性化させた線維芽細胞やIPF患者由来の線維芽細胞を用い、in vivoでは、ブレオマイシン誘導肺線維症モデルマウスを用いて実験を行いました。In vitro, in vivoともに、PAK2阻害剤は優れた線維化抑制効果を示し(図3)、さらにWNT5A+, CTHRC1+の発現および発現細胞数を低下させることも確認されました。
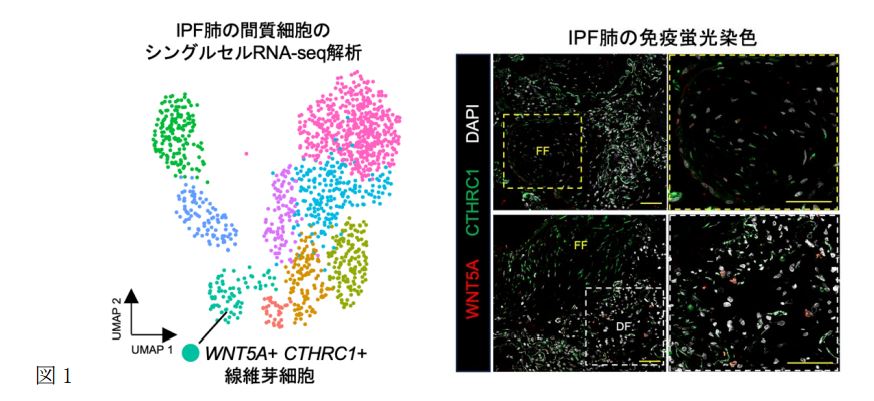
図1. シングルセルRNA-seq解析でIPF肺の間質細胞の詳細な遺伝子プロファイリングを行ったところ、WNT5AおよびCTHRC1を高発現する新規の線維芽細胞を同定しました(左)。公共データベースでの再現性に加え、IPF肺組織の免疫蛍光染色でも同細胞集団の存在をFFとDF領域で確認しました(右)。
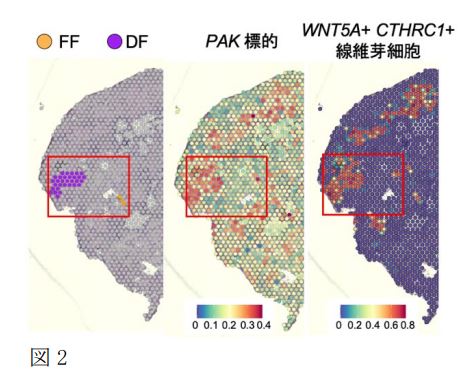
図2. シングルセルRNA-seq解析と空間トランスクリプトーム解析の統合により、IPF肺におけるFFとDFの分布、PAKが作用する分布、WNT5A+CTHRC1+myofibroblastの分布が類似することが判明しました。
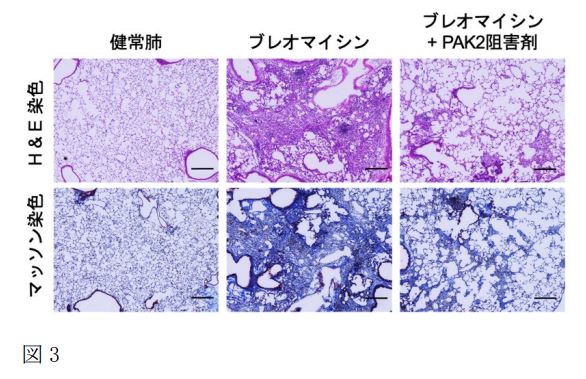
図3. ブレオマイシンにより線維化を誘導したマウスの肺組織に、PAK2阻害剤を投与することで、肺の線維化の改善を確認しました。
3.今後の展開
本研究により、IPF進行に関与する新たな病原性線維芽細胞の特性が明らかになり、それらを標的とする治療戦略の可能性が示されました。PAK2を阻害するFRAX486は難溶性であるが、現在溶解性を高めた製剤処方を研究責任者の藤田雄が起業した慈恵医大発ベンチャー株式会社EVerMedと開発を進めており、新たな分子標的治療の候補として今後の治療応用が期待されます。
4.脚注、用語説明
注1.特発性肺線維症 (Idiopathic Pulmonary Fibrosis;IPF)
明らかな原因がないまま肺の構造が損傷を受け、その修復過程で線維化が進行する疾患です。肺胞壁の肥厚と硬化により、ガス交換機能が低下し、呼吸困難や慢性の咳を引き起こします。進行性であり、診断後の平均生存期間はおよそ3~5年とされ、予後不良な疾患の一つです。
注2.シングルセルRNA-seq解析
組織内の個々の細胞を1つずつ解析し、細胞ごとの遺伝子発現や性質の違いを明らかにする技術です。従来のバルク解析では見逃されていた、細胞間の多様性や希少な細胞集団の同定が可能になります。
注3.空間トランスクリプトーム解析
遺伝子の発現情報を、組織内での「空間的位置」とあわせて解析する手法です。細胞がどこに存在し、どのような遺伝子を活性化しているかを視覚的に把握でき、病態の局所的な理解が進みます。
注4. 線維芽細胞巣
特発性肺線維症に特徴的な病理学的所見であり、活性化された線維芽細胞や筋線維芽細胞が集積している領域を指します。病変の進展部位と考えられており、線維化の進行に関与するとされています。
注5. Aberrant basaloid cell
通常とは異なる性質を持つ、基底細胞に似た形態や遺伝子発現を示す細胞です。特発性肺線維症などの病的肺組織で新たに出現するとされ、正常な上皮再生ではみられない異常な細胞集団と考えられています。病態との関連が注目されています。
注6. ニッチ(niche)
細胞が生きたり働いたりするうえで重要な、特定の“環境”や“場所”のことです。
本研究では、異常な線維芽細胞と上皮細胞が集まってお互いに影響し合い、線維化が進行する局所的な環境を指しています。こうした「病気を進行させる場」は、治療標的として注目されています。
注7. キナーゼ
細胞内で特定のたんぱく質にリン酸基を付加(リン酸化)する酵素で、シグナル伝達経路の制御に重要な役割を担います。がんや線維化疾患などの病態にも深く関与しており、創薬の標的として注目されています。
注8. Psuedotime trajectory解析
細胞が分化・変化していく「時間の流れ」を、実際の時間ではなく遺伝子発現の違いに基づいて推定する解析手法です。細胞がどのような経路で変化していくか(分化経路や状態遷移)を時系列的に再構築できます。主にシングルセル解析と組み合わせて用いられます。
5.論文タイトル,著者
掲載誌名
European Respiratory Journal
DOI
https://doi.org/10.1183/13993003.00022-2025(外部サイトにリンクします)
論文タイトル
Integrated Spatial and Single-Cell Transcriptomics Reveal PAK kinase as a Therapeutic Target in Fibroblastic Foci and Dense Fibrosis of IPF
著者
Naoaki Watanabe1,2#, Masahiro Yoshida1#, Yuta Hirano1,2#, Shota Fujimoto1, Sachi Matsubayashi1, Takashi Ishiguro3, Nobumasa Takahashi4, Yoshihiko Shimizu5, Noboru Takayanagi3, Yoshinori Kawabata5, Yutaro Mori6, Koji Okamoto6, Shunsuke Minagawa1, Kazuyoshi Kuwano1, Jun Araya1, Yusuke Yamamoto2*, Yu Fujita1,7*
著者(日本語表記)
渡邉直昭1,2#, 吉田昌弘1#, 平野悠太1,2#, 藤本祥太1, 松林沙知1, 石黒卓3, 高橋伸政4, 清水禎彦5, 高柳昇3, 河端美則5, 森裕太郎6, 岡本康司6, 皆川俊介1, 桑野和善1, 荒屋潤1, 山本雄介2*, 藤田雄1,7*
#共同筆頭著者
*責任著者
- 東京慈恵会医科大学内科学講座呼吸器内科
- 国立研究開発法人国立がん研究センター研究所病態情報学ユニット
- 埼玉県立循環器・呼吸器病センター呼吸器内科
- 埼玉県立循環器・呼吸器病センター呼吸器外科
- 埼玉県立循環器・呼吸器病センター病理診断科
- 国立研究開発法人国立がん研究センター研究所がん分化制御解析分野(研究当時)
- 東京慈恵会医科大学総合医科学研究センター次世代創薬研究部
6 主な研究資金
本研究は、日本学術振興会(JSPS)(課題番号21H02721、21H02930、22H03082、21K16149、23K27847、24K02696)、GSK ジャパン研究助成、公益財団法人 持田記念医学薬学振興財団、株式会社EVerMed、日本呼吸器学会等の支援を受けて行いました。
7. 本研究に関する問い合わせ先
東京慈恵会医科大学
総合医科学研究センター次世代創薬研究部
准教授 藤田 雄
Eメール:yuugot●jikei.ac.jp
HP: https://jikei-exosome.com(外部サイトにリンクします)
国立がん研究センター研究所 病態情報学ユニット
ユニット長 山本 雄介
電話番号:03-3542-2511(代表)
Eメール:yuyamamo●ncc.go.jp
ユニットHP:https://www.ncc.go.jp/jp/ri/division/integrative_oncology/index.html
8 報道機関からのお問い合わせ窓口
学校法人慈恵大学
法人事務局 経営企画部 広報課
電話:03-5400-1280
Eメール:koho●jikei.ac.jp
国立がん研究センター 企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
HP:https://www.ncc.go.jp/jp/index.html
埼玉県立循環器・呼吸器病センター
事務局 総務担当
電話番号:048-536-9900(代表)
Eメール:k369900●saitama-pho.jp
HP:https://www.saitama-pho.jp/junko-c/index.html(外部サイトにリンクします)
