DNA複製ストレスによる染色体不安定性と抗腫瘍免疫活性化の分子機構を解明-DNA複製ストレスを標的とした新規がん免疫療法の開発に期待-
2023年11月29日
国立研究開発法人国立がん研究センター
In English
発表のポイント
- DNA複製ストレス*1誘導剤による染色体不安定性*2と抗腫瘍免疫活性化の分子機構を解明しました。
- DNA複製ストレス誘導剤である新規CDC7(cell division cycle 7)キナーゼ*3阻害剤TAK-931*4(以下CDC7阻害剤TAK-931)が免疫チェックポイント阻害薬*5の薬効を高める可能性があることをマウスモデルで示しました。
- DNA複製ストレスを治療標的とする新規がん免疫療法の確立につながることが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)先端医療開発センター(センター長:土井 俊彦)共通研究開発分野の大橋紹宏ユニット長を研究代表者とした国際共同研究チームは、DNA複製ストレスによる染色体不安定性と抗腫瘍免疫活性化の分子機構を解明しました。
研究チームは、武田薬品工業株式会社(本社:東京都中央区)が創出した分子標的薬候補であるCDC7阻害剤TAK-931が、がん細胞に対しDNA複製ストレスを介した染色体不安定を強く誘導することを見出すとともに、この染色体不安定の誘導が抗腫瘍免疫反応を活性化し、さらに免疫チェックポイント阻害薬の薬効を高める可能性があることをマウスモデルで示しました。今後さらに研究を進めることで、DNA複製ストレスを治療標的とする新たながん治療法の確立につながることが期待されます。
本研究成果は、国際学術誌 「Nature Communications」 に2023年11月18日付で掲載されました。
背景
免疫チェックポイント阻害薬(ICI)は現在幅広いがん種で標準療法として使用されている一方で、ICIに抵抗性を示す免疫原生*6の低いがんも数多く存在することが分かってきました。これら免疫原生の低いがんに効果を示す新規治療法・併用療法の開発を目標に、私たちはDNA複製ストレス(RS)とICI感受性との関連性に着目しながら、RS誘導剤であるCDC7阻害剤TAK-931を用いた新規治療仮説を実験的に検証しました。
研究方法・成果
1.CDC7阻害によるRSはがん細胞に染色体不安定を引き起こし、細胞内炎症反応を惹起する
RS誘導剤であるCDC7阻害剤TAK-931はがん細胞に染色体不安定性を強く引き起こし、それに伴って扁平化・肥大化といった細胞内炎症反応に特徴的な老化細胞形態を誘導することがわかりました(図1A)。
また遺伝子発現解析を行ったところ、陰性対照細胞に比べCDC7阻害剤TAK-931処理後の扁平化・肥大化細胞はIL6、CCL5、CXCL10といった炎症性サイトカインやケモカイン*7の発現が有意に上昇していました(図1B)。炎症性サイトカイン・ケモカインは免疫細胞の活性化や腫瘍内への浸潤を促すことが知られているため、「CDC7阻害剤TAK-931によるがん細胞の染色体不安定性の誘導が、抗腫瘍免疫効果を高めるのではないか」という仮説を立てマウスモデルを用いた試験を実施しました(図1C)。
図1 CDC7阻害剤TAK-931処理細胞の細胞形態と細胞内炎症反応
A. CDC7阻害剤TAK-931処理後のHeLa細胞の形態B. CDC7阻害剤TAK-931処理細胞のIL6、CCL5、CXCL10の遺伝子発現
C. CDC7阻害剤TAK-931によるRSと細胞内炎症反応の薬理作用仮説
2.CDC7阻害剤TAK-931によるDNA複製ストレスは免疫細胞の腫瘍内浸潤を引き起こす
CDC7阻害剤TAK-931によるがん細胞へのDNA複製ストレスが実際に免疫細胞の腫瘍内浸潤を促進するかを調べるために、マウスモデルを用いた非臨床試験を実施しました。
腫瘍を皮下移植したマウスにCDC7阻害剤TAK-931および陰性対照剤を5~6日間経口投与を行い、腫瘍に浸潤している免疫細胞を免疫組織化学染色により可視化しました(図2A)。その結果、陰性対照剤投与マウス(図2B上図)に比べてCDC7阻害剤TAK-931投与マウス(図2B下図)では、T細胞(Cd3陽性細胞)、細胞障害性T細胞(Cd8陽性細胞)、ヘルパーT細胞(Cd4陽性細胞)、樹状細胞(Cd11c陽性細胞)が腫瘍内に多く存在していることが明らかとなりました。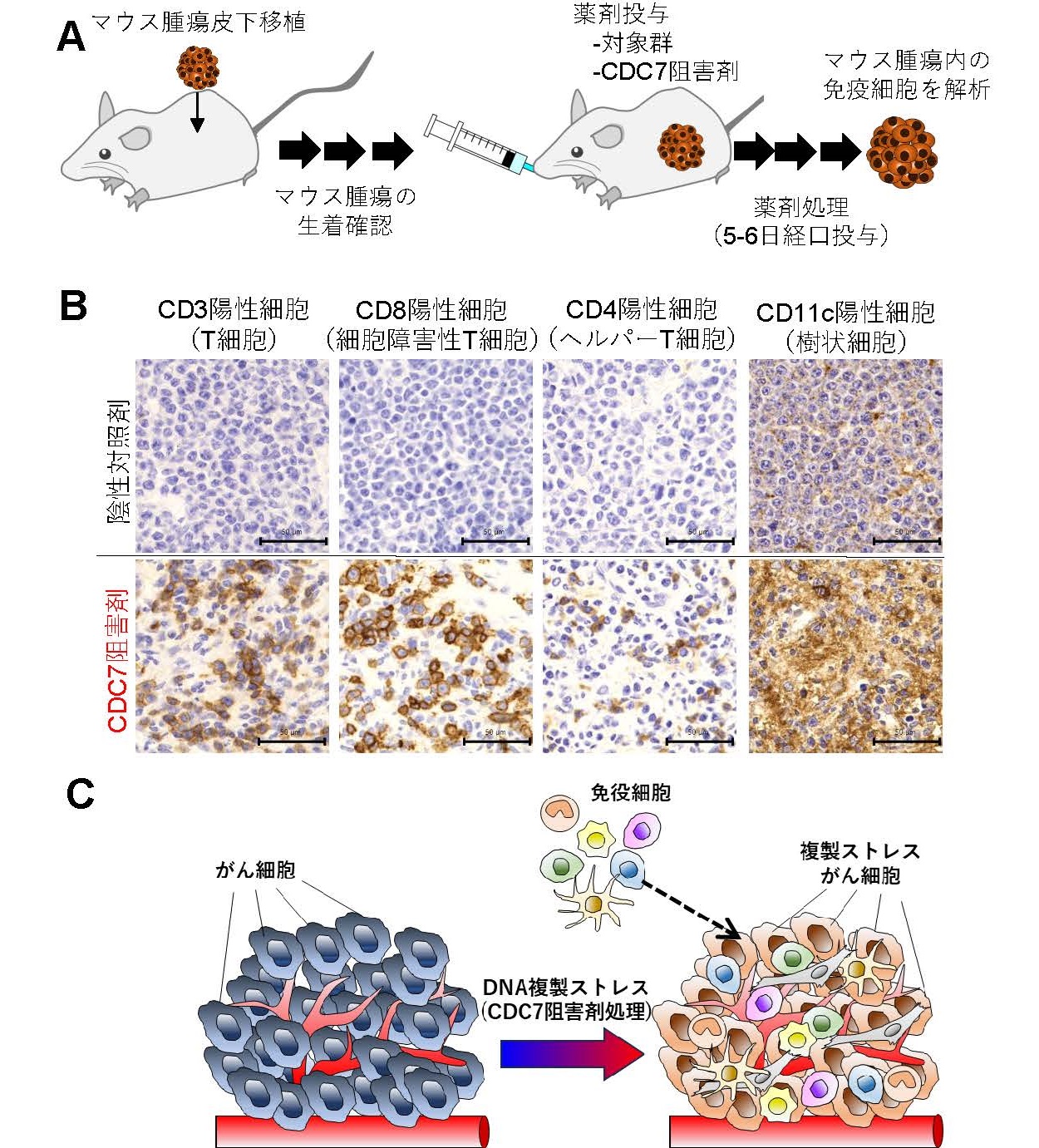
図2 マウスモデルを用いた免疫細胞の腫瘍内浸潤実験
A. 免疫細胞の腫瘍内浸潤実験デザイン
B. マウス移植腫瘍を用いた免疫組織化学染色
C. CDC7阻害剤TAK-931によるRSと免疫細胞の腫瘍内浸潤のサマリー
また再移植(リチャレンジ移植)実験を実施したところ(図3A)、CDC7阻害剤TAK-931投与マウスでは腫瘍の生着が見られず移植腫瘍に対する抗腫瘍免疫反応が高まっていることも確認されました(図3B)。これらはCDC7阻害剤TAK-931によるがん細胞のRSおよび染色体不安定性の誘導が抗腫瘍免疫反応を活性化させる非臨床実験データとなります。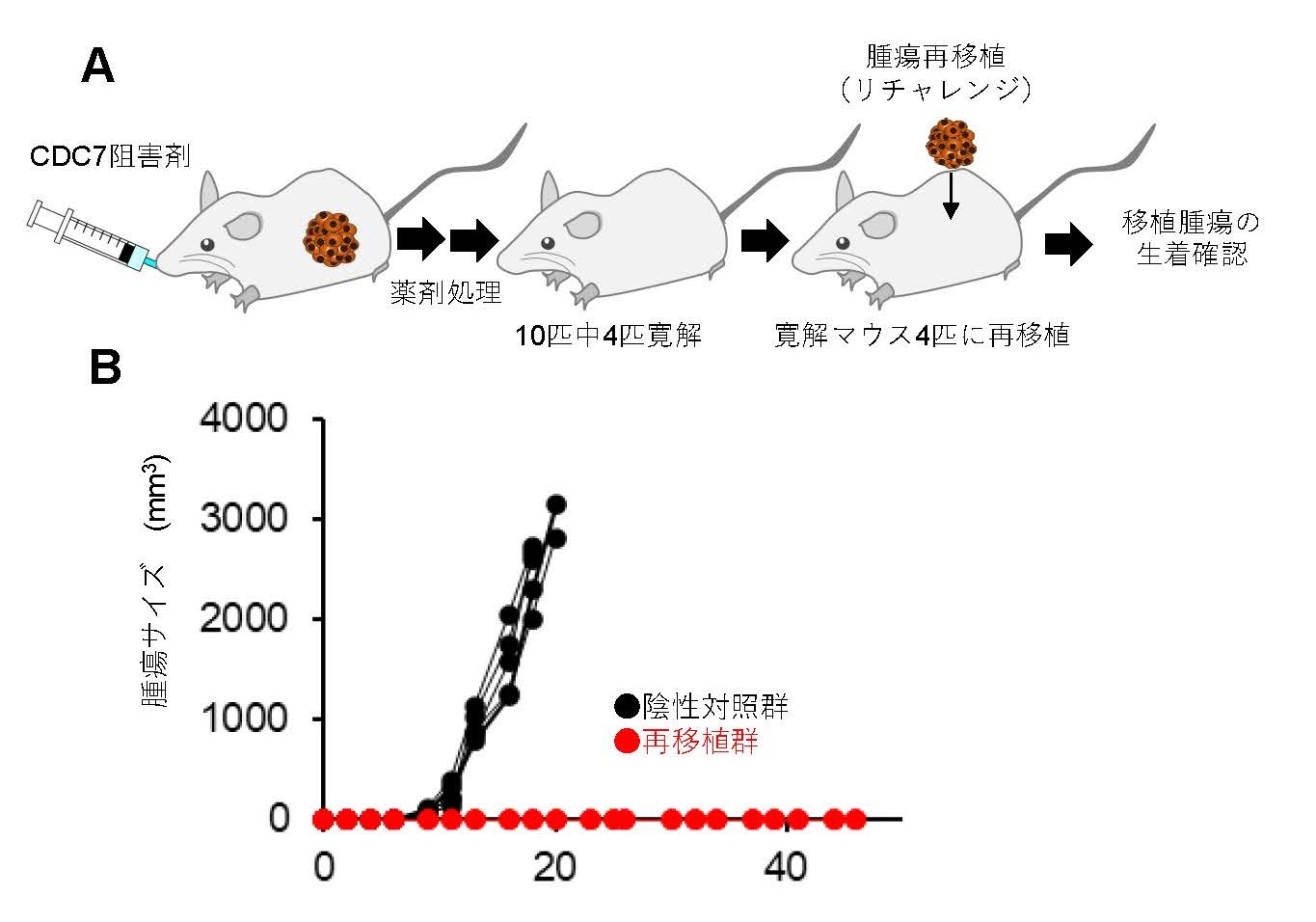
図3 マウスモデルを用いた再移植(リチャレンジ)実験
A. 再移植(リチャレンジ)実験デザイン
B. 再移植マウスおよび陰性対照マウスにおける腫瘍生着データ
3.CDC7阻害剤TAK-931によるDNA複製ストレスは免疫チェックポイント阻害薬の効果を高める
CDC7阻害剤TAK-931と免疫チェックポイント阻害薬との併用効果を調べるために、マウスモデルを用いた非臨床併用薬効試験を実施しました。
腫瘍を皮下移植したマウスに、陰性対照剤、CDC7阻害剤TAK-931単剤、抗マウスPD-1抗体単剤、CDC7阻害剤TAK-931と抗マウスPD-1抗体との併用剤の投与を行い、それぞれの投与群において腫瘍サイズの測定を行いました(図4A)。その結果、CDC7阻害剤TAK-931と抗マウスPD-1抗体との併用がより強い抗腫瘍効果を引き起こすことが明らかとなりました(図4B)。これらの非臨床試験結果は、CDC7阻害剤TAK-931によるDNA複製ストレスおよび染色体不安定性の誘導が抗腫瘍免疫反応を活性化し、その結果免疫チェックポイント阻害薬への感受性を高める可能性を示唆しています。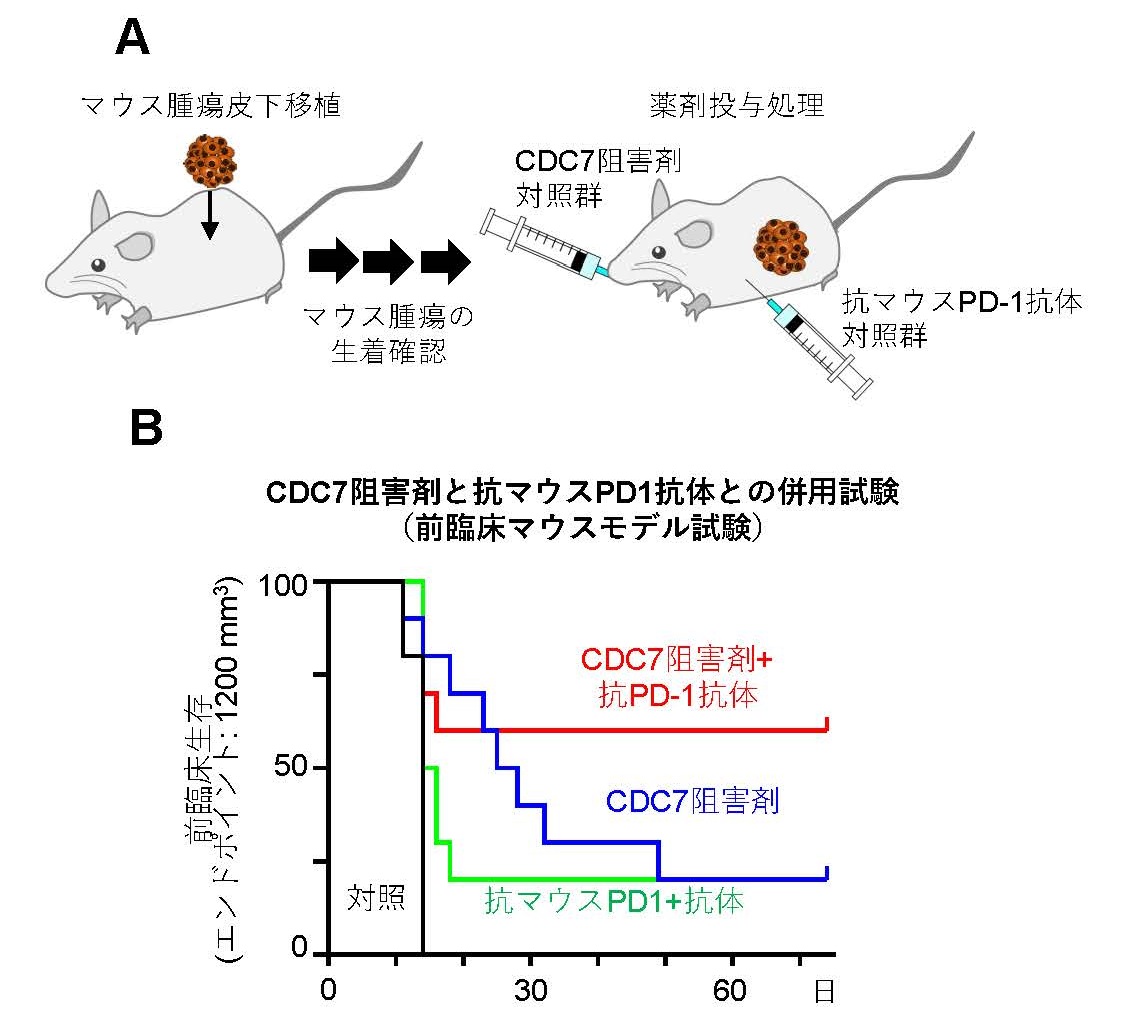
図4 マウスモデルを用いたICIとの非臨床併用薬効試験
A. ICIとの非臨床併用薬効試験の実験デザインB. 陰性対照剤投与、CDC7阻害剤TAK-931単剤投与、マウスICI(抗マウスPD-1抗体)単剤投与、併用投与の非臨床薬効試験データのサマリー
展望
科学技術の進歩とともに数多くの新薬が開発されてきましたが、未だ治療困難ながんが多く存在しています。このような治療困難ながんを克服するため、既存のがん治療薬とは異なる新しい作用機序を有する画期的新薬・治療法の開発が望まれています。本研究結果はDNA複製ストレスを治療標的とする新たながん治療法の確立につながることが期待されます。
発表論文
雑誌名
Nature communications
タイトル
CDC7 inhibition induces replication stress-mediated aneuploid cells with an inflammatory phenotype sensitizing tumors to immune checkpoint blockade.
著者
Tomoko Yamamori Morita1†, Jie Yu2†, Yukie Kashima1,3†, Ryo Kamata1, Gaku Yamamoto1, Tatsunori Minamide1,4, Chiaki Mashima1, Miyuki Yoshiya1, Yuta Sakae1, Toyohiro Yamauchi1,5, Yumi Hakozaki1, Shun-ichiro Kageyama6, Akito Nakamura2, Eric Lightcap2, Kosuke Tanaka1, Huifeng Niu7, Karuppiah Kannan8, and Akihiro Ohashi1,2,5,*
- Division of Translational Genomics, Exploratory Oncology Research & Clinical Trial Center, National Cancer Center
- Oncology Drug Discovery Unit, Takeda Development Center Americas (TDCA), Inc.
- Department of Computational Biology and Medical Sciences, Graduate School of Frontier Sciences, The University of Tokyo
- Department of Gastroenterology and Endoscopy, National Cancer Center Hospital East
- Department of Integrated Bioscience, Graduate School of Frontier Sciences, The University of Tokyo
- Department of Radiation Oncology, National Cancer Center Hospital East
- Oncology Translational Science., TDCA, Inc.
- Oncology Therapeutic Area Unit, TDCA, Inc.
†共同筆頭著者 *責任著者
DOI
10.1038/s41467-023-43274-3
掲載日
2023年11月18日
URL
https://doi.org/10.1038/s41467-023-43274-3(クリックすると外部サイトにリンクします)
研究費
- 日本学術振興会
科学研究費助成事業 基盤研究B
新規CDC7キナーゼ阻害剤TAK-931の併用療法開発に向けた橋渡し研究
用語解説
*1 DNA複製ストレス(RS)
薬剤処理などによってDNA複製が適切に行えない状態。
*2 染色体不安定性
染色体の分配異常が高頻度で起こり、その結果、染色体数や染色体構造の異常を引き起こすことです。
*3 CDC7キナーゼ
DNA複製やDNA損傷反応を制御する重要なセリン・スレオニンキナーゼ(セリン・スレオニン残基をリン酸化する酵素)。多くのがん細胞でCDC7遺伝子の発現上昇が確認されており、CDC7遺伝子の発現と予後との相関が示唆されています。
*4 TAK-931
CDC7キナーゼの酵素活性を選択的に阻害する低分子化合物。
*5 免疫チェックポイント阻害薬
T細胞の活性を抑制する免疫チェックポイントを阻害する薬剤。抗PD-1抗体、抗PD-L1抗体、抗CTLA抗体などがあります。
*6 免疫原生
抗原などの異物が体内で免疫応答を引き起こす能力。
*7 サイトカインやケモカイン
細胞から分泌される生理活性物質。免疫や炎症に関連した分子が多く標的細胞に様々な細胞応答を引き起こします。走化性サイトカインを特にケモカインと呼びます。
問い合わせ先
研究に関するお問い合わせ
国立研究開発法人 国立がん研究センター 先端医療開発センター
共通研究開発分野 大橋 紹宏
電話番号:04-7133-1111 (内線91484)
Eメール:aohashi●east.ncc.go.jp
広報窓口
国立研究開発法人 国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
