SMARCB1遺伝子欠損型の小児・AYA世代のがんに有望な治療標的と阻害剤を発見新たに開発した網羅的な創薬標的探索方法により難治性がんの治療開発の加速が期待
2024年6月26日
国立研究開発法人国立がん研究センター
発表のポイント
- 小児・AYA世代に好発する希少がんであるラブドイド腫瘍や類上皮肉腫など遺伝子欠損異常があるがんの治療標的として有望な2つのタンパク質を発見し、これらを1つの阻害剤で同時に抑制することで、細胞株モデルでの実験結果から既存薬よりも高い有効性が期待できることが明らかになりました。
- これらの研究成果は、研究グループが新たに考案した、タンパク質構造の類似性から1つの阻害剤で2つの標的を同時に抑制できるという創薬標的探索法“パラログ同時阻害法“を用いています。
- SMARCB1遺伝子が欠損しているがんでは、細胞死(アポトーシス)を抑制する遺伝子が特異的に発現することでがん細胞が有利に増殖できるようになりますが、今回発見した治療標的を1つの阻害剤で同時に抑制することによってアポトーシスが促進される機序を解明しました。
- 今後“パラログ同時阻害法“の改良を重ね、より大規模な創薬標的探索基盤を構築することで、治療法の確立されていない難治性がんの治療標的の探索や治療開発が加速することが期待されます。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)研究所(所長:間野 博行)がん治療学研究分野の荻原 秀明分野長、佐々木 麻里子研究員を中心とする共同研究グループは、ラブドイド腫瘍や類上皮肉腫などに特徴的なSMARCB1欠損型遺伝子異常のあるがんに対して、CBPとp300という2つのタンパク質を新たな治療標的とし、1剤で同時に阻害することが有望であることを発見しました。従来は、2つの因子を阻害するには、それぞれの阻害剤を併用する必要がありましたが、本研究では、新たに考案した”パラログ同時阻害法“を用いることで、CBPとp300を治療標的として同定し、またCBPとp300が類似した構造のタンパク質同士(パラログ)であることを利用し1剤で同時に抑制することを可能としました。また、本研究で発見したCBP/p300の同時阻害剤は、これまでにSMARCB1欠損型類上皮肉腫の治療薬として米国で承認され、国内でも医師主導治験が行われているEZH2阻害薬よりも高い有効性を期待できることが細胞株モデルでの実験結果で得られました。
“パラログ同時阻害法“の改良を重ね、より大規模な創薬標的探索基盤を構築することで、治療法の確立されていない遺伝子欠損型の遺伝子異常を持つ小児・AYA世代のがんや希少がんなどの難治性がんの治療標的の探索や治療開発が加速することが期待されます。
本研究の成果は、2024年6月5日付で英国科学誌「Nature Communications」に掲載されました。
本研究は、住友ファーマ株式会社リサーチディビジョンがん創薬研究ユニットの大坪 嗣輝研究員、加藤 大輝研究員、村上 果林研究員、国立がん研究センター中央病院病理診断科の吉田 裕医員、国立がん研究センター研究所がん治療学研究分野の高瀬 翔平研究員らによる共同研究です。
背景
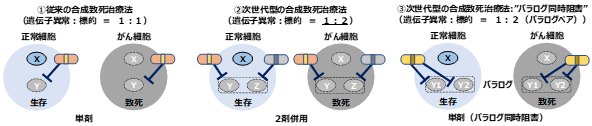
ラブドイド腫瘍注1や類上皮肉腫注2は日本における小児がんやAYA世代(Adolescent&Young Adult(思春期・若年成人)の略)のがんの中でも希少ながんであり、予後の悪いがんです。これらのがんは遺伝子の発現を制御するタンパク質に関与するSMARCB1遺伝子に欠損型の異常が原因となっています。ラブドイド腫瘍や類上皮肉腫のような欠損型遺伝子異常をもつがんには、合成致死性を利用したがん治療法(合成致死治療法)が有望です。合成致死性とは、細胞内に2つの遺伝子がある場合に、片方の遺伝子のみが抑制された場合には細胞は死なないが、2つの遺伝子が両方とも抑制された場合に細胞が死滅する現象です。従来の阻害薬の開発は1つの遺伝子異常に対して1つの標的を1つの阻害薬で治療することが一般的ですが(図1-1)、1つの標的を探す研究方法は成熟した状況にありました。そこで、新しい標的を見つける方法として、1つではなく、2つの標的を同時に抑制する方法が考えられます(図1-2)。しかし、別々の標的を阻害する場合、それぞれに阻害剤の使用が必要となります。臨床開発の中で新しい2つの阻害剤による試験を検討する必要があるため、阻害剤併用による試験計画の煩雑性や副作用などの問題が生じやすいことが懸念されていました。
そこで研究チームは、標的とするタンパク質の構造的な相同性(パラログであること)を利用して2つのタンパク質を1つの阻害剤で同時に抑制する方法 “パラログ同時阻害法”注3を考案しました(図1-3)。
本研究では、SMARCB1欠損がんに有望な治療標的を見つけるために、SMARCB1欠損型のがん細胞では細胞死が起こるが、正常な細胞では細胞死が起こらない、すなわち、合成致死性を示すパラログペアとなる2つの標的タンパク質を探索しました。
図1. 従来型と次世代型の合成致死治療法
研究成果
SMARCB1欠損型遺伝子異常をもつがんに有望な合成致死標的として、CBPとp300のパラログペアを発見しました。CBP/p300阻害剤は、従来ラブドイド腫瘍や類上皮肉腫に使用されているEZH2阻害薬よりも高い有効性を示し、その作用機序も明らかにしました。図2.SMARCB1欠損がんにおけるCBP/p300の作用機序
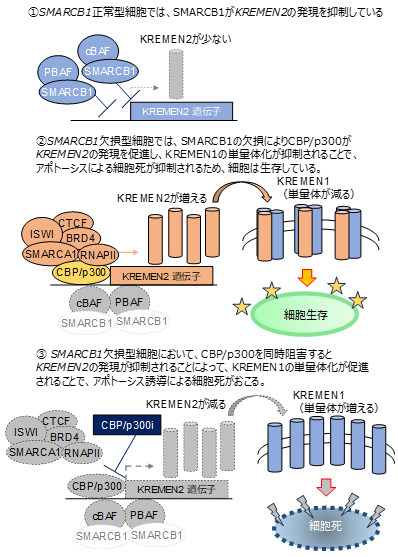
SMARCB1正常型細胞:SMARCB1は、KREMEN2遺伝子の転写制御領域でクロマチン構造を閉じた状態にすることで、KREMEN2遺伝子の発現を抑制しています。このとき、CBP/p300は、KREMEN2遺伝子の転写制御領域に局在することができません。そのため、SMARCB1正常型細胞で、CBP/p300を同時阻害しても細胞死が誘導されないと考えられました(図2-1)。
SMARCB1欠損型細胞:SMARCB1が欠損すると、KREMEN2遺伝子座の転写制御領域にCBP/p300が局在することでクロマチン構造が開かれることで、KREMEN2遺伝子の発現を促進します。このとき、KREMEN2は、KREMEN1の単量体化を防止することでアポトーシスを抑制するようになります(図2-2)。このとき、SMARCB1欠損型細胞は、CBP/p300およびKREMEN2の発現に依存した状態になっているため、CBP/p300を同時阻害すると、KREMEN2の発現が抑制されることで、KREMEN1の単量体化が起こります。このとき、アポトーシスの抑制が解除されて、結果としてアポトーシスによる細胞死が誘導されると考えられました(図2-3)。
研究成果の詳細
SMARCB1欠損型がんに有望な合成致死標的として、CBP/p300パラログペアを発見した
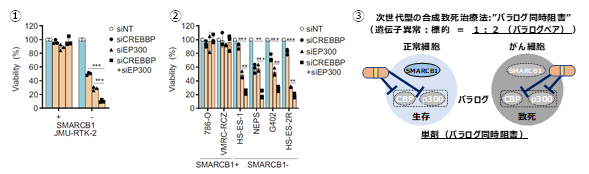
SMARCB1欠損型細胞株モデルを構築し、クロマチン制御遺伝子におけるパラログペアの2つの遺伝子を同時に抑制することで、SMARCB1欠損型細胞では致死となるが、SMARCB1正常型細胞では生存に影響がない、すなわち、合成致死性を示すパラログペア遺伝子を探索しました。その結果として、ヒストンアセチル化酵素をコードするCBP(CREBBP)とp300(EP300)のパラログペア遺伝子を同定しました。SMARCB1欠損型細胞において、CBPあるいはp300を単独で抑制すると、部分的に増殖が抑制されますが、CBPとp300を同時に阻害すると致死性を示すことを発見しました(図3-1,2,3)。図3.CBP/p300パラログペアの同時阻害による合成致死性
CBP/p300阻害剤は、SMARCB1欠損型がん細胞に高い有効性を示す
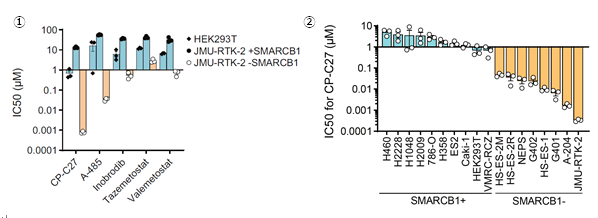
既存のCBP/p300阻害剤CP-C27を用いて、阻害剤によるSMARCB1欠損型細胞への有効性を確認するために、薬剤感受性試験を検討しました。その結果、SMARCB1欠損型細胞は、SMARCB1正常型細胞に比べて、100倍以上選択性が高い(IC50が低い)ことがわかりました(図4-1,2)。さらに、CBP/p300阻害剤は、SMARCB1欠損型類上皮肉腫の既存薬よりも高い効果を示すことがわかりました(図4-1)。図4.CBP/p300パラログペアの同時阻害剤の薬剤感受性
合成致死性を決定づける下流因子としてKREMEN2遺伝子を発見した
SMARCB1は、SWI/SNFクロマチンリモデリング複合体として、様々な遺伝子の転写を促進したり、抑制したりする働きがあります。一方で、CBP/p300は、ヒストンアセチル化酵素であり、様々な遺伝子の転写を促進する働きがあります。そこで、SMARCB1欠損型細胞において、CBP/p300を同時に阻害すると、どのような作用機序で合成致死性になるかを検討しました。私たちは、網羅的遺伝子発現解析を用いて、SMARCB1の欠損によって発現が増加する遺伝子の中で、CBP/p300の阻害によってその発現が抑制される遺伝子を探索しました。その結果、KREMEN2遺伝子を同定しました(図5-1,2,3)。KREMEN2を抑制すると、SMARCB1正常型細胞では増殖抑制は起こりませんが、SMARCB1欠損型細胞では増殖抑制が起こる、すなわち、合成致死性を示すことがわかりました(図5-4)。また、SMARCB1欠損型細胞におけるCBP/p300同時阻害による細胞死が、KREMEN2遺伝子の発現を補うことで細胞死が回避される(図5-5)ことから、KREMEN2は合成致死性の決定因子であることがわかりました。図5.合成致死性の決定因子としてKREMEN2を同定
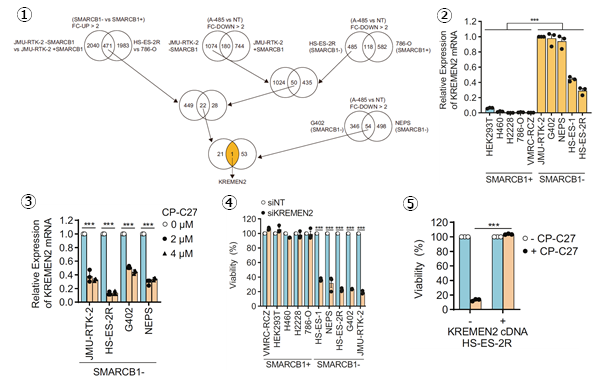
SMARCB1とCBP/p300によるKREMEN2の遺伝子発現制御の分子メカニズムを解明した
KREMEN2の遺伝子発現制御の分子メカニズムを明らかにするために、CUT&RUN-seqによるクロマチン局在解析やATAC-seqによるクロマチン構造解析などのクロマチン解析手法を用いて検討しました。SMARCB1はSWI/SNFクロマチンリモデリング複合体として、KREMEN2遺伝子座の転写制御領域に局在することで、KREMEN2遺伝子の転写を抑制していました(図6-1)。一方で、SMARCB1が欠損することによって、CBPとp300の両方がKREMEN2遺伝子座の転写制御領域に局在することで、KREMEN2遺伝子の転写が促進されることがわかりました(図6-2,3)。さらに、CBPとp300を同時阻害すると、KREMEN2遺伝子座の転写制御領域における転写因子の局在が抑制されることで、KREMEN2遺伝子の転写が抑制されることがわかりました(図6-4,5)。その結果として、合成致死性が誘導されると考えられました。図6.SMARCB1およびCBP/p300によるKREMEN2遺伝子の転写制御機構
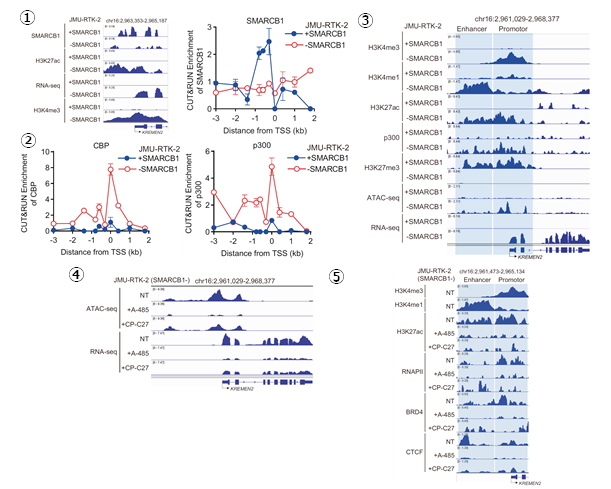
KREMEN2の抑制によって誘導される細胞死経路を特定した
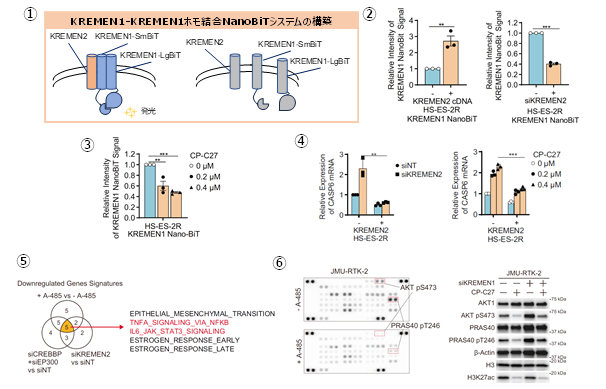
これまでの結果から、SMARCB1欠損型細胞において、CBP/p300を同時阻害したとき、KREMEN2の発現が抑制されることで、細胞死が誘導されることを明らかにしました。そこで、KREMEN2の発現抑制によって、どのような分子メカニズムによって細胞死が誘導されるかを検討しました。これまで、KREMEN2は膜タンパク質であり、KREMEN1という別の膜タンパク質と結合することと、KREMEN1タンパク同士が結合することが分かっていました。また、KREMEN2はアポトーシス抑制タンパク質であり、KREMEN1はアポトーシス促進タンパク質であることも分かっていました。しかし、KREMEN2とKREMEN1の相互作用とアポトーシスの制御機構は明らかになっていませんでした。そこで、タンパク質同士の相互作用(結合)を発光シグナルで定量的に検出する実験手法であるNanoBitシステム注4を応用してKREMEN1同士の結合を定量的かつ簡便に検出できるアッセイ系を構築しました(図7-1)。KREMEN2が増加するとKREMEN1同士の結合を促進することでアポトーシスが抑制されること、KREMEN2が減少(CBP/p300を同時阻害)するとKREMEN1が単量体化することでアポトーシスを促進することを明らかにしました(図7-2,3,4)。
さらに、SMARCB1欠損型細胞において、CBP/p300を同時阻害したときに、どのような分子経路を経てアポトーシスが誘導されるかを検討するために、CBP/p300の同時阻害およびKREMEN2の抑制で共通して変動する遺伝子とタンパク質について、網羅的遺伝子発現解析に基づいたGSEA(Gene Set Enrichment Analysis)解析およびリン酸化タンパク質抗体アレイ解析を行いました。これらの解析の結果、CBP/p300の同時阻害に伴うKREMEN2の発現抑制によって、IL6-JAK-STAT3経路、TNFα-NFκB経路、PI3K-AKT経路によるアポトーシス抑制が解除された結果として、アポトーシスが誘導されることを明らかにしました(図7-5,6)。
図7.SMARCB1欠損型細胞におけるCBP/p300の阻害に伴うKREMEN2の発現低下による細胞死経路の特定
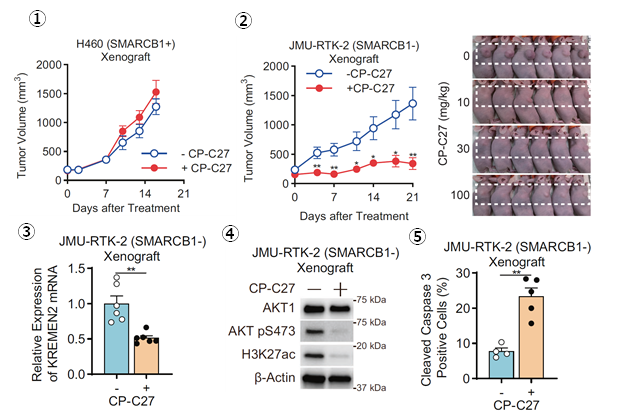
メカニズムに基づいたCBP/p300阻害剤の有望性を生体モデルで実証した
細胞株モデルを用いて明らかにしてきた以上の現象について、マウス移植腫瘍モデルにおける生体モデルで検証しました。CBP/p300の同時阻害剤の投与によって、SMARCB1正常型細胞由来のマウス移植腫瘍モデルでは、抗腫瘍効果を示しませんでした(図8-1)。一方で、SMARCB1欠損型細胞由来のマウス移植腫瘍モデルでは、抗腫瘍効果を示すことを明らかにしました(図8-2,3)。このとき、SMARCB1欠損型の腫瘍では、KREMEN2の発現抑制とともに、PI3K-AKT経路の抑制、アポトーシスの誘導が、生体モデルでも確認することができました(図8-4,5,6)。図8.マウス移植腫瘍モデルにおけるCBP/p300同時阻害剤投与による抗腫瘍効果の検討
展望
企業と共同して、CBP/p300の同時阻害剤の創薬開発を進め、臨床試験の実施を目指すともに、最終的にはラブドイド腫瘍、類上皮肉腫などのSMARCB1欠損型の小児がん、AYA世代のがんの治療へ貢献できるように研究を進めていきたいと考えています。また、SMARCB1とは別の因子の遺伝子欠損が肺がんなどの難治性がんで高頻度に見つかっています。このようながんに対してもCBP/p300の同時阻害剤が有望であるかについての研究も進めています。本研究では、新たに考案した“パラログ同時阻害法”によって、有望な創薬標的を発見することができました。本研究では、対象とするパラログペア遺伝子の数を限定して標的探索を行いましたが、現在、対象とするパラログペア遺伝子の数を拡大して、大規模に創薬標的を探索できる方法を構築しています。今後、小児がん、AYA世代のがんなどの希少がんだけでなく、治療法が確立されていない難治性がんにおいて、欠損型遺伝子異常をもつがんに有望な治療法の開発につなげていく研究を進めていきます。
論文情報
雑誌名
Nature Communications
タイトル
Targeting dependency on a paralog pair of CBP/p300 against de-repression of KREMEN2 in SMARCB1-deficient cancers
著者
佐々木 麻里子、加藤 大輝、村上 果林、吉田 裕、高瀬 翔平、大坪 嗣輝、荻原 秀明
DOI
10.1038/s41467-024-49063-w
掲載日
2024年6月5日
URL
https://www.nature.com/articles/s41467-024-49063-w(外部サイトにリンクします)
研究費
- 国立研究開発法人日本医療研究開発機構
研究事業名:次世代がん医療創生研究事業
研究課題名:SMARCB1欠損がんにおける合成致死治療法の開発
研究代表者名:荻原 秀明 - 住友ファーマ株式会社
研究事業名:共同研究
研究課題名:クロマチン制御因子を標的とした新規治療法の開発
研究代表者名:荻原 秀明 - 独立行政法人日本学術振興会
研究事業名:科学研究費助成事業
研究課題名:複数因子の同時阻害による新規治療標的探索法の開発
研究代表者名:荻原 秀明
用語解説
注1 ラブドイド腫瘍
ラブドイド腫瘍は、腎臓や脳など発症し、進行が速く、治療が困難な難治性がんです。日本では年間15人ほどの1歳までの乳幼児がラブドイド腫瘍と診断されています。治療法としては、がんを切除する外科療法に加え、化学療法、放射線療法が行われますが、最適な治療法は確立されていません。注2 類上皮肉腫
類上皮肉腫は、悪性軟部肉腫の1種で、前腕から手の浅層などの上肢に発症するAYA世代に好発するがんです。日本では年間17人ほどのAYA世代が類上皮肉腫と診断されています。治療法としては、外科療法による完全切除が基本であり、切除不能の場合は、化学療法が行われますが、予後不良な疾患です。2020年に、EZH2阻害薬であるタゼメトスタットが類上皮肉腫の治療薬として米国で承認されました。注3 パラログ同時阻害法
パラログとは、類似した構造をもつタンパク質です。阻害剤が標的タンパク質を特異的に抑制するのは、阻害剤が標的タンパク質にあるポケットに収まることで標的タンパク質の機能を抑制するからです。しかし、パラログな構造を持つタンパク質は、そのポケットの構造も似ているため、1つの阻害剤でパラログタンパク質同士を同時に抑制することが可能になります。この性質を応用したのがパラログ同時阻害法です。つまり、パラログ同時阻害法とは、治療標的としてパラログタンパク質を対象とすることで、1つの阻害剤で2つのタンパク質を同時に抑制するがん治療法です。注4 NanoBiTシステム
タンパク質同士の相互作用(結合)を発光シグナルで定量的に検出する実験手法です。相互作用を見たい2つのタンパク質に対して、一方にはSmBiTタグ、もう片方にはLgBiTタグを融合させたタンパク質を細胞内で発現させます。2つのタンパク質が結合すると、SmBiT、LgBiTが結合することができるようになり、ルシフェラーゼ活性をもつようになる。このときNanoBiT試薬で処理すると発光する仕組みです。お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター研究所 がん治療学研究分野 荻原 秀明
電話番号:03-3547-2511(代表)
Eメール:hogiwara●ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター企画戦略局 広報企画室
電話番号:03-3547-2511(代表)
Eメール:ncc-admin●ncc.go.jp
