RNAを修飾する遺伝子CMTR2の変異の意義を解明免疫チェックポイント阻害薬、RNAスプライシング阻害剤への感受性が高い可能性を確認
2025年11月14日
国立研究開発法人国立がん研究センター
慶應義塾大学
国立大学法人東北大学
発表のポイント
- RNAのスプライシング機構にミスが起こると、間違ったタンパク質ができ、がんの原因となることが知られています。
- 今回、研究グループは、CMTR2遺伝子変異によりRNAスプライシングの編集ミスが起きやすくなることを発見しました。
- さらに、CMTR2に変異があるがん細胞は、RNAスプライシング機構を抑制する化合物(例:RNAスプライシング阻害剤)や、免疫チェックポイント阻害薬に高い感受性を示すことがマウスを用いた実験により明らかになりました。
- 本研究成果により、CMTR2遺伝子変異の有無によって、これらの治療効果を予測する可能性が示されました。今後、肺がん患者さんの検体や臨床経過等を分析して、さらなる検証が求められます。
- また、CMTR2遺伝子変異と関連したRNAスプライシング機構を標的とした治療薬の開発にもつながることが期待されます。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:間野 博行)研究所 ゲノム生物学研究分野 中奥 敬史ユニット長、河野 隆志分野長、慶應義塾大学医学部内科学(呼吸器) 額賀 重成助教らの研究グループは、1,000例を超える肺がん試料を解析し、CMTR2注1という遺伝子に変異があると、メッセンジャーRNA(タンパク質の設計図)の編集過程であるRNAスプライシング注2にミスが起きやすくなることを明らかにしました。
さらに、CMTR2に変異があるがん細胞は、スプライシングを調節してがんを攻撃する化合物(スプライシング阻害剤注3)と免疫のブレーキを外してがんを攻撃しやすくする薬(免疫チェックポイント阻害薬注4)に高い感受性を示すことも分かりました。今回の成果は、「RNAスプライシング機構の異常」が遺伝子変異の多様性や薬剤耐性のため、治療が難しい疾患とされている肺がんの新しい治療標的になり得ることを示したもので、今後のがんゲノム医療への応用が期待されます。
本研究成果は、2025年11月6日付で、国際学術誌「Nature Communications」に掲載されました。
背景
私たちの体は、遺伝情報が書かれた「DNA」に基づいて作られる「タンパク質」によって成り立っています。タンパク質をつくるため、細胞の中ではDNAの情報を転写した「RNA」が合成され、さらに中間物質である「メッセンジャーRNA」が作られます(図1)。メッセンジャーRNAはRNAの先端に「キャップ(帽子)」をつけ、タンパク質合成に必要な情報だけをつなぎ合わせる「RNAスプライシング」という編集過程を経て完成します。CMTR2遺伝子は、このキャップ構造を安定化させるためのCap2修飾を行う酵素の遺伝子としてこれまで理解されてきました。
近年、白血病などの血液がんでは、特定の遺伝子の変異に伴い「RNAスプライシング」にミスが生じ、がん化を促すことがわかってきました。これを「RNAスプライシング機構の異常」と呼びます。 しかし、肺がんなどの固形がんにおいては、どのようなメカニズムでRNAスプライシング機構の異常が引き起こされるのか、わかっていませんでした。
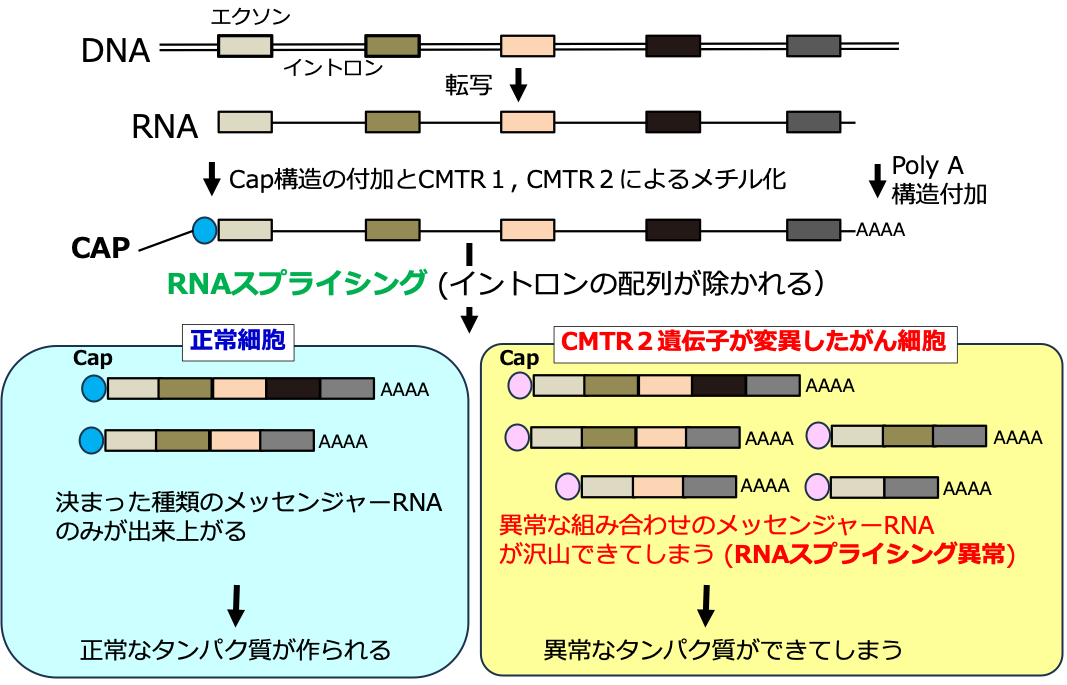
図1 RNAスプライシングとCMTR2遺伝子の変異
メッセンジャーRNAは、不要な部分の情報(イントロン)を除き、タンパク質合成に必要な情報(エクソン)をつなぎ合わせる「RNAスプライシング」によってつくられます。CMTR2タンパク質は、CAP構造にメチル化注5を行うRNA修飾酵素です。
研究成果
1. 肺がんにおけるCMTR2遺伝子変異を発見
本研究グループは、国立がん研究センター中央病院で手術により摘出された1,000例を超える肺がんのDNAとRNAの配列情報を調べました。その結果、全体の3.8%でCMTR2遺伝子に変異があり、CMTR2変異のある肺がんは他とは異なるRNAスプライシングのパターンを持つことが分かりました(図2)。今回見つかったCMTR2遺伝子変異の大部分は、遺伝子の機能を失わせるタイプ(短縮型変異)であり、喫煙歴のある肺腺がんの患者さんにより多く見られました。更なる調査の結果、CMTR2変異を持つがんでは、様々な遺伝子のRNAスプライシングに異常が起きていることが分かりました。
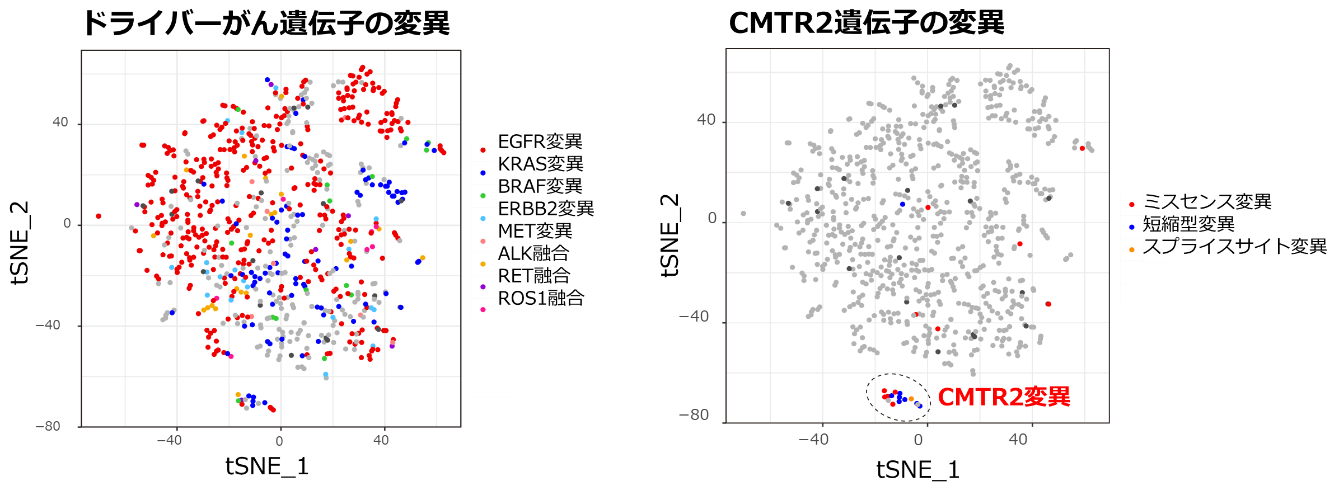
図2 RNAスプライシングパターンによる肺腺がんのグルーピング
肺腺がんのRNAスプライシングのパターンを数値化し、tSNEという次元圧縮法により、可視化しました。RNAスプライシングのパターンが似ているがん同士は近くに集まって見えます。肺がん症例は、がん化に関わるドライバーがん遺伝子の変異とは独立に、CMTR2遺伝子変異を持つものがお互いに似たRNAスプライシングパターンを示しています。
2. CMTR2変異がRNAスプライシングの広範な異常を引き起こすことを解明
CMTR2遺伝子は、メッセンジャーRNAの完成に先んじて、RNAに付加される“キャップ (Cap)”と呼ばれる保護構造に「メチル化」という化学修飾を行います。しかしながら、CMTR2遺伝子とRNAスプライシング異常の関係は知られていませんでした。
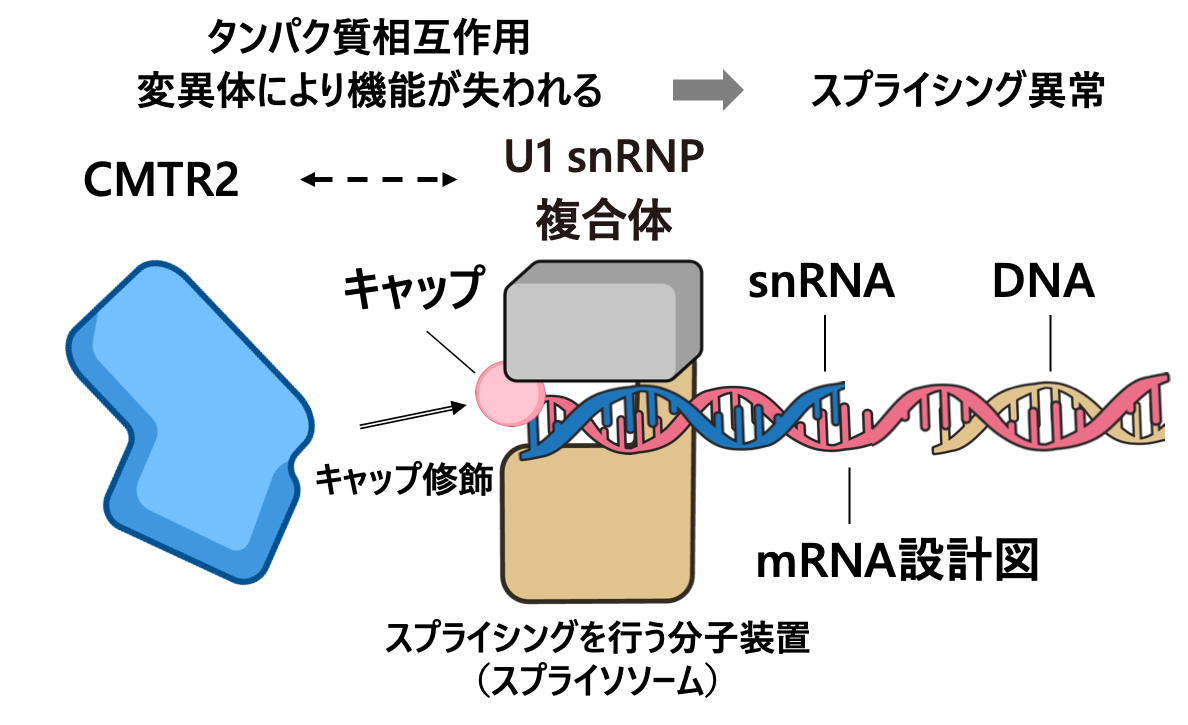
ゲノム編集技術を用いて、人工的にCMTR2遺伝子を破壊したところ、患者さんのがんで見られたように、スプライシング異常が生じました。精製タンパク質を用いた結合実験により、CMTR2タンパク質がスプライシングを行う分子装置(スプライソソーム)注6と相互作用する一方、変異したCMTR2タンパク質では、この相互作用が失われていました。この相互作用の破綻により、広範なスプライシング異常が生じると考えられました(図3)。
図3 CMTR2タンパク質がRNAスプライシングを制御する仕組み
3. CMTR2変異がもたらす「がん細胞の弱点(脆弱性)」の特定
本研究グループは、CMTR2変異により引き起こされるRNAスプライシング機構の異常が、がん細胞にとって治療が効きやすい「弱点」になると考えました。マウスを用いた実験の結果、CMTR2変異を持つがん細胞は、以下の2種類の薬剤・化合物に対して高い感受性を示すことを明らかにしました。
- RNAスプライシング阻害剤:
異常なRNAスプライシング機構の異常を誘導することでがん細胞を攻撃する化合物です。マウスの実験や患者さん由来の培養がん細胞の実験で、CMTR2変異がん細胞は、RNAスプライシング阻害剤であるインディシュラムにより、効率よく増殖が抑制されることが分かりました(図4A-B)。もともとRNAスプライシング異常を起こしているCMTR2変異がん細胞は、RNAスプライシング阻害剤によるさらなる異常なRNAスプライシングの誘導に耐えられないからであると推察されます。
- 免疫チェックポイント阻害薬:
免疫細胞が持つがん細胞の攻撃力を強める治療薬です。マウスの実験で、CMTR2変異がん細胞に対しては、抗PD-1抗体による治療効果が高いことを確認しました(図4A)。さらに、患者さんの臨床データを解析したところ、CMTR2遺伝子に変異のある肺がんの患者さんでは、免疫チェックポイント阻害薬ペンブロリズマブにより、治療開始前と比較し、約60%の腫瘍の縮小がみられていました(図4C)。RNAスプライシング機構の異常を起こしているCMTR2変異がん細胞は、免疫細胞の攻撃を受けやすくなっていると推察されます。
このように、CMTR2変異を持つがん細胞は、スプライシング阻害剤と免疫チェックポイント阻害薬に対して高い腫瘍縮小効果を認め(図4A-C)、新たな治療標的となることを見出しました。
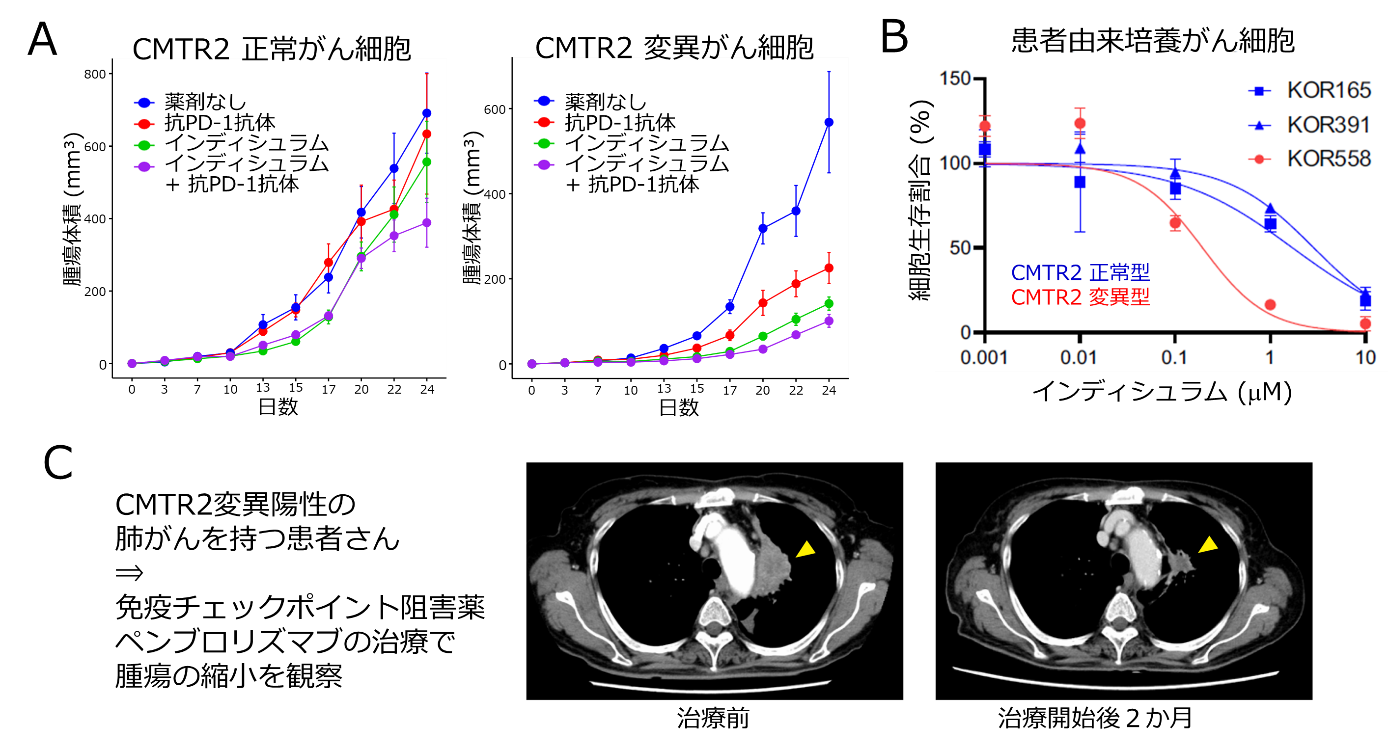
図4 CMTR2変異を持つがん細胞における腫瘍の縮小効果
A. マウスの移植腫瘍の実験(各治療グループ10匹)で、CMTR2変異がん細胞において、RNAスプライシング阻害剤(インディシュラム)、免疫チェックポイント阻害薬(抗PD-1抗体)に対し、腫瘍の縮小効果が統計上有意にみられました。
B. 肺がん患者さんから樹立された培養肺がん細胞の実験(4回の独立した実験)で、CMTR2変異がん(KOR558)は、野生型のがん(KOR165およびKOR391)に比べ、RNAスプライシング阻害剤(インディシュラム)に高い感受性を示しました。
C. CMTR2変異のある肺がんの患者さんでは、免疫チェックポイント阻害薬ペンブロリズマブにより、腫瘍縮小効果がみられました。
展望
本研究では、肺がんにおいてメッセンジャーRNAが作られる過程の異常とがんを結びつける、全く新しい仕組みを世界で初めて解き明かしました。この成果により、今後は、肺がん患者さんの手術や検査で得られた組織から「CMTR2遺伝子」を調べることで、「スプライシング阻害剤」や「免疫チェックポイント阻害薬」の治療効果を、治療開始前に精度よく予測できる可能性があります。さらに、CMTR2遺伝子の異常が引き起こすRNAのスプライシング機構の異常は、がん細胞にとってのアキレス腱(脆弱性)でもあるため、この弱点を標的とした、さらに効果的な治療薬の開発にもつながることが期待されます。本研究グループは、今回の成果をもとに、がんゲノム医療での新たな診断・治療法の確立を目指してまいります。
研究支援
本研究は、 国立研究開発法人日本医療研究開発機構(AMED)(JP24ck0106905 「新規RNAスプライシング遺伝子の失活変異を基盤とした肺がん最適治療法の開発」, JP23ak0101205 「大規模がんゲノム情報に基づく異常スプライシングに対する新たな創薬標的の開発」, JP24ama221233 「肺がんにおけるRNA多様性とゲノム異常の統合解析に基づく新規治療法の開発」) 、科学研究費助成事業(KAKENHI)(22KJ3158 「大規模がんゲノム解析から得られる共存する遺伝子異常の機能解明と治療応用への展開」, 25K02539 「がん免疫療法に対する応答性決定因子としてのRNAプロセッシング異常の解析」, 20H00545 「上皮内肺がん等の全ゲノムシークエンス解析による新規ドライバー遺伝子の同定」) 、科学技術振興機構(JST)CREST (JPMJCR1689) 「人工知能を用いた統合的ながん医療システムの開発」、科学技術振興機構(JST)AIP-PRISM (JPMJCR18Y4) 「人工知能技術を活用した革新的ながん創薬システムの開発」、文部科学省 スーパーコンピュータ「富岳」成果創出加速プログラム (JPMXP1020230120)、公益財団法人MSD生命科学財団、公益財団法人高松宮妃癌研究基金、SGHがん研究助成 などの支援を受け行われました。また、今回の研究は、国立がん研究センターバイオバンクの試料を用いた研究です。試料の提供を頂きました患者さんに深く感謝いたします。
発表論文
雑誌名
Nature Communications
タイトル
Mutation of CMTR2 in Lung Adenocarcinoma Alters RNA Alternative Splicing and Reveals Therapeutic Vulnerabilities
掲載日
2025年11月6日
DOI
10.1038/s41467-025-64821-0
URL
https://www.nature.com/articles/s41467-025-64821-0(外部サイトにリンクします)
発表者
国立研究開発法人国立がん研究センター
額賀 重成 (Shigenari Nukaga、筆頭著者) 、白石 航也 (Kouya Shiraishi) 、望月 亮史 (Akifumi Mochizuki) 、浜口 悠 (Yu Hamaguchi) 、小川 衣未 (Emi Ogawa) 、Nguyen Thai Le 、島田 陽子 (Yoko Shimada) 、小野 華子 (Hanako Ono) 、西中村 瞳 (Hitomi Nishinakamura) 、小林 祥久 (Yoshihisa Kobayashi) 、遠藤 智 (Satoshi Endo) 、宮腰 純 (Jun Miyakoshi) 、白石 友一 (Yuichi Shiraishi) 、吉田 達哉 (Tatsuya Yoshida) 、後藤 悌 (Yasushi Goto) 、大江 裕一郎 (Yuichiro Ohe) 、渡辺 俊一 (Shun-Ichi Watanabe) 、谷田部 恭 (Yasushi Yatabe) 、西川 博嘉 (Hiroyoshi Nishikawa) 、浜本 隆二 (Ryuji Hamamoto) 、河野 隆志 (Takashi Kohno、共責任著者)、中奥 敬史 (Takashi Nakaoku、責任著者)
慶應義塾大学医学部
額賀 重成 (Shigenari Nukaga、筆頭著者) 、濱邉 健多 (Kenta Hamabe) 、浜本 純子 (Junko Hamamoto) 、扇野 圭子 (Keiko Ohgino) 、安田 浩之 (Hiroyuki Yasuda)
京都大学大学院医学研究科
荒木 望嗣 (Mitsugu Araki) 、寒河江 由香里 (Yukari Sagae) 、奥野 恭史 (Yasushi Okuno)
東北大学加齢医学研究所
宇井 彩子 (Ayako Ui)
川崎市立川崎病院
杉原 快 (Kai Sugihara)
用語解説
注1:CMTR2遺伝子
CMTR2は「Cap-specific mRNA (nucleoside-2'-O-)-methyltransferase 2」の略称で、RNAの保護と機能調節に重要な役割を果たす酵素を作る遺伝子です。メッセンジャーRNAは作られた後、すぐに分解されないように「キャップ」と呼ばれる保護構造が付加されます。CMTR2遺伝子は、このキャップ構造をさらに安定化させるための化学修飾(Cap2修飾)を行う酵素の遺伝子です。本研究により、肺がんやメラノーマなどにCMTR2遺伝子に変異が生じており、この酵素が変異によって正常に働かなくなることで、RNAスプライシング機構が大きく崩れることが初めて明らかになりました。
注2:RNAスプライシング
私たちの体は、DNAの情報をもとに、メッセンジャーRNA(mRNA)という設計図を作り、その指示でタンパク質を作ります。この下書きとなるRNAには、タンパク質を作るのに不要な部分(イントロン)を含むため、必要な部分(エクソン)だけをつなぐ編集作業が必要です。この作業がRNAスプライシングです。RNAスプライシングが乱れると、余計な部分が残る/必要な部分が抜けるなどの不具合が起き、異常なタンパク質が作られて、がんの性質(増殖しやすさ、薬の効き方など)に影響します。
注3:RNAスプライシング阻害剤
がん細胞の中には、RNAスプライシング機構に異常を抱えているものがあります。そのようながん細胞は、異常を補うために、残された正常なスプライシング関連タンパク質に強く依存している状態にあります。スプライシング阻害剤は、その依存しているタンパク質(本研究ではRBM39タンパク質)を選択的に分解する働きを持ちます。これにより、元々RNAスプライシング機構に欠損を持つがん細胞だけをより効率的に死滅に追い込むことができます。
注4:免疫チェックポイント阻害薬
私たちの体には、免疫細胞が正常な細胞を誤って攻撃しないように、「ブレーキ」をかける仕組み(免疫チェックポイント)が備わっています。がん細胞は、このブレーキの仕組みを利用して免疫細胞からの攻撃を回避し、体内で生き延びます。免疫チェックポイント阻害薬は、がん細胞がかけているこの免疫のブレーキを解除し、自身が持つ免疫の力で、がん細胞を再び攻撃できるようにする治療薬です。本研究でCMTR2変異を持つがんは、異常なRNAスプライシング機構の結果として、免疫チェックポイント阻害薬への効果が高まっている可能性が考えられました。
注5:メチル化
遺伝情報(DNAやRNA)に、「メチル基」という小さな化学物質の修飾を付ける化学反応のことです。この修飾が付いたり外れたりすることで、遺伝子のスイッチがオンになったりオフになったりするなど、その遺伝子の働きが調節されます。CMTR2タンパク質は、RNAの「キャップ」にこの修飾を付ける専門の酵素です。
注6:分子装置(スプライソソーム)
注1のRNAスプライシングを実行する、細胞内の「分子複合体」の総称です。この装置はタンパク質とRNA(snRNA)でできており、RNAの不要な部分(イントロン)を正確に認識して切り取り、必要な部分(エクソン)を繋ぎ合わせます。本文中のU1 snRNPは、このスプライソソームを構成する重要な部品の一つです。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター研究所
ゲノム生物学研究分野 ユニット長 中奥 敬史(なかおく たかし)
TEL:03-3547-5201(内線3865)
E-mail:tnakaoku●ncc.go.jp
慶應義塾大学医学部 内科学(呼吸器)
助教 額賀 重成(ぬかが しげなり)
TEL:03-5363-3793
E-mail:shigenarism●keio.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
TEL:03-3542-2511(代表)
E-mail:ncc-admin●ncc.go.jp
慶應義塾大学信濃町キャンパス 総務課
TEL:03-5363-3611
E-mail:med-koho●adst.keio.ac.jp
国立大学法人東北大学
加齢医学研究所 広報情報室
TEL: 022-717-8443
E-mail:ida-pr-office●grp.tohoku.ac.jp
