胃がん・食道胃接合部腺がんに対する周術期治療としてのペムブロリズマブ+化学療法を検討したKEYNOTE-585試験の最終解析結果を報告
2025年8月21日
国立研究開発法人国立がん研究センター
発表のポイント
- 本研究では、局所進行切除可能な胃がん・食道胃接合部腺がん患者さんを対象に、周術期治療としてペムブロリズマブ+化学療法併用と化学療法単独が比較されました。
- 病理学的完全奏効割合はペムブロリズマブ群で有意に改善しました(13.4% vs 2.0%)。
- 無イベント生存期間と最終解析における全生存期間もペムブロリズマブ群で改善傾向を示しましたが、無イベント生存期間は統計学的な有意水準は満たさず、全生存期間については正式な両群の統計学的比較は実施されませんでした。
- 健康関連QOLの悪化は認められず、安全性も許容範囲内でした。
- 本研究は、周術期に免疫チェックポイント阻害薬を併用する新たな治療戦略の可能性を示した重要な国際共同第III相試験であり、胃がんに対する新たな周術期治療の可能性を比較試験において検討した意義が評価され、2025年8月19日(米国時間)に科学雑誌「Journal of Clinical Oncology」に掲載されました。
概要
国立研究開発法人国立がん研究センター(東京都中央区、理事長:間野 博行)東病院(千葉県柏市、病院長:土井 俊彦)設楽 紘平消化管内科長らの研究グループは、切除可能な局所進行胃がん・胃食道接合部腺がん(以下胃がん)に対し、周術期治療としてペムブロリズマブ注1+化学療法併用と化学療法単独(プラセボ+化学療法)を比較する国際共同第III相試験「KEYNOTE-585試験」を実施しました。その結果、二つの主要評価項目の一つである病理学的完全奏効割合注2において統計学的に有意な改善が認められましたが、もう一つの主要評価項目である無イベント生存期間注3については事前に設定された有意性の閾値を満たしませんでした。今回さらに最終解析として全生存期間を報告しました。
本研究は、周術期に免疫チェックポイント阻害薬を併用する新たな治療戦略の可能性を示した重要な国際共同第III相試験であり、胃がんに対する新たな周術期治療の可能性を比較試験において検討した意義が評価され、科学雑誌「Journal of Clinical Oncology」(米国時間2025年8月19日)に掲載されました。
背景
胃がんは依然として世界的に主要ながん死亡原因の一つであり、局所進行例でも術後再発リスクが高いことが知られています。
近年、化学療法に加えて免疫チェックポイント阻害薬の併用が転移性疾患において生存期間延長を示しており、局所進行例における周術期の免疫チェックポイント阻害薬の役割が注目されてきました。
KEYNOTE-585試験は、周術期(術前・術後)の化学療法においてペムブロリズマブを追加することの有効性・安全性を検証するために企画されました。
研究成果(方法・結果)
KEYNOTE-585試験では、2017年10月から2021年1月までの期間に、局所進行・切除可能な胃がん・食道胃接合部腺がん患者さん1007例が登録され、804例が主要コホート、203例がFLOTコホートに割り付けられました。主要コホートでは併用する化学療法として、3週毎投与のシスプラチン+カペシタビンまたはシスプラチン+5-FU併用レジメンが用いられ、ペムブロリズマブもしくはプラセボを術前・術後に併用しました。術前3サイクルと術後3サイクルの化学療法+ペムブロリズマブまたはプラセボが投与され、さらにペムブロリズマブまたはプラセボ単剤による術後治療を最大11サイクル実施しました。FLOTコホートにおいては、併用する化学療法としてFLOT レジメン(5-FU, ドセタキセル, オキサリプラチン)が使用されました。
主要評価項目には、病理学的完全奏効割合、無イベント生存期間、全生存期間が設定されました。また、患者報告アウトカムも探索的に評価されました。今回の最終報告時点では、主要評価対象である主要コホートの追跡期間中央値は59.9ヵ月(範囲39.0ヵ月~75.8ヵ月)でした。
病理学的完全奏効割合は、ペムブロリズマブ群で13.4%(54/402例)、プラセボ群で2.0%(8/402例)と、ペムブロリズマブ群で有意に高率でした(差 11.4%、95%信頼区間 8.0–15.3)。この効果は事前に設定されたサブグループにおいても概ね一貫して認められました。主要コホートおよびFLOTコホートを合わせた全体集団においても、病理学的完全奏効割合はそれぞれ14.2%対2.8%と同様の傾向を示しました。
無イベント生存期間に関しては、主要コホートにおいて、ペムブロリズマブ群の中央値は44.4ヵ月(95%信頼区間 33.0ヵ月–69.8ヵ月)、プラセボ群は25.7ヵ月(95%信頼区間 20.8ヵ月–36.5ヵ月)であり、ハザード比は0.81(95%信頼区間 0.67–0.98)でした(図1)。5年無イベント生存割合は、ペムブロリズマブ群47%、プラセボ群37%と、ペムブロリズマブ群で良好な傾向を示しました。全体集団でも、無イベント生存期間の傾向は同様でした。これらの結果は以前行われた主要解析時点での結果とほぼ一致していました (https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(23)00541-7/abstract(外部サイトにリンクします))。
図1. 無イベント生存割合の生存曲線
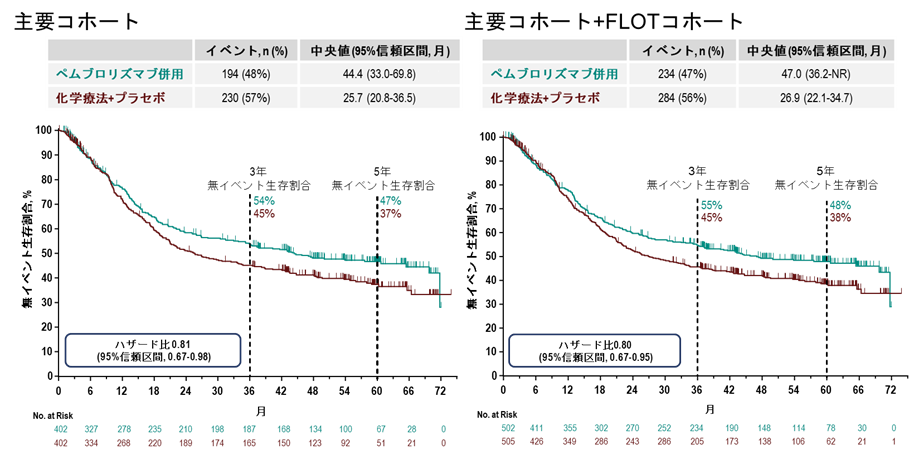
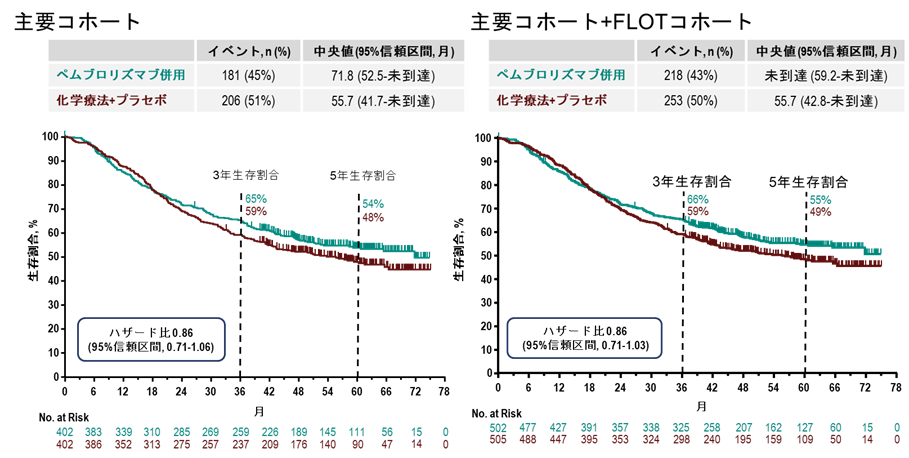
最終解析時点の全生存期間においては、主要コホートでのペムブロリズマブ群の中央値は71.8ヵ月(95%信頼区間 52.5ヵ月–未到達)、プラセボ群は55.7ヵ月(95%信頼区間 41.7ヵ月–未到達)でした(図2)。ハザード比は0.86(95%信頼区間 0.71–1.06)であり、5年生存率はペムブロリズマブ群54%、プラセボ群48%でした。ただし、無イベント生存期間が事前に設定された有意水準を満たさなかったため、全生存期間について正式な両群の統計学的比較は実施されませんでした。
図2. 全生存期間の生存曲線
サブグループ解析では、マイクロサテライト不安定性型注4やPD-L1 CPS注510以上の集団でより大きなペムブロリズマブの上乗せ効果が示唆されましたが、解釈には注意が必要です。
安全性については、治療関連グレード注63以上の有害事象はペムブロリズマブ群で65%、プラセボ群で63%に発現し、新たな安全性上の懸念は認められませんでした。主な治療関連有害事象には、好中球減少、食欲減退、下痢、貧血などが含まれ、頻度や重症度は両群で概ね類似していました。
また、患者報告アウトカムにおいては、治療期間中および治療後における健康関連QOLの変化に大きな差は認められず、ペムブロリズマブ追加による生活の質の悪化は示されませんでした。
また、別途探索的に比較されたアジア人集団(387例)と非アジア人集団(620例)においては、アジアにおける5年無イベント生存割合はペムブロリズマブ併用群54.1% vs プラセボ群45.6%, 非アジアにおいては37.7% vs 24.3%であり、両群ともにアジアにおける成績の方が良好でしたが、ペムブロリズマブ追加によるハザード比はそれぞれ0.81と0.79とほぼ同様でした。 全生存においても、アジアにおける5年生存割合は61.3% vs 57.4%, 非アジアにおいては50.5% vs 42.6%でありとアジアで良好な傾向でしたが、ペムブロリズマブ追加によるハザード比はそれぞれ0.87と0.85とほぼ同等でした(https://ascopubs.org/doi/10.1200/JCO.2025.43.16_suppl.4194(外部サイトにリンクします))。
展望
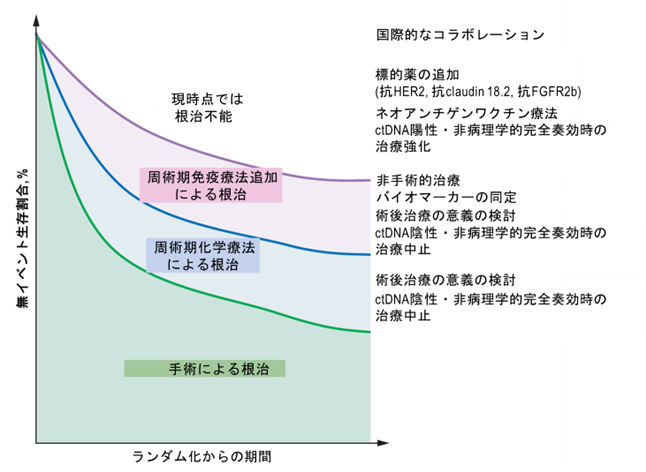
KEYNOTE-585試験は、ペムブロリズマブ併用による病理学的完全奏効割合の改善と、無イベント生存期間および全生存期間の延長傾向を示しました。しかし、無イベント生存期間は統計学的な有意水準には到達せず、また全生存期間の解析は探索的であり、今回の結果をもって標準治療が変更されるには至りませんでした。一方で、同様の局所進行切除可能な胃がん・食道胃接合部腺がん患者さんを対象として、周術期治療として抗PD-L1抗体であるデュルバルマブとFLOT療法の併用を検討した国際共同第III相試験「Matterhorn試験」においては、病理学的完全奏効割合に加えて無イベント生存期間も統計学的に有意な改善を認め、今後はFLOTとデュルバルマブの併用が全世界的な標準治療となることが期待されます(https://www.nejm.org/doi/abs/10.1056/NEJMoa2503701(外部サイトにリンクします))。さらには、図3に示すような、他の薬剤との併用や再発低リスク・高リスク集団を層別化した治療戦略の検討が望まれます (https://www.nejm.org/doi/full/10.1056/NEJMe2507207(外部サイトにリンクします))。
図3. 現在の治療による転帰と今後の検討課題
論文情報
雑誌名
Journal of Clinical Oncology
タイトル
Pembrolizumab Plus Chemotherapy Versus Chemotherapy as Perioperative Therapy in Locally Advanced Gastric and Gastroesophageal Junction Cancer: Final Analysis of the Randomized, Phase III KEYNOTE-585 Study
著者
Kohei Shitara, Sun Young Rha, Lucjan Wyrwicz, Takashi Oshima, Nina Karaseva, Mikhail Osipov, Hisateru Yasui, Hiroshi Yabusaki, Sergey Afanasyev, Young-Kyu Park, Salah Eddin Al-Batran, Takaki Yoshikawa, Patricio Yanez, Filippo Pietrantonio, Sara Lonardi, Xiao Fang, Yanfen Guan, Adriana Valderrama, Pierre Leconte, Pooja Bhagia, Yung-Jue Bang, on behalf of the KEYNOTE-585 Investigators
DOI
10.1200/JCO-25-00486
掲載日
2025年8月19日(米国時間)
URL
https://ascopubs.org/doi/10.1200/JCO-25-00486 (外部サイトにリンクします)
研究費
研究費名(支援先)
Merck・MSD株式会社
研究課題名
胃腺癌及び食道胃接合部腺癌患者を対象とした術前・術後補助療法としてMK-3475及び化学療法(XP 又はFP)とプラセボ及び化学療法(XP 又はFP)を比較する二重盲検無作為化第III相試験
研究代表者名
Merck・MSD株式会社、国立がん研究センター東病院 設楽紘平
用語解説
注1 ペムブロリズマブ
PD-1(Programmed death-1)を標的とするモノクローナル抗体であり免疫チェックポイント阻害薬の一つである。
注2 病理学的完全奏効割合
病理学的完全奏効とは手術標本において腫瘍細胞が検出されないことであり、病理学的完全奏効割合はその割合を示す。
注3 無イベント生存期間
予定された治療の中止、増悪、再発、または死亡までの期間。
注4 マイクロサテライト不安定性
DNAミスマッチ修復機構の欠損を示すバイオマーカーであり、負担制定の高い集団では、免疫チェックポイント阻害剤の効果が高いことが知られている。
注5 PD-L1 CPS(Combined Positive Score)
腫瘍細胞と免疫細胞におけるPD-L1発現を評価する指標であり、本スコアが高い方が免疫チェックポイント阻害剤の効果が高い傾向があることが知られている。
注6 グレード
副作用はCTCAE(Common Terminology Criteria for Adverse Events)の規準に従って判断される。これは、がん治療や薬剤使用による有害事象の重症度を評価するための国際的に用いられる基準である。グレード1から5までの5段階で分類され、グレードが高いほど重症度が高いことを示す。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター東病院
消化管内科 設楽 紘平
電話番号:04-7133-1111(代表)
Eメール:kshitara●east.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表)
Eメール:ncc-admin●ncc.go.jp
