希少がんの研究開発・ゲノム医療を産学共同で推進する中央病院「MASTER KEYプロジェクト」への患者登録数 固形がん・血液がん合わせて5,000例を突破
ポイント
- 中央病院が中心となって行う希少がんの産学共同プロジェクト「MASTER KEYプロジェクト」の国内登録数が、固形がん・血液がん合わせて5,000例を突破しました。
- 2025年度現在、当院を含め全国11施設、13の製薬企業が参画しており、プロジェクトの取り組みにより5つの薬事承認・申請(承認3件、申請2件)に結びつく成果を生み出しました。
- 「MASTER KEY プロジェクト」では、希少がんに対する治験の増加に寄与し、治験の成果に基づく薬事承認の件数が増えることを目標とし、プロジェクトの進展に引き続き注力してまいります。
概要
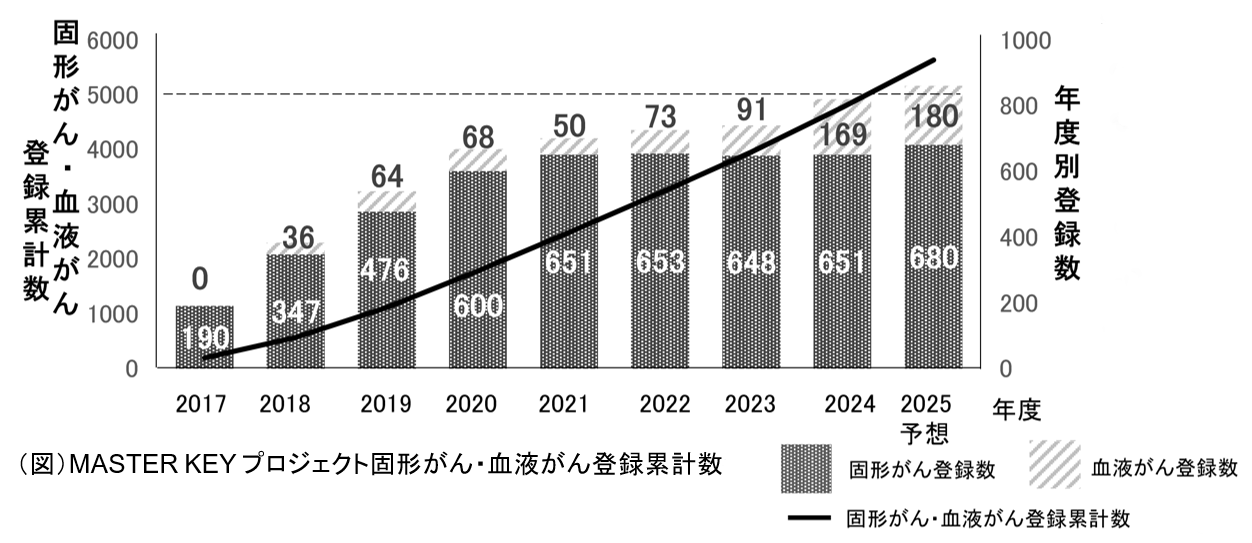
国立研究開発法人国立がん研究センター(所在地:東京都中央区、理事長:間野 博行)中央病院(病院長:瀬戸 泰之)が2017年から開始している希少がんの産学共同プロジェクト「MASTER KEYプロジェクト」では、希少がんの研究や企業治験、医師主導治験を推進するため、希少がん患者さんの遺伝子情報と治療の詳細、予後など臨床情報のデータベースを構築しており、このたび国内患者さんの登録が、固形がん・血液がん合わせて5,000例を突破し、大規模な希少がんデータベースとなりました(図)。
今後も「MASTER KEYプロジェクト」は、一般社団法人日本希少がん患者会ネットワークと連携し希少がん患者さんへのご協力をお願いするとともに、より強固な希少がん治療開発ネットワークへと発展を続け、ゲノム医療の推進、希少がんの新規治療開発の推進に取り組んでまいります。
注:薬事承認・申請の例
- BRAF V600E遺伝子変異陽性固形腫瘍に対するダブラフェニブ・トラメチニブ併用療法ががん種横断的治療薬として日本で薬事承認(ROAR試験)
- 悪性中皮腫(悪性胸膜中皮腫を除く)に対する治療薬としてニボルマブが日本で薬事承認(VIOLA試験)
- 胞巣状軟部肉腫に対する国内初の免疫チェックポイント阻害薬アテゾリズマブが日本で薬事承認(NCCH1907:ALBERT試験)
- 再発/治療抵抗性節外性NK/T細胞リンパ腫-鼻型に対するアテゾリズマブの第II相医師主導治験(NCCH1903:ATTACK試験)成績に基づく適応拡大申請
- 切除不能な進行又は再発のALK遺伝子異常を有する希少がんを対象にアレセンサの有効性と安全性を評価する医師主導の国内第II相臨床試験(NCCH1712:TACKLE試験)の成績に基づく適応拡大申請
プロジェクト開始以来、これまでに実施してきた治験の数は36件に達しました。
これまで行われた治験および現在実施中の治験に関する情報は、こちらをご覧ください。
https://www.ncc.go.jp/jp/ncch/masterkeyproject/substudy/index.html
コメント
日本希少がん患者会ネットワーク 理事長 大西 啓之

MASTER KEY プロジェクト5000例突破、おめでとうございます。
希少がんは種類が多く、それぞれの症例数は少ないため、医薬品の研究開発がなかなか進まず、患者・家族は、適切な治療法にたどり着くことが厳しい状況の中、私たちが発足時から取り組んだのが、本プロジェクトでした。
希少がん患者さんのデータベースを蓄積するだけでなく、個別のバイオマーカーの結果に応じて治験が紹介される機会を得られるということで大いに期待いたしました。その後、参加企業が増え治験数も増加し、さらに地方の患者さんも等しく受けられるよう実施医療機関も増え、大いに希望が持てるようになりました。今後もこの世界に誇れるプロジェクトに期待しています。
国立がん研究センター中央病院 研究担当副院長/ 先端医療科科長
/ 臨床研究支援部門長 MASTER KEYプロジェクト 研究代表者 山本 昇

当院の「MASTER KEYプロジェクト」で、登録症例が5,000例を突破することができました。本プロジェクトにご協力くださった希少がん患者さんをはじめ、参画された各施設の研究者ならびに関係各位に心より御礼申し上げます。希少がんの全貌把握および治療法の開発において、一定規模の症例集積は不可欠であり、本プロジェクト関係各位の不断の努力は、日本における希少がん研究の中核的基盤を形成してきたと高く評価されるものと思います。今後は、蓄積された知見に基づく分子プロファイル指向型の治療戦略の構築や、国際共同研究を更に発展させ、希少がん領域における革新的成果の創出を目指してまいります。
今後の展望
「MASTER KEYプロジェクト」では、希少がんに対する治験の増加に寄与し、治験の成果に基づく薬事承認・申請の件数が増えることを目標とし、プロジェクトの進展に引き続き注力してまいります。
今後も希少がんの患者さんにより早く、より多くの新薬を届けることを目指し、アジア・太平洋地域に拡大した「MASTER KEY Asia」とともに、日本およびアジアにおける希少がんにおけるゲノム医療の推進、希少がんの新規治療開発の推進に取り組んでまいります。
「MASTER KEYプロジェクト」について

希少がんは、一つ一つのがんの患者数が少なく臨床試験もあまり行われてこなかったため、標準治療が十分に確立されておらず、患者さんにとっては新しい薬を受けられる機会が限られていることが問題となってきました。
2017年から開始した「MASTER KEYプロジェクト」は、この喫緊の課題に国立がん研究センターと製薬企業が共同で取り組み、希少がんの患者さんに、より早く、より多くの新薬を届けることを目指しています。また、希少がん患者さんの登録においては、2018年8月に国立がん研究センターと連携協定を締結している一般社団法人日本希少がん患者会ネットワークとの連携により、多くの患者さんにご協力いただくことができました。
MASTER KEYプロジェクトでは、遺伝子情報や診療情報、予後データなどを網羅的に収集し、希少がんにおける日本最大のデータベースを構築しています。このデータベースは将来の患者さんのための治療開発に重要な情報となっています。またこの基盤を活用し、36件(うち実施中8件)の希少がんを対象とした医師主導治験・企業治験を実施してきました。成果の出た臨床試験から、希少な遺伝子変異に対するがん種横断的治療薬が日本で薬事承認され、希少がんの治療開発を加速させる基盤となっています。
実施医療機関
(2025年7月現在11医療機関、プロジェクト参画順で記載)
- 国立がん研究センター中央病院
- 京都大学医学部附属病院
- 北海道大学病院
- 九州大学病院
- 東北大学病院
- 国立成育医療研究センター
- 愛知県がんセンター
- 都立駒込病院
- 富山大学附属病院
- 岡山大学病院
- 近畿大学病院
参加企業
(2025年7月現在13社、五十音順で記載)
- アステラス製薬株式会社
- エーザイ株式会社
- MSD株式会社
- 小野薬品工業株式会社
- シンバイオ製薬株式会社
- 第一三共株式会社
- 大鵬薬品工業株式会社
- 武田薬品工業株式会社
- 中外製薬株式会社
- 日本セルヴィエ株式会社
- 日本ベーリンガーインゲルハイム株式会社
- ファイザーR&D合同会社
- ブリストルマイヤーズスクイブ株式会社
連携協定
日本希少がん患者会ネットワーク
https://rarecancersjapan.org/(外部サイトにリンクします)
参考
「MASTER KEYプロジェクト」 ホームページ
https://www.ncc.go.jp/jp/ncch/masterkeyproject/index.html
お問い合わせ先
「MASTER KEYプロジェクト」に関するお問い合わせ
国立研究開発法人国立がん研究センター
臨床研究支援部門 研究企画推進部
MASTER KEY Project調整事務局
Eメール:NCCH1612_office●ml.res.ncc.go.jp
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
電話番号:03-3542-2511(代表)
Eメール:ncc-admin●ncc.go.jp
