がん関連遺伝子CHEK2と23種のがん種のリスクを評価-大規模ゲノム解析により個別化医療へ貢献-
2025年9月11日
理化学研究所、東京大学医科学研究所、日本医科大学
国立がん研究センター、佐々木研究所附属杏雲堂病院
概要
理化学研究所(理研)生命医科学研究センター基盤技術開発研究チームの竹原侑里大学院生リサーチ・アソシエイト、碓井喜明基礎科学特別研究員、桃沢幸秀チームディレクター(生命医科学研究センター副センター長)、東京大学医科学研究所附属ヒトゲノム解析センターシークエンス技術開発分野の松田浩一特任教授(同大学大学院新領域創成科学研究科メディカル情報生命専攻クリニカルシークエンス分野教授)、日本医科大学先端医学研究所分子生物学部門の村上善則特命教授、国立がん研究センター研究所ゲノム生物学研究分野の河野隆志分野長、同中央病院遺伝子診療部門の平田真部門長(研究当時:東京大学医科学研究所癌・細胞増殖部門人癌病因遺伝子分野非常勤講師)、佐々木研究所附属杏雲堂病院遺伝子診療科の菅野康吉科長らの国際共同研究グループは、がん関連遺伝子であるCHEK2の病的バリアント[1]が乳がん、前立腺がんの発症リスクを上昇させることに加え、病的バリアントを持つ人におけるそれぞれのがんの特徴を明らかにしました。
本研究成果は、CHEK2とがんの関連を、共同研究者であるプラハ・カレル大学のズデニェク・クレイブル教授らによる機能解析[2]結果も用いて初めて大規模に評価したものであり、遺伝診療の指針作りにつながることが期待されます。
今回、国際共同研究グループは、バイオバンク・ジャパン[3]が収集した約11万人のDNAサンプルを用いて、CHEK2について23種のがん種横断的にゲノム解析を実施しました。バリアントの病原性評価に機能解析を加えたことで、日本で頻度の高い遺伝的バリアント[1]があることが分かりました。CHEK2病的バリアントが女性乳がんに加えて前立腺がんのリスクにも関わることが示され、それらのがんについて病的バリアント保持者の臨床的な特徴を明らかにしました。
本研究は、科学雑誌『JCO precision oncology』オンライン版(9月2日付)に掲載されました。
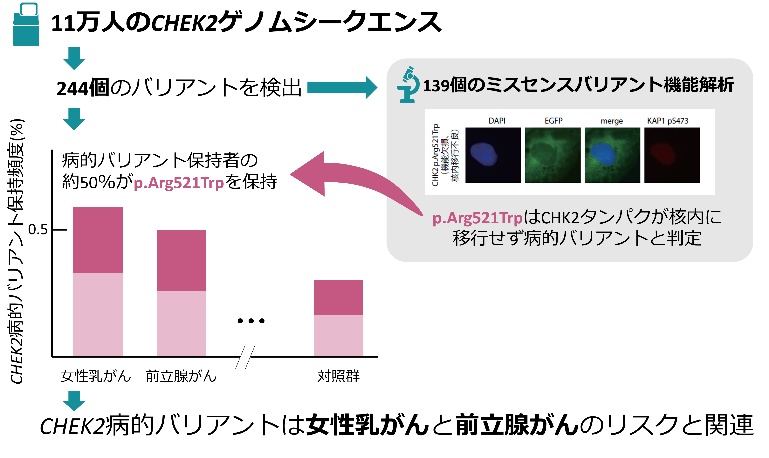
本研究の概要
背景
がんは遺伝要因と環境要因の複雑な相互作用により発症する病気であり、近年では、がんの予防・診断・治療において、個人の遺伝情報を活用する個別化医療が注目されています。がん関連遺伝子とがん罹患(りかん)の関連を大規模なデータで示すことで、個々人が持つ遺伝情報がその人自身の健康管理につながる可能性がますます大きくなってきています。
がん診療の個別化医療では、BRCA1、BRCA2という遺伝子の情報が最も活用されています。BRCA1、BRCA2の病的バリアントは生涯で乳がん、卵巣がんに罹患するリスクを上昇させることが知られています。それらのがんの早期発見のための検査、リスク低減を目的とした手術、また疾患発症メカニズムを応用した治療薬の開発が行われ、保険診療の適応範囲も拡大しています。さらに、前立腺がん、膵臓がんのリスクを上昇させることも知られています。桃沢チームディレクターらはBRCA1、BRCA2遺伝子がこれら四つのがんに加えて、食道がん、胆道がん、胃がんのリスクと関連していることを報告しました注1)。
CHEK2は、そうしたがん関連遺伝子の一つであり、乳がん診療において実施される多遺伝子パネル検査[4]で病的バリアントが検出されることが多いと報告されています。これまで、CHEK2の病的バリアントを持つことで、乳がん以外にも大腸がん、前立腺がん、腎がんなどのリスクが上がるという報告がなされてきましたが、米国のNCCN[5]のガイドラインではその根拠は確定的でないとされていました。
その原因の一つとして、CHEK2の遺伝的バリアントの中には、疾患を引き起こす原因となるか判断が難しい「病的意義不明バリアント[6]」が多数存在することが挙げられ、関連がんを評価する上で障壁となっていました。さらに、これらCHEK2とがんの関連については、欧米では研究データが蓄積されていますが、日本を含む東アジアにおける大規模な解析は実施されていませんでした。遺伝的バリアントは対象集団によって頻度が変わること、また、がん種によっては特定の地域で罹患率が高くなることから、集団や地域ごとのデータは非常に重要であることが考えられています。そして、CHEK2の病的バリアントを保持する人(CHEK2病的バリアント保持者)に対して、全員一律に通常の検診に加えて特別な健康管理を行うべきかについても議論が分かれています。
そこで、国際共同研究グループは、バイオバンク・ジャパンが保有しているDNAサンプルを用いて、CHEK2のゲノム解析とバリアントの機能解析を実施し、関連がんとその臨床的な特徴を評価しました。
注1)2022年4月15日プレスリリース「10万人以上を対象としたBRCA1/2遺伝子の14がん種を横断的解析」
https://www.riken.jp/press/2022/20220415_1/(外部サイトへリンクします)
研究手法と成果
国際共同研究グループは、胆道がん、膀胱がん、骨悪性腫瘍、脳悪性腫瘍、乳がん、子宮頸がん、大腸がん、子宮体がん、食道がん、胃がん、頭頸部がん、肝がん、肺がん、リンパ腫、卵巣がん、膵がん、前立腺がん、腎がん、肉腫、皮膚がん、精巣腫瘍、甲状腺がん、尿管がんの23種のがん種における計112,141人(患者群73,853人、対照群38,288人)について、CHEK2のゲノム解析を行いました。
CHEK2のタンパク質へ翻訳される領域とその周辺の2塩基について、理研独自に開発したターゲットシークエンス法[7]で解析を行いました。その結果、244個の遺伝的バリアントが同定されました。その上で、データベースやタンパク質の機能への影響予測を用いてバリアントを分類し、41個を病的バリアントと判定しました。
次に、病的意義が不明である139個のミスセンスバリアント[1]が病気を引き起こし得る変化かどうかを評価するため、共同研究者であるプラハ・カレル大学のズデニェク・クレイブル教授らが機能解析を実施しました注2)。この機能解析では、CHEK2がコードするCHK2タンパク質と、CHK2タンパク質によって活性化されるKAP1タンパク質のリン酸化(活性)を観察する二つのアッセイ(分析法)を用いました。その結果、バリアントが両タンパク質の活性を欠損させる場合に「タンパク質の機能欠損を引き起こすバリアント」と判定しました。さらに、核内で機能するCHK2タンパク質が、核内に移行できない場合も機能欠損を引き起こすバリアントに分類されました(図1)。その結果、139個のミスセンスバリアント中36個はタンパク質の機能欠損を引き起こすバリアントであると判定しました。
以上の結果から、本研究では、これら合計77個(41個+36個)を「病的バリアント」と定義して解析を進めました(図2)。
なお、全体の病的バリアント保持者のうち約49.4%が521番目のタンパク質であるアルギニンがトリプトファンに変わるp.Arg521Trpバリアントを保持しており、最も高頻度でした。本バリアントは機能解析により機能欠損と判定されており、CHK2タンパク質の核内移行不良を引き起こすことが示されました。また、蛍光顕微鏡では、CHK2タンパク質が核外にとどまる様子が確認されました(図1)。一方で、ヨーロッパにおいてCHEK2の創始者バリアント[8]かつ病的バリアントであるc.1100delCを保持する人は本研究の集団では見られませんでした。このことから、CHEK2には日本人に特有の創始者バリアントが存在する可能性が示されました。
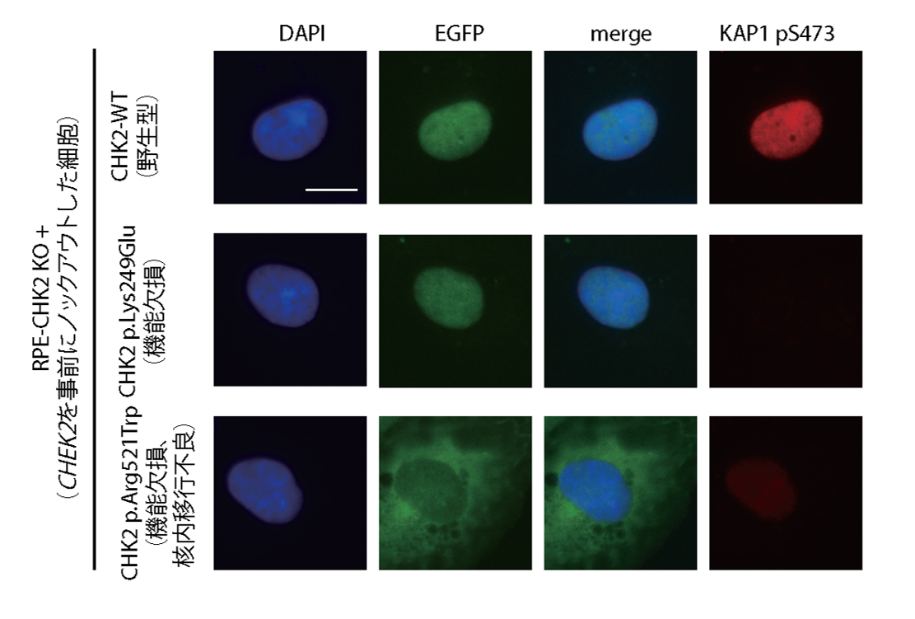
図1 CHEK2ミスセンスバリアントに対する機能解析における細胞実験結果
機能解析では、ヒト由来のPRE1細胞からCHEK2領域をノックアウトした後に、野生型または実験対象であるバリアントを持つCHEK2のプラスミドDNA(細胞内でゲノムとは別に維持されるDNA分子:外来のDNAをホスト細胞に導入するために用いられ、導入されると外来遺伝子を発現する)を導入し、CHK2の発現、CHK2とKAP1の活性を顕微鏡で観察した。その結果の一部を示す。(横)DAPI:細胞の核が青色で示される。EGFP:CHK2の発現量と分布が緑色で示される。merge:DAPIとEGFPの図を融合した。KAP1 pS473:KAP1タンパク質のセリン473番のリン酸化を赤色で示す。
(縦1段目)CHK2-WT(野生型):CHEK2野生型遺伝子を導入した細胞を示す。発現したCHK2タンパク質は核内に分布し、KAP1タンパク質のリン酸化も起こっていることが確認された(図では示されていないが、CHK2タンパク質のリン酸化も確認された)。
(縦2段目)CHK2 p.Lys249Glu(機能欠損):CHEK2(遺伝子に機能解析で「機能欠損」と判定されたバリアント)を導入した細胞を示す。CHK2は核内に移行し、CHK2・KAP1タンパク質の活性化がいずれも基準値以下となった。
(縦3段目)CHK2 p.Arg521Trp(機能欠損、CHK2核内移行不良):CHEK2にp.Arg521Trpバリアントが導入された細胞を示す。CHK2タンパク質は核外にとどまり、KAP1タンパク質のリン酸化活性は基準値以下となった。
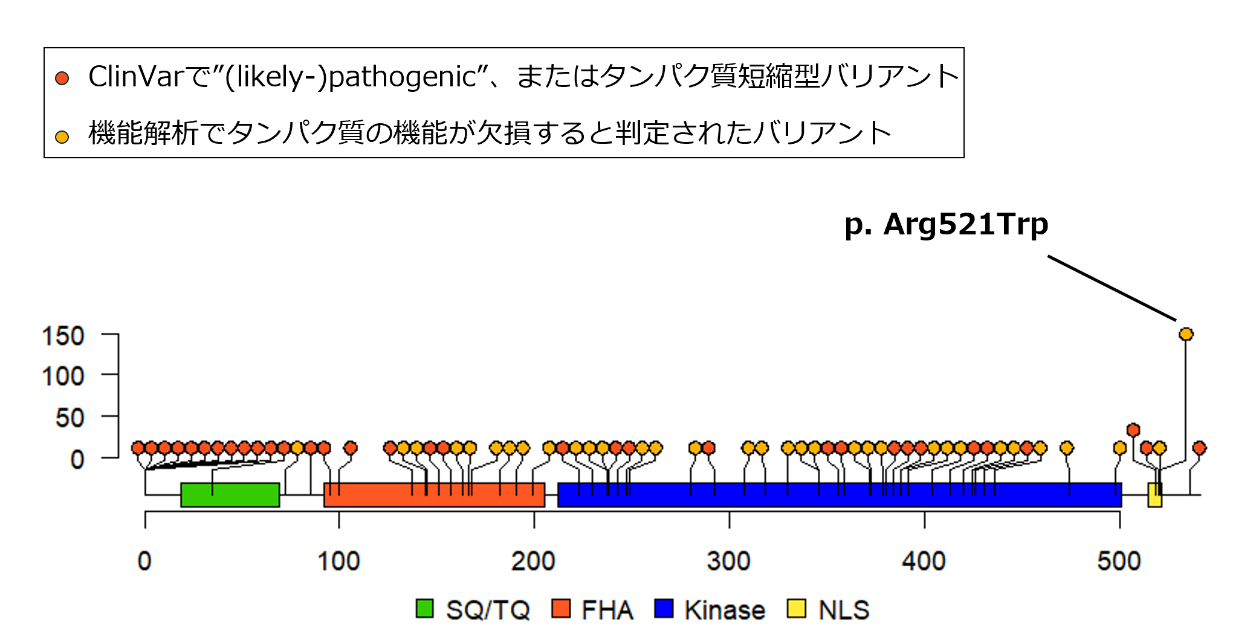
図2 CHEK2に存在する病的バリアントの位置と保有人数
本研究で定義した病的バリアント77個の位置と保持人数を示した図。その形が、棒付きの飴(あめ)(ロリポップ)に似ていることから、ロリプロットと呼ぶ。横軸がアミノ酸の位置、縦軸がその病的バリアントを保有する人数を示す。四角は各種ドメインの領域を示す。〇印の色は凡例の通り病的バリアントの評価方法を示す。赤色は、医療において重要なバリアントと疾患の関係性を取り扱うデータベースであるClinVarで「病的または病的の可能性が高い」と登録されたバリアントまたはタンパク質の機能への影響予測において「タンパク質短縮型」とされたバリアント、黄色は、本研究における機能解析で「機能欠損」と判定されたバリアントを示す。これらの病的バリアントのうち、p. Arg521Trpの保持者が最も多かった。
23種のがん種いずれかの罹患歴がある症例群と、対照群におけるCHEK2病的バリアントの保持頻度を算出し、どのくらいがんになりやすいかという「疾患リスク」を計算しました。統計学的な検定を行った結果、CHEK2の病的バリアントと有意な関連を示したがんは、女性の乳がんと前立腺がんでした(表1)。いずれのがんも、CHEK2病的バリアント保持者であると、非保持者に比べて罹患リスクが1.8倍でした。
| がん種 | 症例群 | 対照群 | OR (95%信頼区間) |
P値 | |||
|---|---|---|---|---|---|---|---|
| 全体数 | 病的バリアント保持者数 (%) | 全体数 | 病的バリアント保持者数 (%) | ||||
| 乳がん(女性) | 11,530 | 68 (0.6) | 16,780 | 54 (0.3) | 1.8 | (1.3-2.6) | 1.2×10-3 |
| 前立腺がん | 12,161 | 61 (0.5) | 21,483 | 61 (0.3) | 1.8 | (1.2-2.6) | 1.7×10-3 |
表1 CHEK2 病的バリアントと有意な関連を示した2がん種の結果
各がん種の症例群における病的バリアント保持者の数とその頻度、症例群と対照群における病的バリアント頻度から計算されるリスク(OR:オッズ比(ある事象の起こりやすさ))と95%信頼区間、P値を示す。
さらに、関連が見られた乳がん・前立腺がんについて、家族歴(同じがんの罹患者が一等親以内にいる)が疾患のリスクにどのような影響を与えるか調べました。病的バリアントも家族歴も持たない場合に比べて、病的バリアントと同じがんの家族歴をいずれも持つ場合のリスクは女性の乳がんで3.8倍(95%信頼区間1.0–14.7)、前立腺がんは14.0倍(95%信頼区間1.7–114.8)でした。このことから、CHEK2病的バリアント保持者のがんリスクを評価する際に家族歴を考慮することは重要であると考えられました。
次に、関連が見られた女性の乳がん、前立腺がんの臨床的な特徴を、CHEK2病的バリアント保持者と非保持者の間で比較しました。各がんの診断年齢は、CHEK2病的バリアント保持者と非保持者の間に有意な差は見られませんでした。また、各がんにおける予後因子(がんの予後を予測する因子)の一つである、トリプルネガティブ乳がん[9]、グリソンスコア[10]が8以上の前立腺がんの割合も比較しました。この結果、いずれもCHEK2病的バリアント保持者と非保持者の間で有意な違いは見られませんでした。これは、過去に桃沢チームディレクターらが発表した乳がんの高リスク遺伝子として知られるBRCA1やBRCA2の病的バリアント保持者の結果と対照的でした。
注2)Stolarova L, Kleiblova P, Zemankova P, et al. ENIGMA CHEK2gether Project: A Comprehensive Study Identifies Functionally Impaired CHEK2 Germline Missense Variants Associated with Increased Breast Cancer Risk.
https://doi.org/10.1158/1078-0432.CCR-23-0212(外部サイトへリンクします)
今後の期待
本研究では、機能解析の結果を用いて、これまで大規模なデータがなかった日本人におけるCHEK2と23種のがん種の関連を調べました。今回の研究成果により、日本人において、CHEK2病的バリアントは乳がんと前立腺がんのリスクを上げることが示されました。一方で、病的バリアントを保持していても、これらのがんのリスクの上昇は中程度であり、診断年齢や特定の病理学的特徴は病的バリアントを持たない場合と有意な差は見られませんでした。
これらの結果を踏まえると、CHEK2病的バリアント保持者の健康管理は、がんの早期発見のために一律全員に追加の検査を行うよりも、家族歴など個別のリスク因子まで加味した上で検査の必要性を決定していくことが重要であると考えられます。この結果を基にさらにデータが蓄積されることで、CHEK2病的バリアント保持者の個別化医療が発展していくことが期待されます。
論文情報
タイトル
Case-Control Study for 23 Cancer Types With Functional Analysis of CHEK2: Risk Estimation and Clinical Recommendations in East Asia
著者名
Yuri TAKEHARA*, Yoshiaki USUI*, Lenka STOLAROVA, Petra KLEIBLOVA, Yusuke IWASAKI, Todd A. JOHNSON, Makoto HIRATA, Yoichiro KAMATANI, Yoshinori MURAKAMI, Mikiko ENDO, Kouya SHIRAISHI, Takashi KOHNO,
Kokichi SUGANO, Koichi MATSUDA, Teruhiko YOSHIDA, Amanda B. SPURDLE, Hidewaki NAKAGAWA, Libor MACUREK, Zdenek KLEIBL, Yukihide MOMOZAWA (*共同筆頭著者)
雑誌
JCO precision oncology
DOI
10.1200/PO-24-00945
補足説明
[1]病的バリアント、遺伝的バリアント、ミスセンスバリアント
遺伝的バリアントは、遺伝子の塩基配列の変化を指し、生物の多様性を生じさせる。また、遺伝的バリアントのうち疾患発症の原因となるものを病的バリアントという。ミスセンスバリアントは遺伝子上のDNA配列が変化することで、翻訳されたタンパク質の一つのアミノ酸が別のアミノ酸に置換される変異。[2]機能解析
ここでは、遺伝的バリアントが、その遺伝子がコードするタンパク質の機能にどのような影響を与えるか解析する手法を指す。
[3]バイオバンク・ジャパン
日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ提供している。2003年から東京大学医科学研究所内に設置されている。[4]多遺伝子パネル検査
特定の疾患、状態に関連する複数の遺伝子を同時に検査する方法。生まれ持った遺伝子の特徴を調べる検査で、がん、心疾患、希少疾患などに対して実施される。[5]NCCN
患者ケアと研究、教育を専門とする、米国を代表する33のがんセンターによって結成された非営利団体。NCCNが作成しているがん診療のガイドラインは国際的に広く利用され、研究論文でも数多く引用されている。NCCNはThe National Comprehensive Cancer Networkの略。[6]病的意義不明バリアント
バリアントの病原性を評価するための情報が不十分であり、疾患発症の原因となるか不明であるバリアント。[7]ターゲットシークエンス法
全ゲノム領域のうち標的ゲノム領域のみを解析する方法。多くの場合は標的遺伝子を選定して領域を設定するが、ある疾患領域に関連する全ての遺伝子を解析するなど、疾患と関連するイントロン領域や調節領域などの非翻訳領域も組み入れ、標的を拡大して解析する場合もある。[8]創始者バリアント
地理的にまたは文化的に隔離された集団において、先祖の1人に生じ、その後、その集団内で広がった遺伝的バリアントのこと。[9]トリプルネガティブ乳がん
乳がんの細胞増殖に関わる三つのタンパク質(エストロゲン受容体、プロゲステロン受容体、HER2)を持たないタイプの乳がんのことをこのように呼ぶ。トリプルネガティブ乳がんは一般的に予後不良とされる。[10]グリソンスコア
前立腺がんの悪性度を6~10の数字で示すスコアで、がんの病理組織から判定される。数字が高くなるほど悪性度が高くなり、特に8以上が高悪性度である。予後予測因子の一つとされる。国際共同研究グループ
理化学研究所 生命医科学研究センター
基盤技術開発研究チーム
(生命医科学研究センター 副センター長)
がんゲノム研究チーム
研究員 トッド・アンドリュー・ジョンソン(Todd A Johnson)
プラハ・カレル大学(チェコ共和国)
チェコ科学アカデミー分子遺伝学研究所(チェコ共和国)
日本医科大学先端医学研究所 分子生物学部門
東京大学医科学研究所 附属ヒトゲノム解析センター シークエンス技術開発分野
(同大学 大学院新領域創成科学研究科 メディカル情報生命専攻 クリニカルシークエンス分野 教授)
国立がん研究センター
研究所 ゲノム生物学研究分野
ユニット長 白石航也 (シライシ・コウヤ)
分野長 河野隆志 (コウノ・タカシ)
中央病院 遺伝子診療部門
部門長 平田真 (ヒラタ・マコト)
(研究当時:東京大学医科学研究所 癌・細胞増殖部門 人癌病因遺伝子分野 非常勤講師)
医員 吉田輝彦 (ヨシダ・テルヒコ)
佐々木研究所附属杏雲堂病院 遺伝子診療科
科長 菅野康吉 (スガノ・コウキチ)
(研究当時:国立がん研究センター中央病院 遺伝子診療部門 非常勤医員)
QIMRベルクホーファー医学研究所(オーストラリア)
遺伝学・ポピュレーションヘルス分野
グループリーダー アマンダ・B・スパードル(Amanda B. Spurdle)
研究支援
本研究は、日本医療研究開発機構(AMED)ゲノム創薬基盤推進研究事業「乳がん・大腸がん・膵がんに対する適切な薬剤投与を可能にする大規模データ基盤の構築(研究開発代表者:桃沢幸秀)」、同革新的がん医療実用化研究事業「23がん種14万人を用いた遺伝・環境・生活習慣を統合した各個人の疾患リスクの推定(代表者:桃沢幸秀)」、同ゲノム医療実現バイオバンク利活用プログラム「利活用を目的とした日本疾患バイオバンクの運営・管理(代表者:松田浩一)」、および同次世代がん医療創生研究事業「難治性若年発症婦人科がんの発症リスクに関わる胚細胞系列変異の同定とその機能評価系の構築(研究開発代表者:白石航也)」による助成を受けて行われました。また、NHMRC Investigator Fellowship(Amanda B. Spurdle)、the Ministry of Health of the Czech Republic、Charles University、the Ministry of Education Youth and Sports of the Czech Republic、the Czech Academy of Sciences(Lenka Stolarova)の助成も受けて行われました。
発表者・機関窓口
発表者 注:研究内容については発表者にお問い合わせください。
- 理化学研究所 生命医科学研究センター 基盤技術開発研究チーム
チームディレクター 桃沢幸秀(モモザワ・ユキヒデ)
(生命医科学研究センター副センター長)
大学院生リサーチ・アソシエイト 竹原侑里(タケハラ・ユリ)
基礎科学特別研究員 碓井喜明(ウスイ・ヨシアキ) - 東京大学医科学研究所 附属ヒトゲノム解析センター シークエンス技術開発分野
特任教授 松田浩一(マツダ・コウイチ)
(同大学 大学院 新領域創成科学研究科 メディカル情報生命専攻 クリニカルシークエンス分野教授) - 日本医科大学先端医学研究所 分子生物学部門
特命教授 村上善則(ムラカミ・ヨシノリ) - 国立がん研究センター
研究所 ゲノム生物学研究分野
分野長 河野隆志(コウノ・タカシ)
中央病院 遺伝子診療部門
部門長 平田真(ヒラタ・マコト)
(研究当時:東京大学医科学研究所 癌・細胞増殖部門 人癌病因遺伝子分野 非常勤講師) - 佐々木研究所附属杏雲堂病院 遺伝子診療科
科長 菅野康吉(スガノ・コウキチ)
機関窓口
- 理化学研究所 広報部 報道担当
Tel:050-3495-0247
Email:ex-press●ml.riken.jp - 東京大学医科学研究所 プロジェクトコーディネーター室(広報)
Tel:090-9832-9760
Email:koho●ims.u-tokyo.ac.jp - 日本医科大学先端医学研究所 事務室
Tel:03-3822-2131(代表)
Email:sentankenjimushitsu.group●nms.ac.jp - 国立がん研究センター企画戦略局 広報企画室
Tel:03-3542-2511(代表)
Email:ncc-admin●ncc.go.jp - 佐々木研究所 研究事務室
Tel:03-3294-3286 FAX:03-3294-3290
Email:h-yamaguchi●po.kyoundo.jp
