トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 腫瘍免疫研究分野 > 研究プロジェクト > がんの免疫原性による層別化と今後の研究課題
がんの免疫原性による層別化と今後の研究課題
近年、がんが免疫系から逃避するために獲得するCTLA-4やPD-1といった免疫チェックポイント分子に対するブロッキング抗体によって、悪性黒色腫、非小細胞肺がん、腎細胞がん、胃がんなどの患者さんの生存期間が大きく延長されることがわかり、がん治療の新たな選択肢となってきています。しかし、全体の約30%の患者さんにしか有効でないため、治療に対して効果がみられる可能性が高い患者さん(レスポンダー)を層別化するためのバイオマーカーの検討が進められています。
がん細胞は、細胞の構成成分を抗原として細胞表面に提示しています。T細胞は細胞表面に提示されたこれらの抗原を認識することによって、攻撃するかどうかを決定しています。がん細胞が提示している抗原には、自己に由来する分子と、がん細胞の遺伝子不安定性によって生じた遺伝子変異に由来する分子があります。遺伝子変異によって生じた分子は、免疫系がこれまで出会ったことがない分子であるため、がん細胞に特異的な新たな抗原 (neo-antigens)、すなわち異物として認識され、強いT細胞応答が誘導されるため、これらの抗原を多く発現している場合は、免疫チェックポイント抗体治療が効果を発揮しやすいこと報告されました。一方、冒頭で述べたように、免疫編集によってこのような免疫原性が高い異物として認識されるような抗原を脱落させたがん細胞も存在し、このような場合は免疫チェックポイント抗体治療が効果を発揮しにくいことが示されています。
すなわち、がんは免疫原性と免疫逃避機構によって2つに大別できます。
- neo-antigenを多く発現し、T細胞がready-to-goの状態であるにも関わらず、制御性T細胞や免疫チェックポイント分子などの免疫抑制機構を活用し、増殖しているようながん
- がん細胞自身が、免疫系に認識されないように免疫原性の高い抗原を脱落させ、自己もどきとなることで免疫系から逃避しているがん
1.が主な免疫抑制機構のがんでは、免疫チェックポイント分子による抑制を外すことで十分な抗腫瘍免疫応答を活性化できると考えられます。これらのバランスについての解析が進めば、がん免疫療法を選択する上でより適切なバイオマーカーを得ることができます。
一方、2.の機構が主にかかわっているがんでは、多くのがん抗原は自己由来であり、私たちのグループが示したような自己免疫寛容機構が抗腫瘍免疫応答を抑制していると考えられるため、制御性T細胞を除去した上で、免疫応答を活性化する必要があると考えられます。またがん自身が重要な遺伝子異常やシグナルを用いて積極的に抗腫瘍免疫応答を抑制するようなシステムを持っていることも見出しつつあります。私たちの研究室では、これらの機構をさらに詳細に解明することにより、免疫チェックポイント抗体治療に効果を示す患者さんを層別化するバイオマーカーの同定、さらに、制御性T細胞などの免疫抑制機構を解明することにより、がんに対する免疫抑制を効率的に解除するような、有効で安全ながん免疫治療を開発するための研究を進めています。
- 竹内美子,西川博嘉:がん免疫療法における制御性T細胞の意義.腫瘍内科 16:360-366, 2015
- Nishikawa H, Sakaguchi S. Regulator T cells in cancer immunotherapy. Curr Opin Immunol, 27:1-7, 2014 [PubMed]
- Maeda Y, Nishikawa H, Sugiyama D, Ha D, Hamaguchi M, Saito T, Nishioka M, Wing JB, Adeegbe D, Katayama I, Sakaguchi S. Detection of self-reactive CD8⁺ T cells with an anergic phenotype in healthy individuals. Science, 346:1536-1540, 2014 [PubMed]
- Sugiyama D, Nishikawa H, Maeda Y, Nishioka M, Tanemura A, Katayama I, Ezoe S, Kanakura Y, Sato E, Fukumori Y, Karbach J, Jäger E, Sakaguchi S. Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc Natl Acad Sci USA, 110:17945-17950, 2013 [PubMed]
- Phase Ia/Ib Multicenter Trial of Mogamulizumab for Advanced or Recurrent Cancer. ClinicalTrials.gov ID: NCT01929486 [ClinicalTrials.gov]
がん微小環境でのT細胞活性化および抑制機構の解明
私たちは病原体等の異物を排除するために免疫システムを利用していますが、がん細胞の排除にも同様の免疫システムが働いています。がんの発生初期には自然免疫系から獲得免疫系につながる一連の免疫システムが作動することでがん細胞が排除されます。私たちの研究室では、がん組織中あるいはがん周辺の環境(がん微小環境)における獲得免疫系、とりわけT細胞の機能に着目した研究を行っています。がん細胞を殺傷するキラーT細胞(CD8+T細胞)は、細胞表面に発現しているT細胞受容体(TCR)によりがん抗原を特異的に認識し、殺傷します。CD8+T細胞は、TCRとがん抗原ペプチドとの相互作用と、細胞表面に発現する副刺激分子(CD28等)のシグナル伝達が生じることで活性化し、がん細胞を殺傷できるようになります。一方で、副刺激分子と拮抗し、免疫抑制シグナルを伝達する免疫チェックポイント分子(CTLA-4、PD-1等)が存在し、T細胞の過剰な免疫応答を抑制しています1。
近年、がん免疫治療薬として免疫チェックポイント分子の阻害抗体が開発され、難治性がん患者に対し劇的な効果を示しています。しかし、これらの抗体医薬は全身に作用するため、治療患者の多くは、免疫の過剰応答による自己免疫疾患を発症してしまいます。現在まで、がん微小環境に存在するCD8+T細胞のみを効率よく活性化させる手段は明らかにされていません。
以上を踏まえ、私たちの研究室ではがん微小環境に存在するCD8+T細胞の活性化および活性抑制に関与する分子や細胞機能を詳細に解析し、がん微小環境下でCD8+T細胞を活性化する新規メカニズムの解明を目指しています。これらの研究成果から、免疫によるがんの排除を強化しつつ副作用を発生させない新規がん免疫治療法の開発を目的としています。
- Callahan MK, Postow MA, Wolchok JD. CTLA-4 and PD-1 Pathway Blockade: Combinations in the Clinic. Front Oncol, 4:385, 2015 [PubMed]
がん微小環境での代謝と免疫応答の関連の解明
近年、T細胞の分化や機能において代謝機構が重要な役割を持つことがわかってきています。それぞれのT細胞はサブタイプ特異的な代謝機構を活性化させており、それを障害するとT細胞の生存率や機能の低下につながることが明らかになっています。末梢血のCD4+、CD8+エフェクターT細胞 (Teff) では mTORのシグナルにより解糖系が亢進しているのに対して、制御性T細胞 (Treg) では AMPKのシグナルにより脂肪酸酸化に続くミトコンドリアにおける酸化的リン酸化が亢進しています1。
当研究室ではがん局所における免疫応答に注目して研究を行っています。がん微小環境では低グルコース、低酸素などの状態であり、がん局所に浸潤しているT細胞もこのような環境下にあることが知られています2。エネルギー代謝に非常に重要であるグルコースと酸素が不足した状態下では、がん細胞は様々な分子機構を用いて環境に適応していますが、T細胞の代謝の変化については未だ不明な点が多く残っています。当研究室ではがん局所に浸潤しているT細胞の代謝機構の詳細を解析し、さらにその代謝がT細胞の機能に与える影響について明らかにする研究を行っています。この研究成果により、がん微小環境における免疫応答に介入し、抗腫瘍免疫を高めるような新たな治療法の開発を目指しています。
- Howie D, Waldmann H, Cobbold S. Nutrient sensing via mTOR in T cells maintains a tolerogenic microenvironment. Front Immunol, 5:409, 2014 [PubMed]
- Palazon A, Aragonés J, Morales-Kastresana A, de Landázuri MO, Melero I. Molecular pathways: hypoxia response in immune cells fighting or promoting cancer. Clin Cancer Res, 18:1207-1213, 2012 [PubMed]
がん微小環境へのT細胞浸潤機構の解明
がん細胞によって形成されるがん微小環境では正常組織とは異なる生体反応が認められます。その一つとして、血管新生因子の放出による血管新生の促進がみられ、がん細胞が無限に増殖するための栄養素の運搬に寄与しています。一方で、がん細胞の排除に関わるキラーT細胞やがん細胞の生存を助ける免疫抑制細胞も新生血管を通して流出もしくは流入しています(図1)。
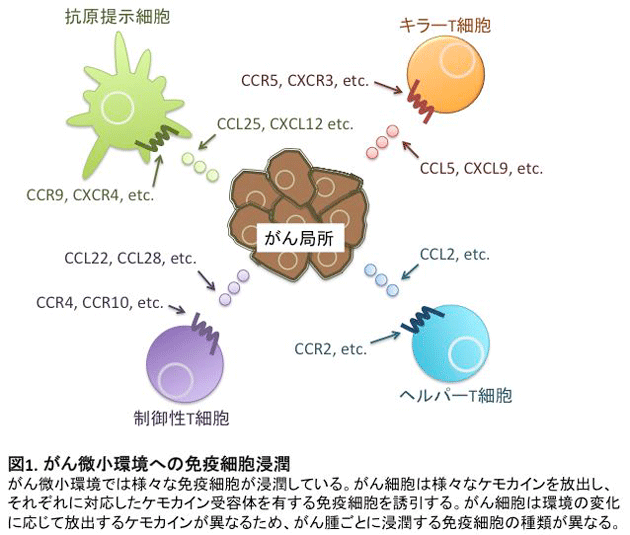
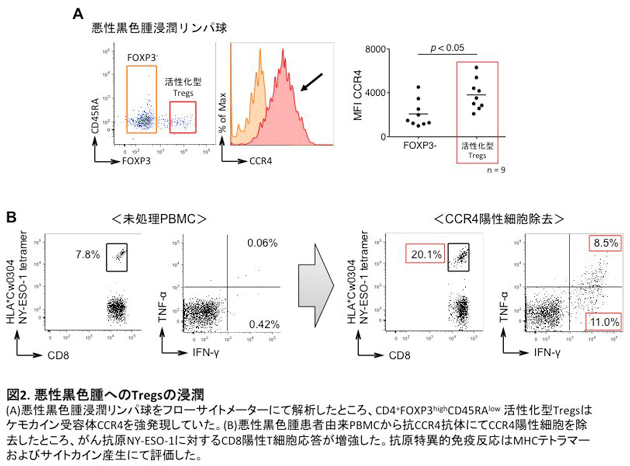
これらの細胞輸送に関わる因子として、ケモカインと呼ばれる化学走化性因子が関係しています。免疫担当細胞はさまざまなケモカイン受容体を発現し、それぞれの受容体に対応するケモカインに引き付けられ組織に遊走し、集積します。現在まで、約50種類のケモカインと約20種類のケモカイン受容体が同定され、それらを産生・発現する細胞も明らかにされてきています。近年では、がん細胞のがん化およびそれに関連するシグナル伝達とケモカイン産生の関連性が詳細に解析され、がん微小環境への免疫担当細胞の浸潤機構に関する研究が盛んに行われています1,2。これまでに私たちは、悪性黒色腫患者検体を用いた研究において、悪性黒色腫局所に浸潤しているCD4+FOXP3highCD45RAlo制御性T細胞(活性化型制御性T細胞)がケモカイン受容体4(CCR4)を強発現していることを見出しました。さらに抗CCR4抗体を用いることでがん局所のTregsを選択的に除去することが可能であり、その結果として抗腫瘍免疫応答が増強することを報告しました3(図2)。この研究成果は、がん微小環境へのT細胞浸潤機構の一部を解明したものですが、がん種ごとのT細胞浸潤機構やT細胞およびがん細胞におけるケモカイン、ケモカイン受容体の発現制御機構について未だに解明されていないことが数多く存在します。
私たちの研究室では、がん患者検体およびマウスモデルを用いて、がん微小環境への新たなT細胞浸潤機構について研究を進めています。特にがん自身が重要な遺伝子異常やシグナルによって積極的に抗腫瘍免疫応答を抑制するようなシステムを持っていることも見出しつつあります。この研究成果から、がん微小環境へのキラーT細胞浸潤を促進し、かつ免疫抑制細胞の浸潤をブロックする細胞浸潤の制御機構を明らかにし、新規がん免疫療法の開発につなげることを目指しています。
- Spranger S, Bao R, Gajewski TF. Melanoma-intrinsic β-catenin signalling prevents anti-tumour immunity. Nature, 523:231-235, 2015 [PubMed]
- Serrels A, Lund T, Serrels B, Byron A, McPherson RC, von Kriegsheim A, et al. Nuclear FAK controls chemokine transcription, Tregs, and evasion of anti-tumor immunity. Cell, 163:160-173, 2015 [PubMed]
- Sugiyama D, Nishikawa H, Maeda Y, Nishioka M, Tanemura A, Katayama I, et al. Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc Natl Acad Sci USA, 110:17945-17950, 2013 [PubMed]
がん免疫療法でのT細胞応答モニタリングによる抗腫瘍免疫応答の本態解明
現在、抗CTLA-4抗体や抗PD-1抗体といった免疫チェックポイント分子阻害剤を用いたがん免疫療法が注目されています。これらの免疫チェックポイント分子阻害剤は、悪性黒色腫や非小細胞肺がんなどのいくつかの難治性悪性腫瘍に対して有効な治療法であると報告されていますが、治療効果がみられない患者も依然として多く、より効果的ながん免疫療法の開発が望まれています。この現状を解決するために、免疫治療を受けた患者さん体内の免疫細胞機能を解析する試みがなされています。近年の解析結果から、免疫療法はがん細胞の遺伝子変異によって発現する新たな抗原(neo-antigen)を多くもつ患者さんに効果的であると報告されています1,2。
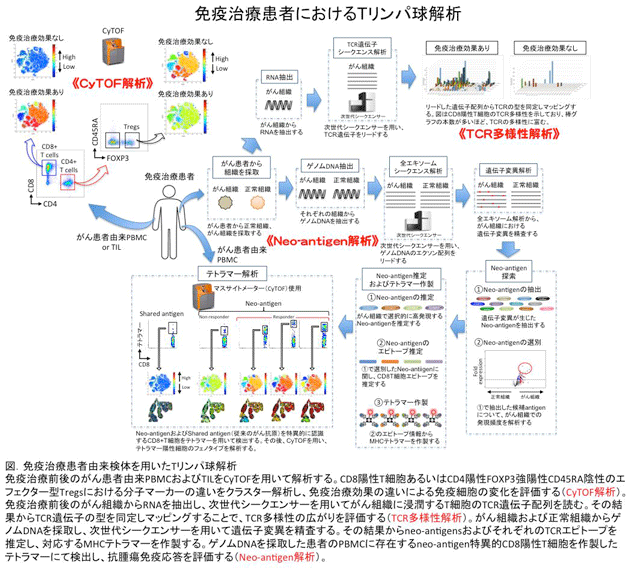
私たちの研究室では、がん免疫療法を含む様々ながん治療を受けた患者さんから血液あるいは腫瘍組織を提供していただき、それらに含まれるTリンパ球の機能を解析しています(図)。解析には最先端の技術を導入しており、その一つとしてマスサイトメーター(CyTOF)を用いた新規標的分子マーカーの探索を行っています3。CyTOFは従来の蛍光抗体を用いたフローサイトメーター(現時点では最大30マーカー程度を同時に検出可能)とは異なり、重金属ラベルされた抗体を用います。この方法により、CyTOFでは理論上100を超えるマーカーを同時に検出可能であり、少量サンプルでも新規標的マーカーを効率よく探索することができます。また、上述したneo-antigen特異的T細胞の検出も試みています。Neo-antigenを特異的に認識するCD8陽性T細胞を検出することで、免疫療法後に抗腫瘍免疫応答が増強されているか否かを正確に評価することができます。さらに、Tリンパ球のTCR多様性にも着目しており、CD8陽性T細胞あるいは制御性T細胞のTCR多様性の広がりと治療効果との関連性を明らかにすることを試みています。これらの解析結果から、がん免疫療法に効果がある患者さんに共通する特徴的なTリンパ球のフェノタイプや動態を解明することで、がん免疫療法が有効な患者さんを層別化するとともにこれまでがん免疫療法に対して効果がない患者さんを治療する新規がん免疫療法を開発することができると考えています。
- Snyder A, Makarov V, Merghoub T, Yuan J, Zaretsky JM, Desrichard A, et al. Genetic basis for clinical response to CTLA-4 blockade in melanoma. N Engl J Med, 371:2189-2199, 2014 [PubMed]
- Rizvi NA, Hellmann MD, Snyder A, Kvistborg P, Makarov V, Havel JJ, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science, 348:124-128, 2015 [PubMed]
- Newell EW, Sigal N, Nair N, Kidd BA, Greenberg HB, Davis MM. Combinatorial tetramer staining and mass cytometry analysis facilitate T-cell epitope mapping and characterization. Nat Biotechnol, 31:623-629, 2013 [PubMed]

