トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 独立ユニットグループ > 分子発がん研究ユニット > 研究プロジェクト > miRNAの特性を利用した新規分子標的の同定と応用
miRNAの特性を利用した新規分子標的の同定と応用
がんの発生過程では、さまざまな外因性の発がんストレス(oncogenic insults)によりゲノム・エピゲノム変異が誘発され、それらが多段階的・多岐的に蓄積することにより、がん細胞は特徴的な遺伝子発現プロファイルを獲得します。その結果として、多くの細胞内がん抑制ネットワークが不活性化(あるいは活性低下)しています。がん抑制因子p53は様々な発がんストレスに応答し、ゲノムの安定性を維持し正常細胞の形質転換を防いでいますが、多くのがん細胞ではp53依存的ながん抑制ネットワークの不活化が生じています。
私たちが研究している細胞内small non-coding RNAであるmicroRNA (miRNA) は遺伝子発現制御因子として機能し、細胞内ネットワークのfine-tuningをおこなう重要な因子ですが、p53依存的な細胞内ネットワークの適切な制御にも必須であり、miRNAの機能異常はp53ネットワークの適切な制御からの逸脱に深く関連しています。
私たちは特定のmiRNAが誘導する表現型と標的遺伝子との関連解析だけではなく、そのmiRNAが介在する細胞内ネットワークの全体を理解することでがん本態を知り、新たながん治療戦略を提案することができると考え研究をおこなっています。また、miRNAの標的遺伝子の選択は細胞タイプに依存することから、miRNAをスクリーニングツールとして、特定遺伝子変異を背景とするがん細胞の増殖に必須な細胞内ネットワークの同定を行い、そのメカニズムの解明を通して、より効果的な治療法確立への貢献を目指しています。
野生型p53が形成する内在性がん抑制ネットワークの理解
p53がさまざまな細胞外からのストレスによって適切な下流ネットワークを活性化できる理由のひとつは、ストレスの種類に依存して転写活性化する下流遺伝子を選択するためです。そのメカニズムの一つとしてp53タンパク質の翻訳後修飾による制御が知られています。p53が制御する細胞内がん抑制ネットワークは多様であり、複雑に形成されています。ネットワークの制御因子に機能異常(変異や不活化など)が生じれば、たとえp53が野生型でも一部そのネットワークが機能しなくなります。細胞傷害性の化学療法剤の多くは、さまざまなメカニズムで野生型p53を活性化しますが、適切な下流ネットワークがp53により選択されなければ、あるいは選択されたとしてもそのネットワークが不活性化していれば、薬剤の効果は期待できません。このようなストレスに応じたp53依存的な下流ネットワークの選択において、特定miRNAの活性化も非常に重要です。p53ネットワークで機能するmiRNAsもp53に依存して、ストレスの種類に応じて活性化されます。しかし、がん細胞でmiRNAsの発現・機能異常が生じれば、たとえそのネットワークの他の制御因子の失活がなくても、p53下流ネットワークの活性化が不完全(あるいは活性化しない)と考えられます。
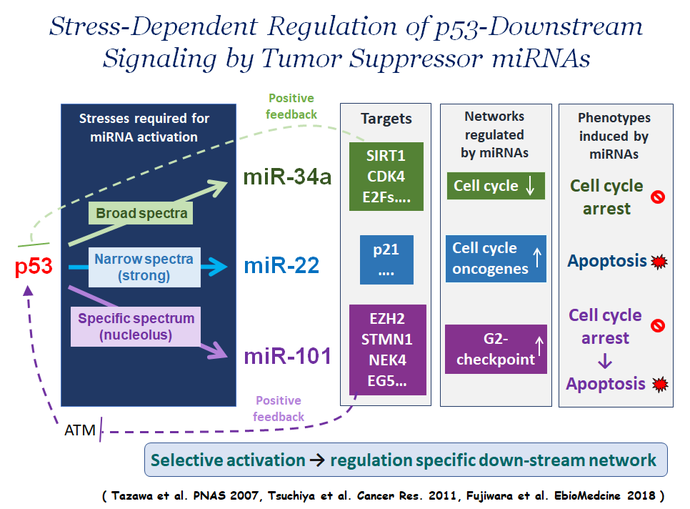
miR-34aは私たちを含む複数のグループが同時期に報告したがん抑制的miRNAであり、p53により転写制御されることが証明されたmiRNAの第1号です。miR-34aは広範な細胞外からのストレスに応答してp53によって転写活性化され、細胞周期の停止や細胞老化を誘導し、 がん細胞の増殖を強く抑制する機能を有しています。
一方、私たちの研究室で樹立した機能的スクリーニング法により単離したmiR-22は、p53で直接転写活性化を受けるmiRNAですが、その活性化は細胞死を誘導する様な強いストレスに限定されています。miR-22は強いストレス曝露下でp21の発現を抑制し、p53野生型がん細胞にアポトーシスを強く誘導します。大腸がん症例では、p53と共にmiR-22の遺伝子の片アリル欠損を生じているケースが多く、miR-22ががん抑制遺伝子として機能していると考えられます。
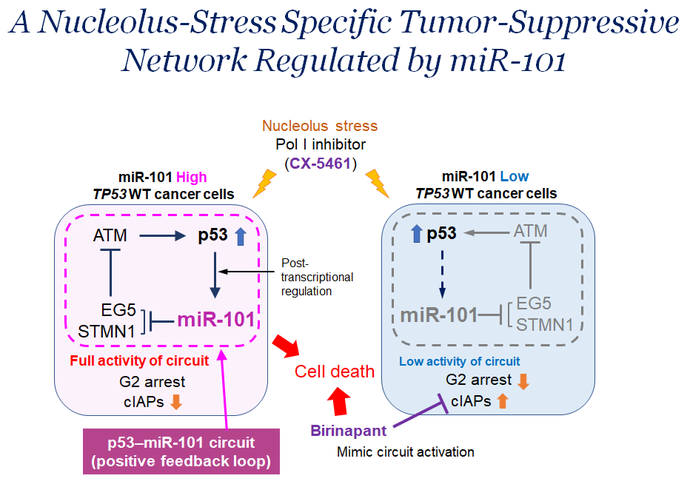
機能的スクリーニング法で単離したがん抑制的miRNAの一つであるmiR-101は、核小体ストレスにのみ応答してp53依存的に発現量が増加し、細胞周期のG2停止を誘導した後、細胞のアポトーシスを誘導します。核小体はリボソーム合成の主な場所であり、リボソームの合成は細胞増殖と密接に連携しており、正常細胞におけるその制御はがん関連因子やがん抑制因子が形成するネットワークで厳密に制御されています。リボソームの機能異常(核小体ストレス)はp53の活性化を誘導します。我々は核小体ストレスに応答してmiR-101がp53のポジティブフィードバックを維持し、下流ネットワークの持続的な活性化に必要であることを示しました。すなわち、miR-101の発現(機能)が低下していれば、核小体ストレス誘導剤(注)でp53を活性化させても薬剤の効果は期待できないと考えられます。
注:核小体ストレス誘導剤(CX-5461)は、臨床試験がすすんでいます。
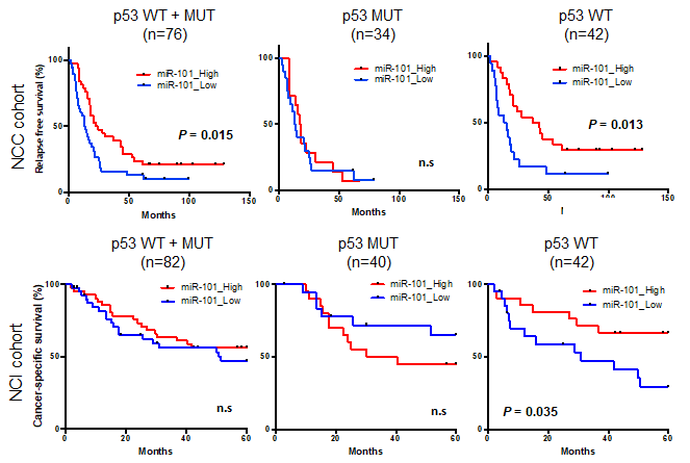
実際に臨床検体でのmiR-101の低下と患者予後との関連について解析したところ、miR-101の発現が低いp53野生型の症例は予後不良でしたが、p53遺伝子に変異を有する症例では予後に差はありませんでした。このことはmiR-101がp53下流ネットワーク依存的な内在性のがん抑制機構の形成に重要であることを示唆します。miR-101の発現が低い症例でも、miR-101が介在するp53依存的な核小体ストレス応答経路の活性化を模倣することができれば、効率よくがん細胞死を誘導できるとも考えられます。
そこで、p53-miR-101の最下流に位置し、細胞死の誘導に最も関連する因子の探索を行い、cIAP1 (cellular inhibitor of apoptosis protein 1 , BIRC2) を同定し、がんで発現が亢進していることを見出しました。そしてcIAPの選択的阻害剤 ( Birinapant:臨床試験中) と核小体ストレス誘導剤 (CX-5461) の投与により、p53野生型のがん細胞に効率よくアポトーシスを誘導できることを明らかにしました。すなわち、核小体ストレスによるp53の活性化とp53-miR-101ネットワークの最下流に位置する分子を標的にすれば、内在性のがん抑制ネットワークの活性化を模倣できる可能性を示しています。
このように、miRNAが介在する細胞内ネットワークを理解し、その表現型を規定する最下流の分子を同定することで、化学療法剤と分子標的薬の併用に関する基礎的なデータを取得することができます。我々は細胞内の複雑なネットワークを理解するために、miRNAを利用して網羅的な遺伝子発現や、臨床検体のゲノム解析などを組み合わせて、臨床的にも意義を有すると考えられる分子標的の候補を提案する研究をおこなうことが重要であると考えています。
p53変異がん細胞の選択的排除をめざした標的分子の探索
p53遺伝子の変異はがんの約半数で検出され、その機能喪失が、がんの発生を深く関連することは明らかです。また、上述の通り、野生型p53を活性化し、がん細胞の増殖を抑制する戦略は、古くから多くの試みがあります。一方で、p53が変異したがん細胞を選択的に排除する方法は、未だ具体的に示されていません(変異型p53を標的とした治療薬の開発は試みられていますが、未だに良い薬剤はありません)。
miRNAは遺伝子発現制御因子として機能しますが、ひとつのmiRNAが複数の遺伝子の発現を同時に制御することで、細胞内ネットワークのfine-tuningをおこないます。miRNAは、細胞のタイプによって標的となる遺伝子が異なります。これは、p53遺伝子の変異の有無でも変わることがわかっています。その様なmiRNAの機能を利用して、p53変異がん細胞の増殖を選択的に抑制する分子の探索が可能であると思われます。
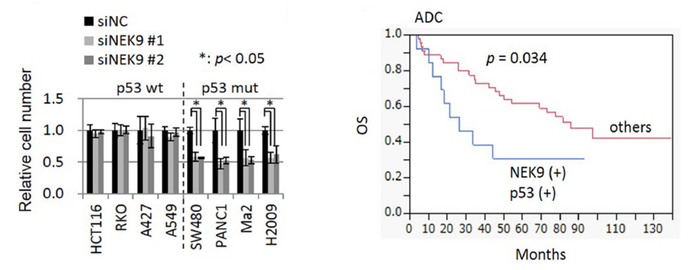
そこで、私たちが単離したがん抑制的miR−22をスクリーニングツールとして利用し、p53不活化がん細胞の細胞周期停止に関連する標的遺伝子の探索をおこない、細胞周期亢進に必須なNEK9 ( NIMA-related kinase 9 ) を同定しました。NEK9の発現を抑制することで、p53変異がん細胞の増殖が抑制されますが、p53野生型がん細胞の増殖は抑制しませんでした。すなわち、NEK9はp53変異がん細胞の生存・増殖に深く連携する分子であることを示しています。また、p53が変異しNEK9の発現が高い肺腺がん症例は予後不良であることから、この経路ががんの悪性化に関連していることが示唆されます。
現在はp53が変異したがん細胞を選択的に排除する治療法の開発を目指して、NEK9が関連する細胞内ネットワークの詳細な解析を行っています。一方、miRNAがスクリーニングツールとして有用であることが上記の研究から示唆されたため、p53が不活化したがん細胞内で形成される細胞内ネットワークの解明を目指し、p53変異がん細胞の増殖を特異的に抑制するmiRNAの網羅的スクリーニングとその機能解析も行っています。

