トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 医療AI研究開発分野
医療AI研究開発分野(旧 がん分子修飾制御学分野)
お知らせ
- [NCCからの発表(2024年4月17日)] 当分野・分野長の浜本が、第42回札幌国際がんシンポジウムに登壇いたします。詳しくは"こちら"をご覧ください。
- [NCCからの発表(2024年4月16日)] 当分野と研究所ゲノム生物学研究分野・東京医科歯科大学などとの共同研究成果がJournal of Thoracic Oncology誌に掲載されました。詳しくは" こちら"をご覧ください。
- [NCCからの発表(2024年3月5日)] 当分野の研究成果がExperimental & Molecular Medicine誌に掲載されました。詳しくは"こちら"をご覧ください。
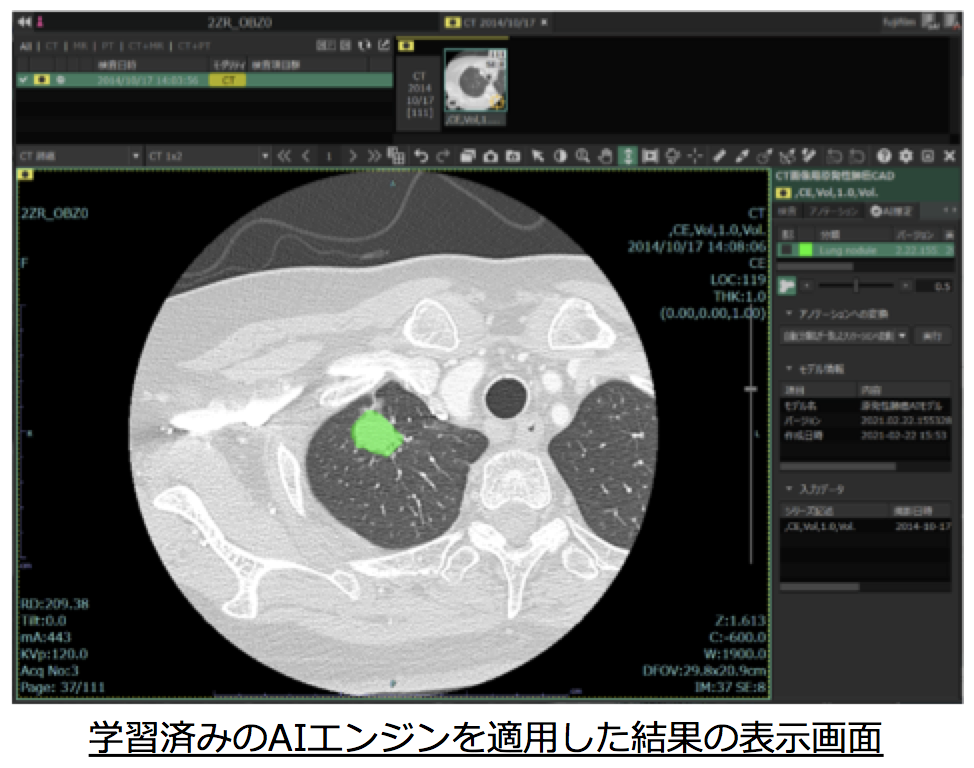
- [NCCからの発表(2024年2月28日)] 当分野と中央病院・脳脊髄腫瘍科、中央病院・放射線診断科及び富士フイルム社との共同研究成果が薬機法における認証を取得し製品化されました。詳しくは"こちら"をご覧ください。
- [お知らせ(2024年1月25日)] 当分野・分野長の浜本が、2024年2月20日に内閣府(科学技術・イノベーション推進事務局)が主催して開催される、SIP/BRIDGEシンポジウム2024に登壇いたします。詳しくは" こちら"(外部サイトへリンクします)をご覧ください。
- [お知らせ(2024年1月12日)] 当分野・分野長の浜本が「日本学術会議・公開シンポジウム」に登壇しました。詳しくは”こちら”(外部サイトへリンクします)をご覧ください。
- [NCCからの発表(2023年12月22日)] 当分野の研究成果がMedical Image Analysis誌に掲載されました。詳しくは"こちら"をご覧ください。
- [NCCからの発表(2023年11月8日)] 当分野メンバーが参加した多施設共同研究の成果がCancer Communications誌に掲載されました。詳しくは"こちら"をご覧ください。
- [理化学研究所主導の共同発表(2023年10月4日)] 当分野のメンバーが主導した国際共同研究グループによる研究成果が、Experimental & Molecular Medicine誌に発表されました。詳しくは"こちら"をご覧ください。
- [NCCからの発表(2023年9月7日)] 当分野と研究所・ゲノムストレス応答学ユニットなどとの共同研究成果がNature Communications誌に発表されました。詳しくは"こちら"をご覧ください。
- [お知らせ(2023年7月12日)] 当分野と理化学研究所革新知能統合研究センターとの共同研究成果が、医用画像処理のトップカンファレンスであるThe 26th International Conference on Medical Image Computing and Computer Assisted Intervention(MICCAI 2023)に早期採択(上位10.4%)されました。詳しくは"こちら"(外部サイトへリンクします)をご覧ください。
- [NCCからの発表(2023年7月10日)] 当分野・分野長の浜本が研究総括(PM:プログラムマネージャー)として、内閣府のBRIDGE対象施策「医療デジタルツインの発展に資するデジタル医療データバンク構想」事業を推進いたします。詳しくは"こちら"をご覧ください。
- [NCCからの発表(2023年6月9日)] 当分野・分野長の浜本が参加した多施設共同研究の成果がNature Communications誌に掲載されました。詳しくは"こちら"をご覧ください。
- [帝京大学主導の発表(2023年5月24日)]当分野と帝京大学先端総合研究機構・岡本康司教授、及び国立がん研究センター・中釜斉理事長との共同研究成果がCell Reports誌に掲載されました。詳しくは"こちら"をご覧ください。
- [NCCからの発表(2023年4月21日)]当分野・分野長の浜本が「日本医学会総会2023東京博覧会 市民公開セッション」に登壇しました。詳しくは"こちら"をご覧ください。
-
[お知らせ(2022年6月6日)]当分野・分野長の浜本が連携大学院教員を併任している東京医科歯科大学との共同研究成果がプレスリリースされました。詳しくは"AI及びリモートテクノロジーを用いた心房細動の早期発見により清水区を脳梗塞の少ないまちにする地域医療プロジェクト(略称SPAFS)"(外部サイトへリンクします)をご覧ください。
- [お知らせ(2022年4月5日)]当分野と富士フイルムとの共同研究成果が社会実装され、富士フイルムからプレスリリースされました。詳しくは"こちら"(外部サイトへリンクします)をご覧ください。
-
[理化学研究所主導の発表(2022年3月22日)]当分野と理化学研究所革新知能統合研究センター及び昭和大学医学部との共同研究成果が、理化学研究所からプレスリリースされました。詳しくは"説明可能AIを用いた超音波画像診断支援-胎児心臓超音波スクリーニングへの臨床応用に期待-"をご覧ください。
-
[理化学研究所主導の共同発表(2022年2月7日)]当分野のメンバーが主導した国際共同研究グループによる研究成果がプレスリリースされました。詳しくは"卵巣がんの新しい治療標的を同定-がん研究に医療ビッグデータとコンピュータ科学を活用-"をご覧ください。
- [NCCからの発表(2021年10月2日)]分野長の浜本が、中央病院内視鏡科の山田真善先生及び斎藤豊先生と共同でJCA-CHAAO賞を受賞しました。詳細はこちらをご覧ください。
- [NCCからの発表(2021年4月16日)]当分野と富士フィルム、中央病院放射線診断科及び脳脊髄腫瘍科との共同研究がプレスリリースされました。詳しくは"富士フィルムと国立がん研究センターが「AI開発支援プラットフォーム」を共同開発"をご覧ください。
- [お知らせ(2021年4月1日)]分野名をがん分子修飾制御学分野から医療AI研究開発分野に改名いたしました。
- [NCCからの発表(2021年1月12日)]当分野と中央病院内
視鏡科との共同研究成果がプレスリリースされました。
詳しくは”国立がん研究センターと日本電気株式会社が共同開発した内視鏡AI診断支援医療機器ソフトウェア「WISE VISION 内視鏡画像解析AI」医療機器承認 ”をご覧ください。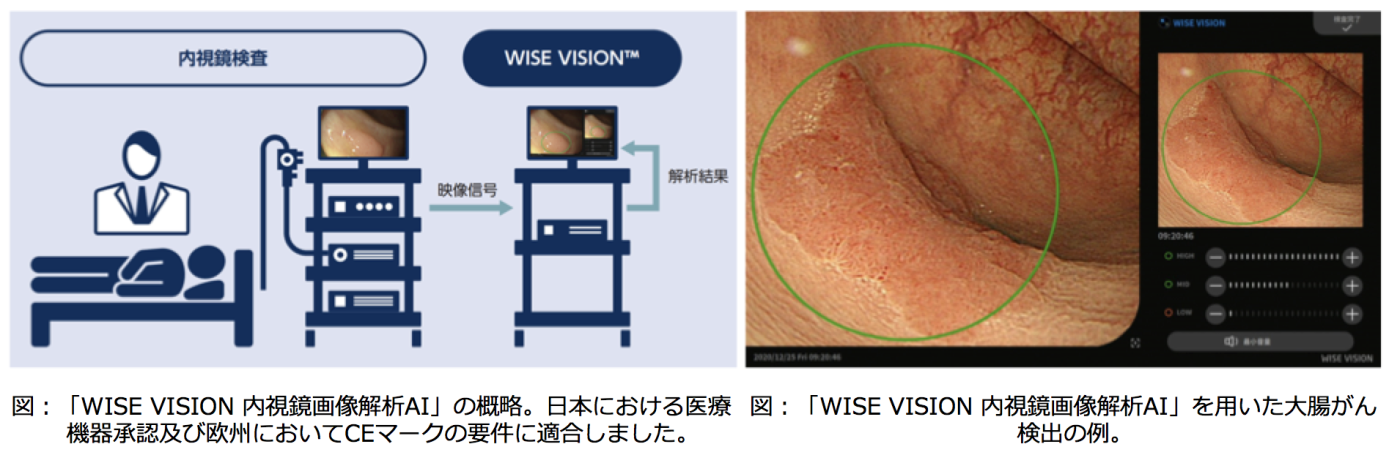
- [お知らせ(2020年8月27日)]医歯薬出版様から要請を受けまして分野長の浜本が企画した、医学のあゆみ誌274巻9月号が刊行されました。
詳しくは"AIが切り拓く未来の医療"(外部サイトへリンクします)をご覧ください。 -
[お知らせ(2019年9月20日)]羊土社様から要請を受けま
して分野長の浜本が企画した、実験医学誌2019年10月号が刊 行されました。
詳しくは”AIとがん研究”(外部サイトへリンクします)をご覧ください。 - [NCCからの発表(2019年9月5日)]当分野と研究所 発がん・予防研究分野の共同研究がNature Communications誌に発表されました。
詳しくは"老化に起因した発がんメカニズムの一部解明 がん発生予防の可能性を示唆"をご覧ください。 -
[NCCからの発表(2019年7月26日)]当分野と理化学研究所、富士通株式会社、昭和大学との共同研究がプレスリリースされました。
詳しくは、"ラベルなしデータ学習で胎児心臓スクリーニング技術に進展"をご覧ください。
まず、元の超音波画像と人工影を合成し、人工影を合成した入力画像を作成する。その入力画像をオートエンコーダにより、影のみ画像と構造物のみ画像に分離した後、それらを合成して入力画像を再構成する。赤枠の部分がオートエンコーダを示しており、エンコーダが入力画像から特徴量を抽出し、デコーダが特徴量から入力画像を復元する役割をする。学習後に影を検出する際には、入力画像を超音波検査画像とし、影のみ画像を検出結果とする。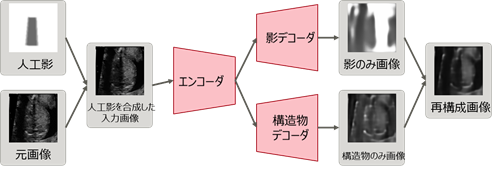
ラベルなしデータで超音波画像の影を学習するモデル -
[お知らせ(2018年8月9日)]国立研究開発法人・科学技術振興機構が推進する、戦略的創造研究推進事業・AIP加速PRISM研究課題に、分野長の浜本を研究代表とする研究課題“人工知能技術を活用した革新的ながん創薬システムの開発”が採択されました。詳しくはこちら(外部サイトへリンクします)をご覧ください。
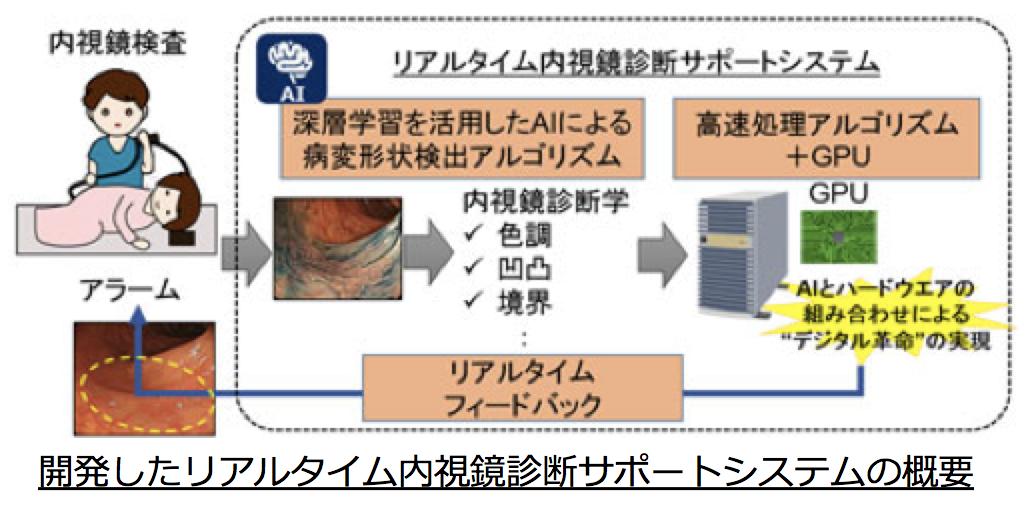
- [NCCからの発表(2017年7月10日)] 中央病院・内視鏡科との共同研究成果がプレスリリースされました。"AIを活用したリアルタイム内視鏡診断サポートシステム開発 大腸内視鏡検査での見逃し回避を目指す"をご覧ください。
- [NCCからの発表(2016年11月29日)] 分野長の浜本が研究代表者の研究課題が、平成28年度戦略的創造研究推進事業(CREST)に採択されました。"人工知能(AI)を活用した統合的がん医療システム 開発プロジェクト開始"をご覧ください。
研究室の紹介
近年深層学習を中心とした機械学習技術の進歩、安価で性能の高いGPUが開発されたこと、また公共データベースの拡充によりビッグデータの利活用が可能になってきたことなどを理由に、人工知能(AI)技術への期待が高まっております。実際、空港の顔認証や自動翻訳、また自動運転など社会において幅広くAI技術は既に活用されております。医療分野も例外ではなく、米国においては多くのAI搭載医療機器がFDAにより承認を受けており、本邦においても、我々の研究成果を含め複数のAI搭載医療機器が薬事承認を受けております。その潜在能力の高さからAI研究開発に関しては、米国や中国などの世界列強国が鎬を削って研究開発を進めており、その競争は年々激化しております。我が国においても、2016年1月に閣議決定された第5期科学技術基本計画の中で、Society 5.0という目標とすべき新しい社会のコンセプトが発表され、その目標達成に向けてAI技術を基盤技術として活用していくことが明文化されており、政府の方針としてAI開発は重点領域の一つとして認識されております。このような状況下、我々は日本国内に先駆けて2016年に大型医療AI研究開発プロジェクト“人工知能を活用した統合的ながん医療システムの開発”プロジェクトを開始いたしました。本研究プロジェクトはJSTの戦略的創造推進事業CRESTの1課題として推進され、2018年からは内閣府主導の官民投資拡大プログラム(PRISM)“新薬創出を加速する人工知能の開発”プロジェクトがアドオンされ現在に至っております。この間に、世界に先駆ける形でAIを用いたリアルタイム内視鏡診断サポートシステムを開発し、またAI解析を志向した世界最大規模の肺がん統合データベースを構築するなど、複数の重要な研究成果を発表して参りました。特にAIを用いたリアルタイム内視鏡診断サポートシステムに関しましては、2020年に日本において医療機器承認をうけ(承認番号:30200BZX00382000)、また欧州においても医療機器製品の基準となるCEマークの要件に適合し、現在日本及び欧州において実地臨床で使用されております。我々が大切にしておりますのは、“研究のための研究”に陥ることなく、常に“患者さんのための研究”を行うことで、質の高い国際誌に原著論文を発表すると同時に、実臨床応用を大変重要視しております。“職員の全ての活動はがん患者の為に!”という国立がん研究センターのスローガンを大変尊重しておりますので、がん患者さんのために研究を行いたいという熱意をお持ちで当分野の研究に興味をお持ちの方は、浜本までご連絡いただけますと幸甚です。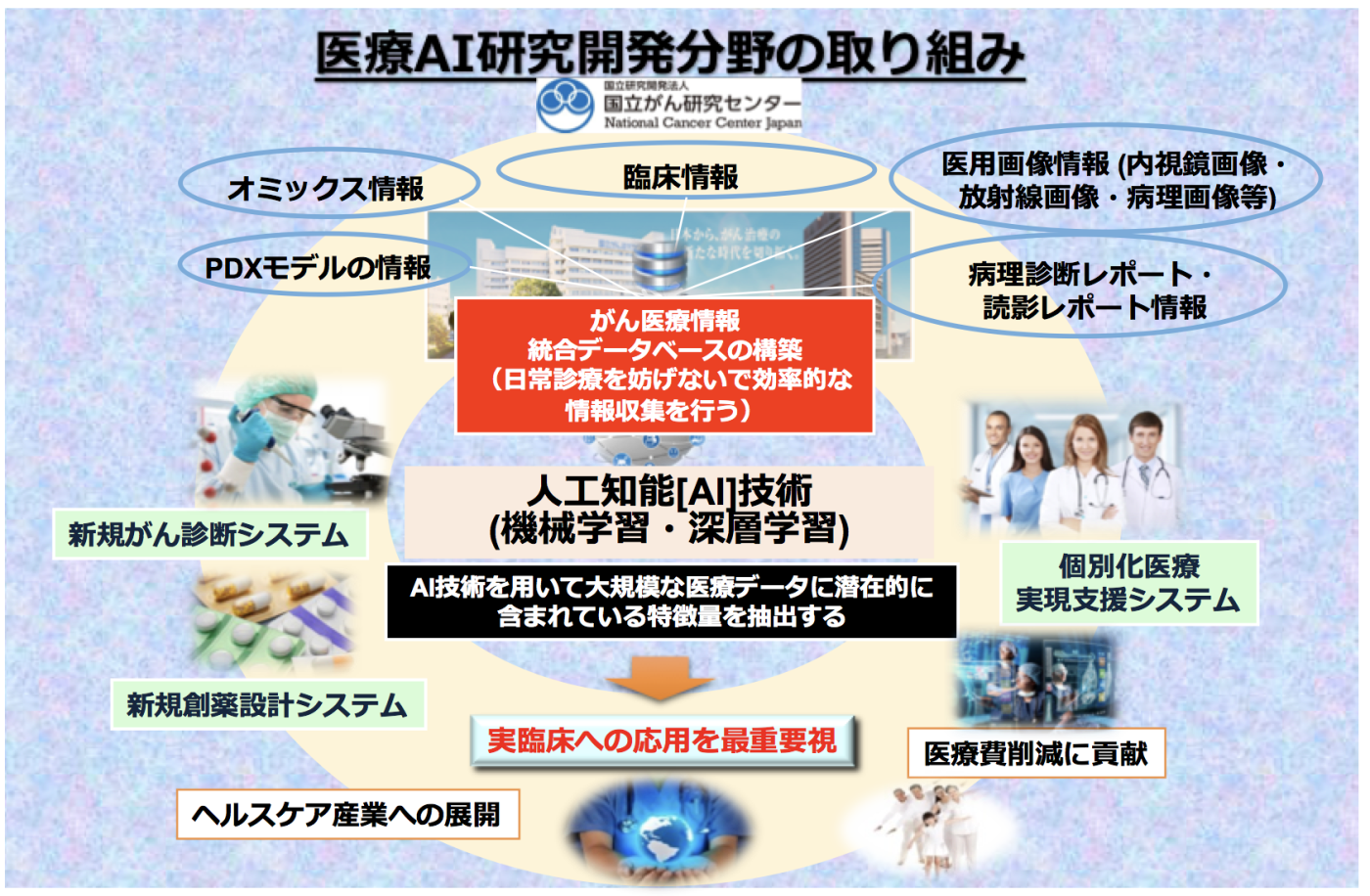
参考文献
- Akifumi Mochizuki, Kouya Shiraishi, Takayuki Honda, Ryoko Inaba Higashiyama, Kuniko Sunami, Maiko Matsuda, Yoko Shimada, Yasunari Miyazaki, Yukihiro Yoshida, Shun-Ichi Watanabe, Yasushi Yatabe, Ryuji Hamamoto, Takashi Kohno: Passive Smoking-Induced Mutagenesis as a Promoter of Lung Carcinogenesis. Journal of Thoracic Oncology, Online ahead of print [PubMed](外部サイトにリンクします)
- Ken Takasawa, Ken Asada, Syuzo Kaneko, Kouya Shiraishi, Hidenori Machino, Satoshi Takahashi, Norio Shinkai, Nobuji Kouno, Kazuma Kobayashi, Masaaki Komatsu, Takaaki Mizuno, Yu Okubo, Masami Mukai, Tatsuya Yoshida, Yukihiro Yoshida, Hidehito Horinouchi, Shun-Ichi Watanabe, Yuichiro Ohe, Yasushi Yatabe, Takashi Kohno, Ryuji Hamamoto: Advances in cancer DNA methylation analysis with methPLIER: Use of non-negative matrix factorization and knowledge-based constraints to enhance biological interpretability. Experimental & Molecular Medicine, 56, 646-655 (2024) [PubMed](外部サイトにリンクします)
- Kazuma Kobayashi, Lin Gu, Ryuichiro Hataya, Takaaki Mizuno, Mototaka Miyake, Hirokazu Watanabe, Masamichi Takahashi, Yasuyuki Takamizawa, Yukihiro Yoshida, Satoshi Nakamura, Nobuji Kouno, Amina Bolatkan, Yusuke Kurose, Tatsuya Harada, Ryuji Hamamoto: Sketch-based semantic retrieval of medical images. Medical Image Analysis, 92, 103060 (2024) [PubMed](外部サイトにリンクします)
- Hidenori Machino, Ai Dozen, Mariko Konaka, Masaaki Komatsu, Kohei Nakamura, Noriko Ikawa, Kanto Shozu, Ken Asada, Syuzo Kaneko, Hiroshi Yoshida, Tomoyasu Kato, Kentaro Nakayama, Vassiliki Saloura, Satoru Kyo, Ryuji Hamamoto: Integrative analysis reveals early epigenetic alterations in high-grade serous ovarian carcinomas: Experimental & Molecular Medicine, 55, 2205-2219 (2023) [PubMed](外部サイトにリンクします)
- Taichi Igarashi, Marianne Mazevet, Takaaki Yasuhara, Kimiyoshi Yano, Akifumi Mochizuki, Makoto Nishino, Tatsuya Yoshida, Yukihiro Yoshida, Nobuhiko Takamatsu, Akihide Yoshimi, Kouya Shiraishi, Hidehito Horinouchi, Takashi Kohno, Ryuji Hamamoto, Jun Adachi, Lee Zou, Bunsyo Shiotani: An ATR-PrimPol pathway confers tolerance to oncogenic KRAS-induced and heterochromatin-associated replication stress. Nature Communications, 14, 4991 (2023) [PubMed](外部サイトにリンクします)
- Ryuji Hamamoto, Takafumi Koyama, Nobuji Kouno, Tomohiro Yasuda, Shuntaro Yui, Kazuki Sudo, Makoto Hirata, Kuniko Sunami, Takashi Kubo, Ken Takasawa, Satoshi Takahashi, Hidenori Machino, Kazuma Kobayashi, Ken Asada, Masaaki Komatsu, Syuzo Kaneko, Yasushi Yatabe, Noboru Yamamoto: Introducing AI to the molecular tumor board: one direction toward the establishment of precision medicine using large-scale cancer clinical and biological information.Experimental Hematology & Oncology, 11, 82 (2022) [PubMed](外部サイトにリンクします)
- Ryuji Hamamoto, Ken Takasawa, Hidenori Machino, Kazuma Kobayashi, Satoshi Takahashi, Amina Bolatkan, Norio Shinkai, Akira Sakai, Rina Aoyama, Masayoshi Yamada, Ken Asada, Masaaki Komatsu, Koji Okamoto, Hirokazu Kameoka, Syuzo Kaneko: Application of non-negative matrix factorization in oncology: one approach for establishing precision medicine. Briefings in Bioinformatics, 23, bbac246 (2022) [PubMed](外部サイトにリンクします)
- Kazuma Kobayashi, Ryuichiro Hataya, Yusuke Kurose, Mototaka Miyake, Masamichi Takahashi, Akiko Nakagawa, Tatsuya Harada, Ryuji Hamamoto: Decomposing normal and abnormal features of medical images for content-based image retrieval of glioma imaging. Medical Image Analysis, 74, 102227 (2021) [PubMed](外部サイトにリンクします)
- Masayoshi Yamada, Yutaka Saito, Hitoshi Imaoka, Masahiro Saiko, Shigemi Yamada, Hiroko Kondo, Hiroyuki Takamaru, Taku Sakamoto, Jun Sese, Aya Kuchiba, Taro Shibata, Ryuji Hamamoto: Development of a real-time endoscopic image diagnosis support system using deep learning technology in colonoscopy. Scientific Reports,9, 14465 (2019) [PubMed](外部サイトにリンクします)
- Yusuke Matsuno, Yuko Atsumi, Atsuhiro Shimizu, Kotoe Katayama, Haruka Fujimori, Mai Hyodo, Yusuke Minakawa, Yoshimichi Nakatsu, Syuzo Kaneko, Ryuji Hamamoto, Teppei Shimamura, Satoru Miyano, Teruhisa Tsuzuki, Fumio Hanaoka, Ken-ichi Yoshioka: Replication stress triggers microsatellite destabilization and hypermutation leading to clonal expansion in vitro. Nature Communications,10, 3925 (2019) [PubMed](外部サイトにリンクします)
- Ryuji Hamamoto, Vassiliki Saloura, Yusuke Nakamura: Critical roles of non-histone protein lysine methylation in human tumorigenesis. Nature Reviews Cancer,15 (2), 110-124 (2015) [PubMed](外部サイトにリンクします)
- Kenbun Sone, Lianhua Piao, Makoto Nakakido, Koji Ueda, Yataro Daigo, Thomas Jenuwein, Yusuke Nakamura, Ryuji Hamamoto: Critical role of lysine 134 methylation on histone H2AX for γ-H2AX production and DNA repair. Nature Communications, 5, 5691 (2014) [PubMed](外部サイトにリンクします)
- Syuzo Kaneko, Roberto Bonasio, Ricardo Saldaña-Meyer, Takahaki Yoshida, Jinsook Son, Koichiro Nishino, Akihiro Umezawa, Danny Reinberg: Interactions between JARID2 and noncoding RNAs regulate PRC2 recruitment to chromatin. Molecular Cell,53 (2), 290-300 (2014) [PubMed](外部サイトにリンクします)
- Syuzo Kaneko, Jinsook Son, Roberto Bonasio, Steven S. Shen, Danny Reinberg: Nascent RNA interaction keeps PRC2 activity poised and in check. Genes & Development,28 (18), 1983-1988 (2014) [PubMed](外部サイトにリンクします)
- Syuzo Kaneko, Jinsook Son, Steven S Shen, Danny Reinberg, Roberto Bonasio: PRC2 binds active promoters and contacts nascent RNAs in embryonic stem cells. Nature Structural & Molecular Biology,20, 1258-1264 (2013) [PubMed](外部サイトにリンクします)
- Hyun-Soo Cho, Tadahiro Shimazu, Gouji Toyokawa, Yataro Daigo, Yoshihiko Maehara, Shinya Hayami, Akihiro Ito, Ken Masuda, Noriko Ikawa, Helen I. Field, Eiju Tsuchiya, Shin-ichi Ohnuma, Bruce A.J. Ponder, Minoru Yoshida,Yusuke Nakamura, Ryuji Hamamoto: Enhanced HSP70 lysine methylation promotes proliferation of cancer cells through activation of aurora kinase B. Nature Communications, 3, 1072 (2012) [PubMed](外部サイトにリンクします)
- Kyohei Arita, Shin Isogai, Takashi Oda, Motoko Unoki, Kazuya Sugita, Naotaka Sekiyama, Keiko Kuwata, Ryuji Hamamoto, Hidehito Tochio, Mamoru Sato, Mariko Ariyoshi, Masahiro Shirakawa: Recognition of modification status on a histone H3 tail by linked histone reader modules of UHRF1. Proc Natl Acad Sci USA,109 (32), 12950-12955 (2012) [PubMed](外部サイトにリンクします)
- Gouji Toyokawa, Ken Masuda, Yataro Daigo, Hyun-Soo Cho, Masanori Yoshimatsu, Masashi Takawa, Shinya Hayami, Kazuhiro Maejima, Makoto Chino, Helen I. Field, David E. Neal, Eijyu Tsuchiya, Bruce A.J. Ponder, Yoshihiko Maehara, Yusuke Nakamura, Ryuji Hamamoto: Minichromosome Maintenance Protein 7 is a potential therapeutic target in human cancer and a novel prognostic marker of non-small cell lung cancer. Molecular Cancer, 10, 65 (2011) [Pubmed](外部サイトにリンクします)
- Shinya Hayami, Masanori Yoshimatsu, Abhimanyu Veerakumarasivam, Motoko Unoki, Yukiko Iwai, Tatsuhiko Tsunoda, Helen I. Field, John D. Kelly, David E. Neal, Hiroki Yamaue, Bruce A.J. Ponder, Yusuke Nakamura, Ryuji Hamamoto: Overexpression of the JmjC histone demethylase KDM5B in human carcinogenesis: involvement in the proliferation of cancer cells through the E2F/RB pathway. Molecular Cancer, 9, 59 (2010) [Pubmed](外部サイトにリンクします)
- Syuzo Kaneko, Gang Li, Jinsook Son, Chong-Feng Xu, Raphael Margueron, Thomas A. Neubert, Danny Reinberg: Phosphorylation of the PRC2component Ezh2 is cell cycle-regulated and up-regulates its binding to ncRNA. Genes & Development, 24 (23), 2615-2620 (2010) [PubMed](外部サイトにリンクします)
- Ryuji Hamamoto, Yoichi Furukawa, Masashi Morita, Yumiko Iimura, Fabio Pittella Silva, Meihua Li, Ryuichiro Yagyu, Yusuke Nakamura: SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells. Nature Cell Biology,6 (8), 731-740 (2004) [PubMed](外部サイトにリンクします)





