トップページ > 診療科・共通部門 > 内科系 > 血液腫瘍科 > HM-SCREEN-Japan02
HM-SCREEN-Japan02
研究の目的
日本人の急性骨髄性白血病患者を対象として遺伝子検査を行った先の研究(HM-SCREEN-JAPAN01試験)では、FLT3変異以外にも将来的に治療のターゲットとなりうる変異(IDH1/IDH2やNPM1、MLL再構成など)や、予後予測に重要な遺伝子変異(TP53やRAS経路関連遺伝子など)がそれぞれ2~3割の頻度で検出されており、遺伝子検査によって多くの貴重な情報が得られることが示唆されました。ただし、先の研究では検査開始から結果が得られるまでおよそ1ヶ月を要しており、病期の進行の速い急性骨髄性白血病において、その遺伝子情報をリアルタイムに臨床に生かすことは困難でした。
そこで今回、検査する対象遺伝子を53個に絞り、より短い期間で結果を報告することのできる新たな遺伝子検査キットを、AmoyDx社がもつシークエンス技術を基盤として国立がん研究センター東病院と共同で開発しました。このキットはまだ製品化されておりませんが、中国人の急性骨髄性白血病患者の検体を用いた性能評価において十分な検出能力があることが確認されており、日本人患者の検体を用いた予備試験においても同等の結果が得られております。また、この検査技術は日本のSRL(エスアールエル)社に移管され、日本国内で検査することができます。本研究では、この遺伝子検査キットを用いて遺伝子変異情報を迅速に知らせることで、診断をより正確に行うことの手助けとなるかどうかをしらべることが目的です。
研究の概要
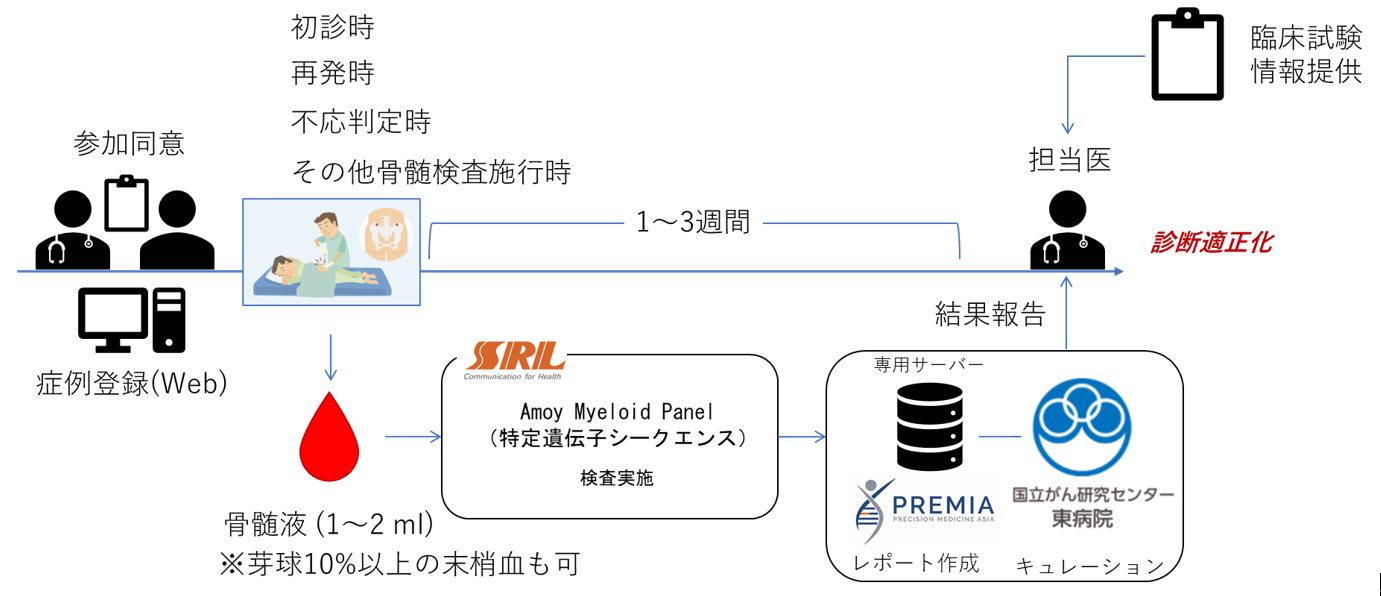
本研究は、研究許可日以降、約200名(解析不能・失敗例を含む)の方に参加していただく予定です。
登録期間は、国立がん研究センターの許可日から2024年3月31日までを予定しています。また研究全体の期間は、国立がん研究センターの研究許可日から2025年3月31日までを予定しています。
本研究では、診断もしくは治療中に採取した骨髄液を用います。日常臨床で必要な検体量に微量を上乗せして採取します(通常診療で10~20mlの骨髄液を採取するのに対し、研究用に1~2 mlを上乗せします)。複数の時点で採取された骨髄液を研究に用いる場合もあります。なお、骨髄液の採取が難しい場合、末梢血中に10%以上の芽球が含まれている場合はそちらの提出も可能です。検体は各参加施設よりSRL社により回収され、概ね3週間以内に専用サーバー(PREMIA社管理)よりレポートが作成されます。作成されたレポートは国立がん研究センター東病院にはキュレーションされのち、各担当医に報告されます。また、AMLに関する臨床試験情報を定期的に配信し、患者の治療方針決定に際し参考にしてもらうことを意図します。
また本研究では、登録患者さんが同種移植を受けた場合に、日本造血細胞移植データセンターが管理する「移植登録一元管理プログラム(TRUMP)」の登録データを利用させていただきます。TRUMP は、日本造血・免疫細胞療法移植学会及び日本造血細胞移植データセンターが実施する、造血細胞移植患者さんを対象とした「造血細胞移植および細胞治療の全国調査」に用いられているweb 入力プログラムです。この全国調査は、日本における造血細胞移植の実状や患者さんの治療状況を把握し、得られたデータから移植後予後や要因分析を行い、移植成績の向上を目指すことを目的としています。
Amoy DX (R) Myeloid Blood Cancer Panel
Amoy Dx® Myeloid Blood Cancer Panel (略称Amoy Myeloid Panel)はAmoyDx社によって開発された、HANDLEシステム(halo-shape annealing and defer-ligation enrichment system)を用いたゲノムシークエンス技術です。
シークエンス対象遺伝子
ABL1, ASXL1, BCOR, BRAF, CALR, CBFB, CBL, CEBPA, CREBBP, CSF3R, CTCF, DIS3, DNMT3A, ETV6, EZH2, FBXW7, FLT3, GATA1, GATA2, IDH1, IDH2, IKZF1, JAK2, JAK3, KIT, KMT2A, KRAS, MAX, MLLT10, MPL, MYC, MYD88, NF1, NPM1, NRAS, NUP98, PDGFRA, PHF6, PML, PTPN11, RB1, RIT1, RUNX1, SET, SETBP1, SF3B1, SRSF2, STAG2, TET2, TP53, U2AF1, WT1, ZRSR2 (全53 項目)
注)強調された遺伝子は融合遺伝子を含む
上記のうち融合遺伝子を含むもの(パートナー遺伝子を併記)
- ABL1: BCR
- CBFB: MYH11
- CREBBP: KAT6A
- ETV6: NTRK3, PDGFRB, ABL1, MN1
- JAK2: BCR, PCM1
- KMT2A: ABI1, ABI2, AFDN, AFF1, AFF4, ARHGAP26, ARHGEF12, CBL, CEP170B,
CIP2A, CREBBP, DAB2IP, ELL, EP300, EPS15, KNL1, LASP1, LPP, MLLT1,
MLLT10, MLLT11, MLLT3, MLLT6, MYO1F, PDS5A, PICALM, SARNP, SEPT2,
SEPT6, SEPT9, SH3GL1, SORBS2, TET1, TOP3A, ZFYVE19
注)PTD(partial tandem duplication)を含む - MLLT10: PICALM
- NUP98: NSD1, HOXA9, KDM5A
- PML: RARA
- RUNX1: RUNX1T1, MECOM
- SET: NUP214
臨床試験情報
医師主導試験
[試験名]
CD116陽性急性骨髄性白血病および若年性骨髄単球性白血病を対象とする非ウイルス遺伝子改変GMR CAR-T細胞のFIH医師主導治験
[試験状況]
募集中 (2022年3月24日現在)
企業治験
[試験名]
Mixed Lineage Leukemia(MLL)再構成又はNucleophosmin 1(NPM1)変異が陽性又は陰性の成人急性白血病患者を対象としたDSP-5336 の非盲検、用量漸増、用量拡大第01月02日相臨床試験(簡易名:成人急性白血病患者を対象としたDSP-5336の臨床試験)
[試験状況]
募集中 (2022年3月24日現在)
[関連リンク]
臨床研究実施計画・研究概要公開システム(jRCT)(外部サイトにリンクします)
問い合わせ先
研究代表者
南 陽介 Minami Yosuke
国立がん研究センター東病院 血液腫瘍科 科長
連絡先:〒277-8577 千葉県柏市柏の葉6-5-1
TEL:04-7133-1111(内線5603)
FAX:04-7133-6502(直通)
E-mail:yominami@east.ncc.go.jp