トップページ > グループ紹介 > 新薬開発分野(柏) > 主な研究内容
主な研究内容
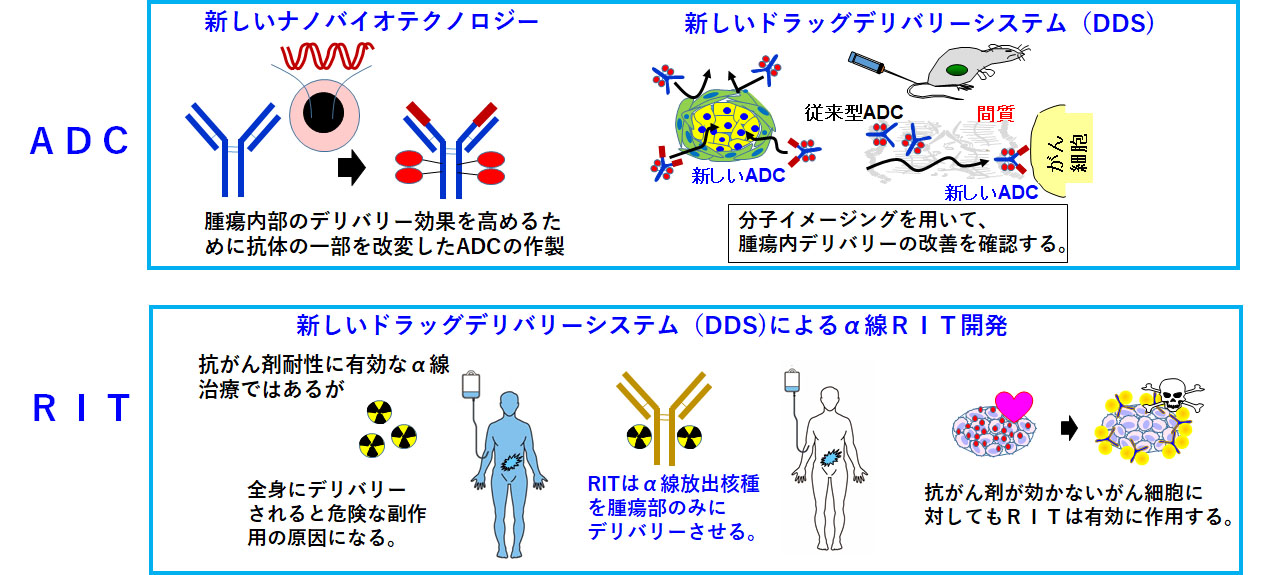
DDS・分子イメージングを駆使した武装化抗体(ADC, RIT)の開発
抗体医薬、Antibody-drug conjugate (ADC)を中心とした次世代抗体医薬の臨床応用は進んでいますが、膵臓がん・スキルス胃がんなどの難治性がんへの応用は達成できていません。これまで、豊富な間質が抗体デリバリーを障害していること(=間質バリア)を報告してきました。そこで、間質バリアを突破して抗体自体をがん細胞へ直接送り届ける方法の開発も必要です。他方、抗体の抗原親和性のパラメーターは結合速度定数と解離速度定数からなりますが、解離速度定数を調節することで腫瘍内の抗体浸透性を改善できます。以上の背景のもとに、抗体工学を中心としたナノバイオテクノロジーを導入して、膵臓がん・スキルス胃がんの豊富な間質においても浸透可能な抗体開発に取り組んでいきます。抗体浸透性の評価には分子イメージングが有用です。また、難治性・再発性のがん細胞自体が、抗がん剤に抵抗性であることも想定されます。この問題に対しては、高いエネルギーと線形エネルギー移動を持ち、殺細胞効果が高く抗がん剤抵抗性のがん細胞への有効性が期待されているα線Radioimmunotherapy(RIT)の応用が有用と思われます。このように、様々な分野の専門家とも協力して、新しいADCやRITの創薬を進めていきます。
【Reference】
- Yasunaga M, Manabe S, Matsumura Y. CAST therapy. In Matsumura, Y. and Tarin, D. (Eds.), Cancer Drug Delivery Systems Based on the Tumor Microenvironment. Springer. 269-288, 2019.
- Koga Y, Tsumura R, Matsumura Y. Preclinical Studies of ADC Therapy for Solid Tumors. Cancer Drug Delivery Systems Based on the Tumor Microenvironment. Springer. 125-154, 2019.
- Tsumura R, Manabe S, Takashima H, Koga Y, Yasunaga M, Matsumura Y. Evaluation of the antitumor mechanism of antibody-drug conjugates against tissue factor in stroma-rich allograft models. Cancer Sci. 2019 110(10): 3296-3305.
- Fuchigami H, Manabe S, Yasunaga M, Matsumura Y. Chemotherapy payload of anti-insoluble fibrin antibody-drug conjugate is released specifically upon binding to fibrin. Sci Rep. 8, 14211-14219. 2018.
- Tsumura R, Manabe S, Takashima H, Koga Y, Yasunaga M, Matsumura Y. Influence of the dissociation rate constant on the intra-tumor distribution of antibody-drug conjugate against tissue factor. J Control Release. 284, 49-56. 2018.
- Tsumura R, Sato R, Furuya F, Koga Y, Yamamoto Y, Fujiwara Y, Yasunaga M, Matsumura Y. Feasibility study of the Fab fragment of a monoclonal antibody against tissue factor as a diagnostic tool. Int J Oncol. 47, 2107-14. 2015.
- Koga Y, Manabe S, Aihara Y, Sato R, Tsumura R, Iwafuji H, Furuya F, Fuchigami H, Fujiwara Y, Hisada Y, Yamamoto Y, Yasunaga M, Matsumura Y. Antitumor effect of antitissue factor antibody-MMAE conjugate in human pancreatic tumor xenografts. Int J Cancer. 37, 1457-66. 2015.
- 安永正浩 DDS(ドラッグデリバリーシステム)UPDATE 抗体薬物複合体(ADC) 医学のあゆみ 267, 511‐518. 2018.
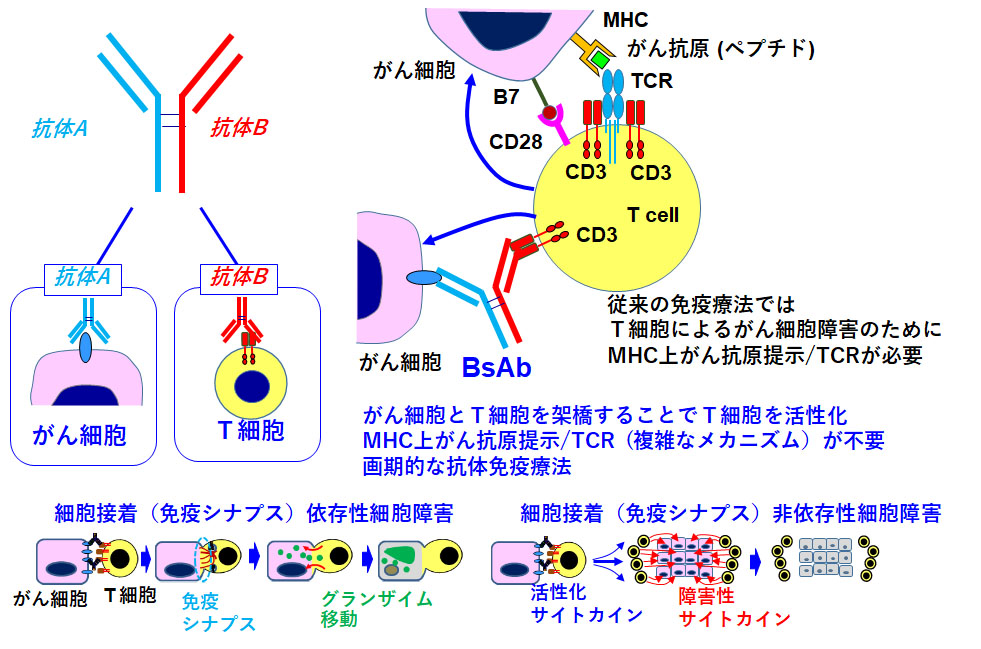
2重特異性抗体(BsAb)の臨床応用性を高めるためのT細胞制御法の開発
世界中で約50種類のBsAbの臨床試験が行われていますが、承認されたBsAbは血液性悪性腫瘍のみで、固型腫瘍への応用はスタック(停滞)しています。武装化抗体のADCやRITの最終的な薬効は付加薬剤や放射性核種に依存しています。一方、BsAbに関しては、最終的な薬効は腫瘍局所にリダイレクションされたT細胞に依存しています。すなわちBsAbそのものに加えて宿主のT細胞の状態に大きく左右されることになります。BsAb自体の技術開発力のみでは不十分で、医学・医療サイドのT細胞制御という面からの研究開発力が必要とされます。したがって、T細胞の状態をいかに制御できるかが大きな鍵になります。そこで、大きく立ちはだかっているのが、腫瘍内T細胞砂漠と疲弊の問題です。いずれも、BsAbが薬効をコンスタントに示すためには、克服すべき重要な課題です。そこで、これらの問題を克服可能なT細胞制御法の開発を進めていきます。抗体工学と細胞生物学に加えて、遺伝子工学も融合して、T細胞の時空間制御(T細胞のDDS化)の技術開発に挑戦していきます。
【Reference】
- Kamakura D, Asano R, Kawai H, Yasunaga M. Mechanism of action of a T cell-dependent bispecific antibody as a breakthrough immunotherapy against refractory colorectal cancer with an oncogenic mutation. Cancer Immunol Immunother. 2020.
- 安永正浩 新しいdrug delivery system. がん分子標的治療 メジカルレビュー社 2019;17(2):50-57
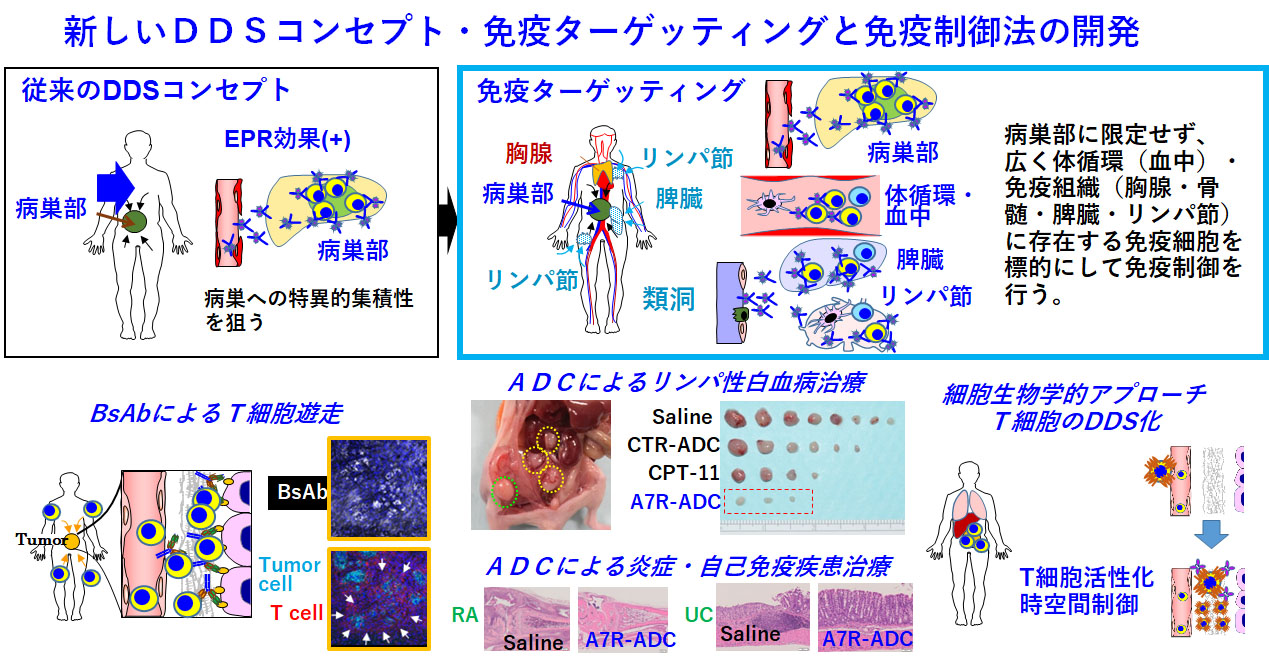
新しいDDSコンセプトとしての免疫ターゲッティングと免疫制御法の開発
従来のDDSコンセプトでは、EPR効果により高分子製剤の腫瘍部への選択的集積性を狙っていましたが、免疫ターゲッティングでは、腫瘍部に限らず、体循環・血中や胸腺・骨髄・リンパ節・脾臓などの免疫系組織中の免疫細胞を標的にして、免疫制御を行うというものです。BsAbによるT細胞の腫瘍局所へのT細胞ディレクションも、一種の免疫ターゲッティング・免疫制御法と考えています。さらに、抗IL-7R抗体のADCでは、リンパ球のホーミング機能や細胞内シグナルなどを特異的に抑制することで、白血病や炎症・自己免疫疾患への治療応用が期待できると考えています。BsAbプロジェクトと重複しますが、T細胞のDDS化(T細胞活性化の時空間制御法)も重要な課題と考えています。
【Reference】
- Yasunaga M. Antibody therapeutics and immunoregulation in cancer and autoimmune disease. Semin Cancer Biol. 64, 1-12. 2020.
- Yasunaga M, Manabe S, Matsumura Y. Immunoregulation by IL-7R-targeting antibody-drug conjugates: overcoming steroid-resistance in cancer and autoimmune disease. Sci Rep. 7, 10735. 2017.
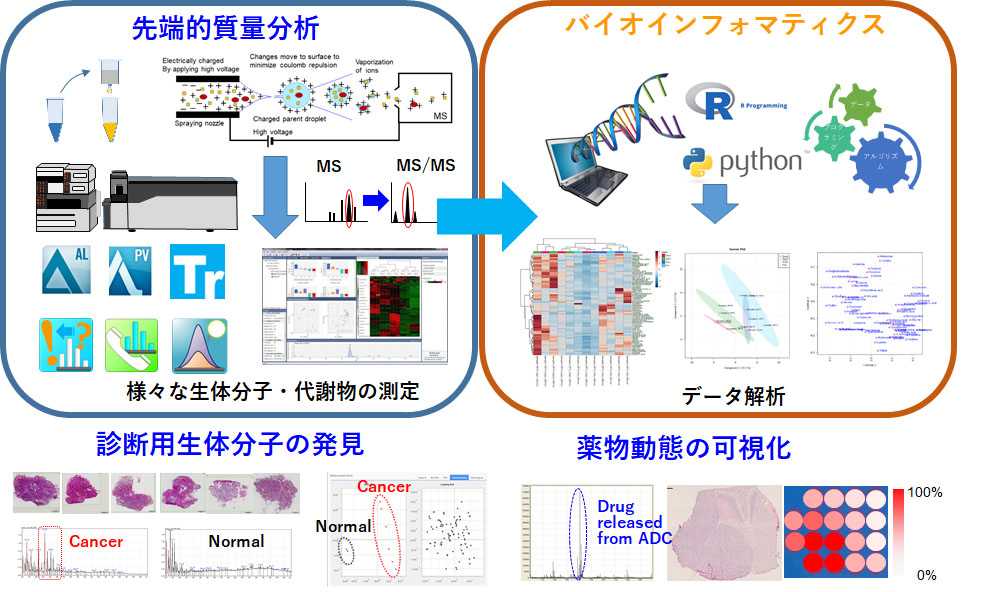
先端的質量分析・バイオインフォマティクスと新薬開発
質量分析によるプロテオミクス・メタボローム解析にバイオインフォマティクスを組み合わせて、抗体の治療標的となる分子の探索・同定を行います。さらに、質量分析でADCからリリースされた薬剤の可視化と薬剤の影響による生体分子・代謝物の変化を測定することで細胞障害のsignatureを観察できます。特に、ADCのMOAとしてのbystander effectと近年注目されているImmunogenic cell death (ICD)の本態解明に役立てたいと考えています。また、質量分析での大きな課題にインフォマティクス解析法とデータべースが未整備であるという点があります。例えば、生体分子・代謝物の分子量m/zが判明しても、その90%がアノテーションされずに放置されているという現状です。そこで、工学系・情報系の専門家と協力して、高感度のin situレベルの質量分析法と人工知能(AI)含む最新のコンピューターサイエンスのデータ分析技術を導入していきます。この先端的質量分析とバイオインフォマティクスによって、マウスとヒト検体の両方で新薬のMOA(mechanism of action)/pharmacokinetics (PK)/ pharmacodynamics (PD)を精密に評価できるようになります。同時に治療標的分子の探索にも活用できます。
【Reference】
- Yasunaga M, Manabe S, Furuta M, Ogata K, Koga Y, Takashima H, Nishida T, Matsumura Y. Mass spectrometry imaging for early discovery and development of cancer drugs. AIMS Md Sci. 5, 162-180. 2018.
- Fujiwara Y, Furuta M, Manabe S, Koga Y, Yasunaga M, Matsumura Y. Imaging mass spectrometry for the precise design of antibody-drug conjugates. Sci Rep. 6, 24954. 2016.
- Yasunaga M, Furuta M, Ogata K, Koga Y, Yamamoto Y, Takigahira M,Matsumura Y. The significance of microscopic mass spectrometry with high resolution in the visualisation of drug distribution. Sci Rep. 3, 3050. 2013.
- 安永正浩、古田大、緒方是嗣、古賀宣勝、藤原悠起、松村保広 MSイメージングを用いたドラッグイメージング法の開発と創薬への応用 日本分子イメージング学会機関紙 9, 15-22, 2015.
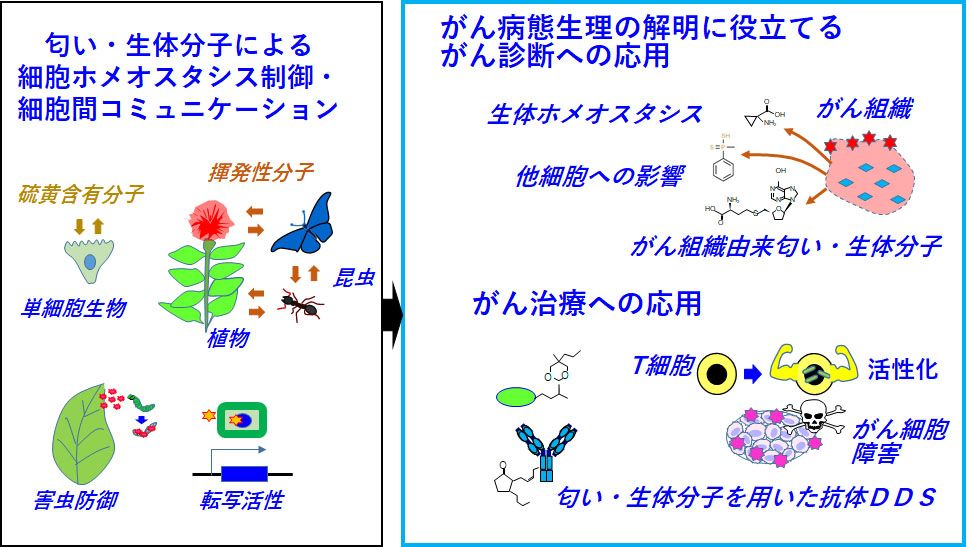
匂い・生体分子を標的にした新しい腫瘍学と診断治療への応用
膵臓がん・スキルス胃がんなど難治性がんに対して、既存の枠にとらわれない新薬開発法も必要と思われます。また、近年がん細胞から放出される匂い分子によるがん診断も着目されています。現在行っています膵臓がん・スキルス胃がんのin situ型質量分析の結果から、ユニークな生体分子・代謝物の存在が示唆されています。アノテーションが十分ではありませんが、下等生物・植物由来の生体分子ががん細胞或いは免疫細胞に働いている可能性が示唆されています。これらの生体ホメオスタシスへの影響やがん病態生理との関係調べて、新たな知見を得ることができれば、新しい腫瘍学や診断治療法の開発に繋げることができるのではないかと期待しています。
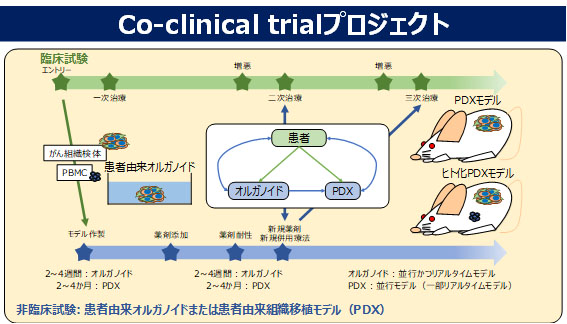
Co-clinical trialプロジェクト
新薬開発分野ではDDS技術を基盤とした様々な薬剤開発を行っていますが、抗がん剤開発において非臨床研究で薬効を示した薬剤が臨床治験で効果を示さない、いわゆる非臨床研究と臨床治験の結果の不一致が重大な課題となっています。その原因は非臨床研究で利用される薬効評価モデルが、ヒトがん組織におけるがん細胞と間質組織との相互作用など、がんネットワークを適切に再現できていないことにあります。Co-clinical trialプロジェクトでは、がん細胞の二次元培養モデル、スフェロイドやオルガノイドなど三次元培養モデル、細胞株移植マウス(CDX)モデル、患者由来組織移植マウス(PDX)モデルなど様々な非臨床モデルの特徴を明らかにして、DDS薬剤開発における非臨床技術基盤を構築します。
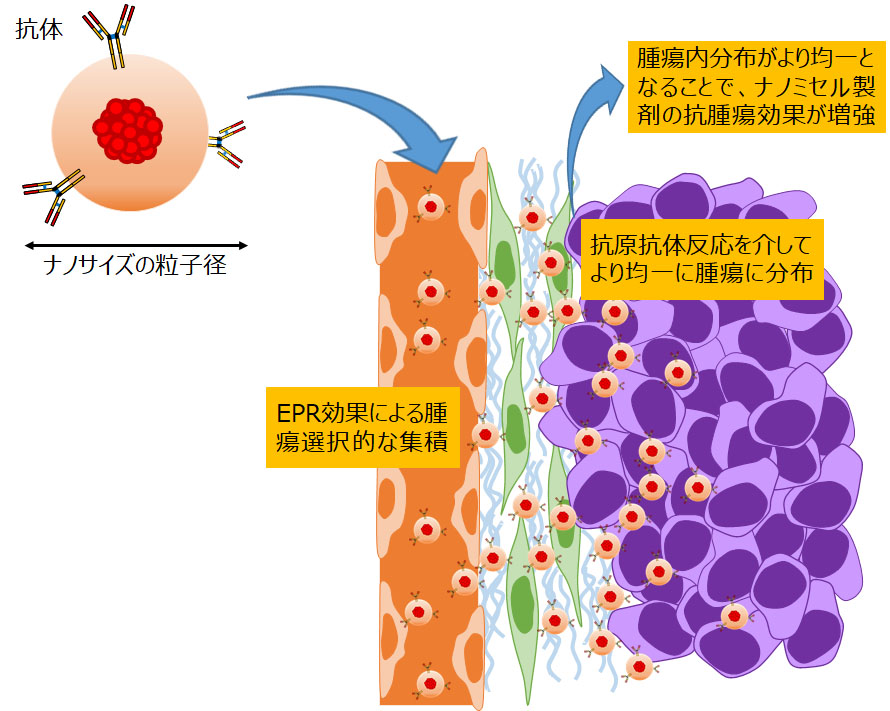
ナノDDS製剤の開発研究
ナノテクノロジーをDDSに応用するための研究が、近年活発に行われています。新薬開発分野では、ナノDDS製剤である抗がん剤内包ミセルの開発研究を行っています。抗がん剤内包ミセルは、EPR効果によって正常臓器への薬剤分布が抑えられる結果、低分子薬剤と比較して安全性の点で優れるということが、種々の前臨床及び臨床試験で示されています。今後の臨床応用に向けては、安全性を維持しつつ、薬効を増強される戦略の開発が重要になると考えています。その一例として、これまでにミセル外殻に抗体を付加することで、生体内の安定性や毒性プロファイルを悪化させることなく、薬効を増強させることが可能であると報告してきました。薬効薬理学的な解析を通じて、ナノDDS製剤のMOAを解明すると共に、基礎的知見を蓄積し、将来の臨床開発に繋げていきます。
【Reference】
- Takashima H, Koga Y, Tsumura R, Yasunaga M, Tsuchiya M, Inoue T, Negishi E, Harada M, Yoshida S, Matsumura Y. Reinforcement of antitumor effect of micelles containing anticancer drugs by binding of an anti-tissue factor antibody without direct cytocidal effects. J Control Release. 323, 138-150. 2020.
-
Takashima H, Tsuji AB, Saga T, Yasunaga M, Koga Y, Kuroda JI, Yano S, Kuratsu JI, Matsumura Y. Molecular imaging using an anti-human tissue factor monoclonal antibody in an orthotopic glioma xenograft model. Sci Rep. 7, 12341. 2017.
関連リンク
- 東京大学大学院 先端生命科学専攻 がん先端生命科学分野 研究室紹介 (外部サイトにリンクします)
