トップページ > 研究組織一覧 > 基盤的臨床開発研究コアセンター > 薬効試験部門 > 研究プロジェクト > 患者腫瘍組織移植モデル(Patient-derived xenografts)を用いた創薬研究手法の開発
患者腫瘍組織移植モデル(Patient-derived xenografts)を用いた創薬研究手法の開発
更新日 : 2021年08月13日
1. 抗がん剤のスクリーニングと細胞株モデル
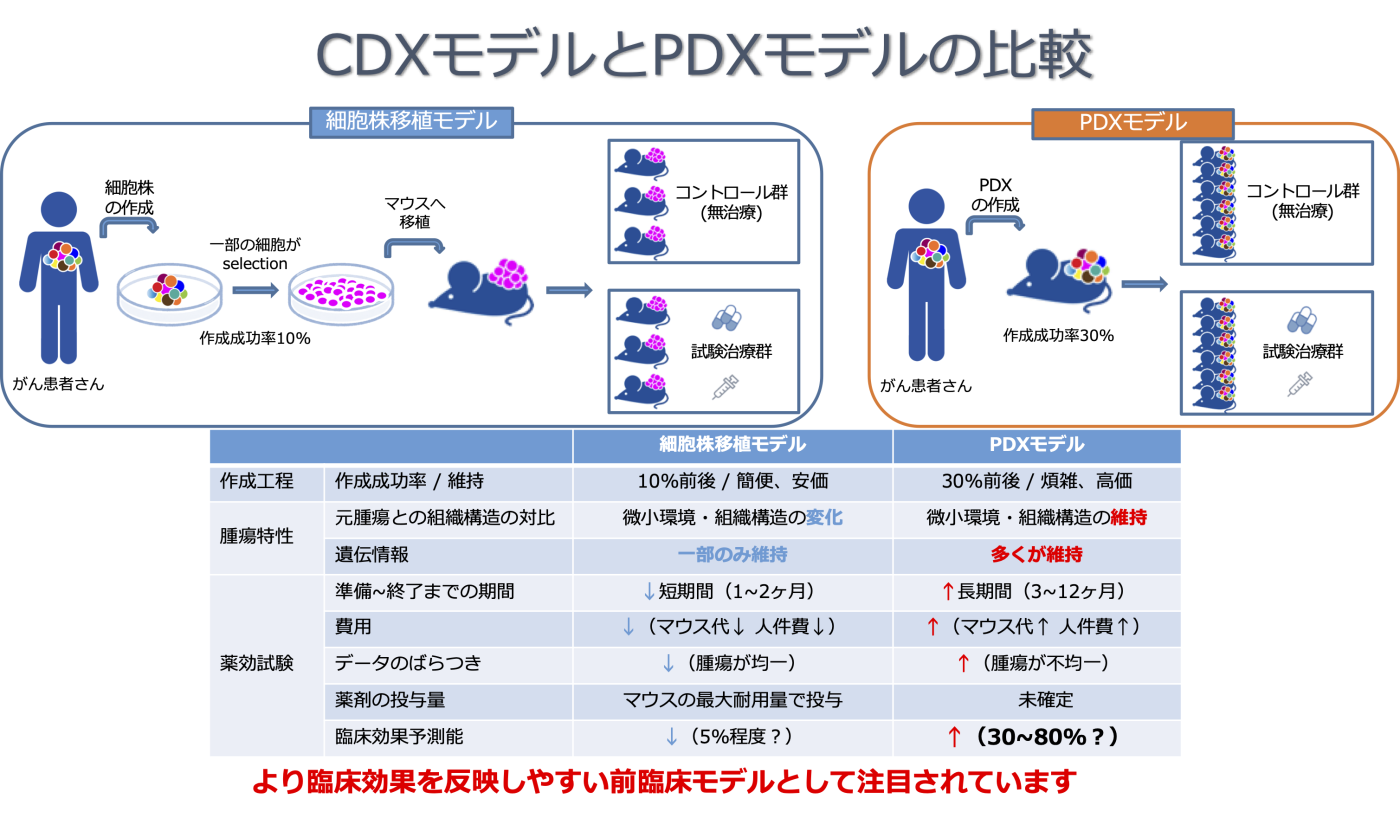
従来より抗がん薬の有効性を評価する(スクリーニング)手段として、患者さんの腫瘍組織を細分化しシャーレで培養する細胞株が用いられてきました。細胞株にシャーレの中でさまざまな濃度の抗がん薬を投与し、どれくらいの濃度でがん細胞の増殖を抑えられるかの検討(in vitro試験)、細胞株をマウスへ移植して腫瘍を作成し(細胞株移植モデル:Cell line-derived xenograft, CDXモデル)マウスに対して抗がん薬を投与する検討(in vivo試験)が標準的な評価法として使われています。しかし、このような細胞株を用いた抗がん薬のスクリーニングで有効であると判断されても、実際にがん患者さんで有効性を示す抗がん薬の割合は低く、一般的に抗がん薬の開発成功率は5%程度と非常に低いことが報告されています。この原因としては、以下のような点があると考えられています。
- 細胞株を作成する段階で、がん細胞の一部のシャーレ(二次元空間)で育ちやすい細胞だけが残ってしまう
- 細胞株移植モデル(CDXモデル)は実際の患者さんの腫瘍と比べ、組織構造が異なる
- 患者さんの腫瘍は様々な顔つきのがん細胞が存在する(不均一性と言います)が、CDXモデルでは同じような顔つきのがん細胞だけになってしまう
- 患者さんの腫瘍の遺伝子異常が一部しか細胞株へ反映されない
以上のように、細胞株モデルは実際の患者さんの腫瘍の特性を一部しか反映できておらず、患者さんにおける抗がん薬の効果を反映できないのではないかと考えられています。このため、細胞株モデルに代わる、より抗がん薬の患者さんでの有効性を予測できるスクリーニング手法が長年にわたり望まれています。
2. 患者腫瘍移植モデル(Patient-derived xenograft, PDXモデル)とは
近年、より患者さんの抗がん薬の効果を予測できる手法として、患者腫瘍移植モデル(PDXモデル)が注目を浴びています。PDXモデルは免疫不全マウス(マウスの免疫力を強く抑え、拒絶反応が起きにくいマウス)に患者さんの腫瘍組織をそのまま移植する手法です。マウスという生体の中で腫瘍は三次元的に増殖することができるため、シャーレの中で培養する場合に比べて、患者さんの体内での腫瘍の増殖に似た状況となります。PDXモデルでは、作成された腫瘍の組織構造が患者さんの腫瘍の組織構造と近似しており、腫瘍の不均一性が保たれ、さらに遺伝子異常が維持されるという特性が報告されています。また、患者さんの抗がん薬の効果とPDXでの抗がん薬の投与結果が高い一致率を示すという報告もあり、より患者さんでの有効性を予測できるモデルとして注目されています。
3. 国内外のPDXモデルの利活用状況
PDXモデルが抗がん薬のスクリーニングのため注目されている中、米国や欧州では大学が政府機関、営利団体を中心にPDXモデルを作成して抗がん薬の開発に活用する試みが進められてきました。中でも米国がん研究所(National Cancer Institute, NCI)では2015年に、抗がん薬のスクリーニングを、細胞株を用いた手法からPDXを用いた手法へ変更するという大きな舵取りを行いました。多くの製薬企業でもPDXモデルを活用し、より患者さんに近いモデルで抗がん薬の効果を試すという開発研究が進んでいます。
日本国内では、国立研究開発法人 医薬基盤・健康・栄養研究所 創薬等モデル動物研究プロジェクトの野村大成先生が古くからPDXモデルの有用性に注目され、特殊な免疫不全マウスの作成とPDXモデルの構築に取り組まれてこられました。また、公立大学法人福島県立医科大学では福島医薬品関連産業支援拠点化事業の一つとして福島PDX(F-PDX)モデルを作成されています。
しかし、日本国内のPDXモデルは欧米に比べると数が少なく、また欧米のPDXモデルは多くが早期がんの患者さんから手術検体を用いて作られています。抗がん薬の開発に活用するためには、実際に抗がん薬を投与される進行・再発期のがん患者さんや、抗がん薬が効かなくなった(耐性と言います)状態の患者さんを反映するPDXモデルが必要です。
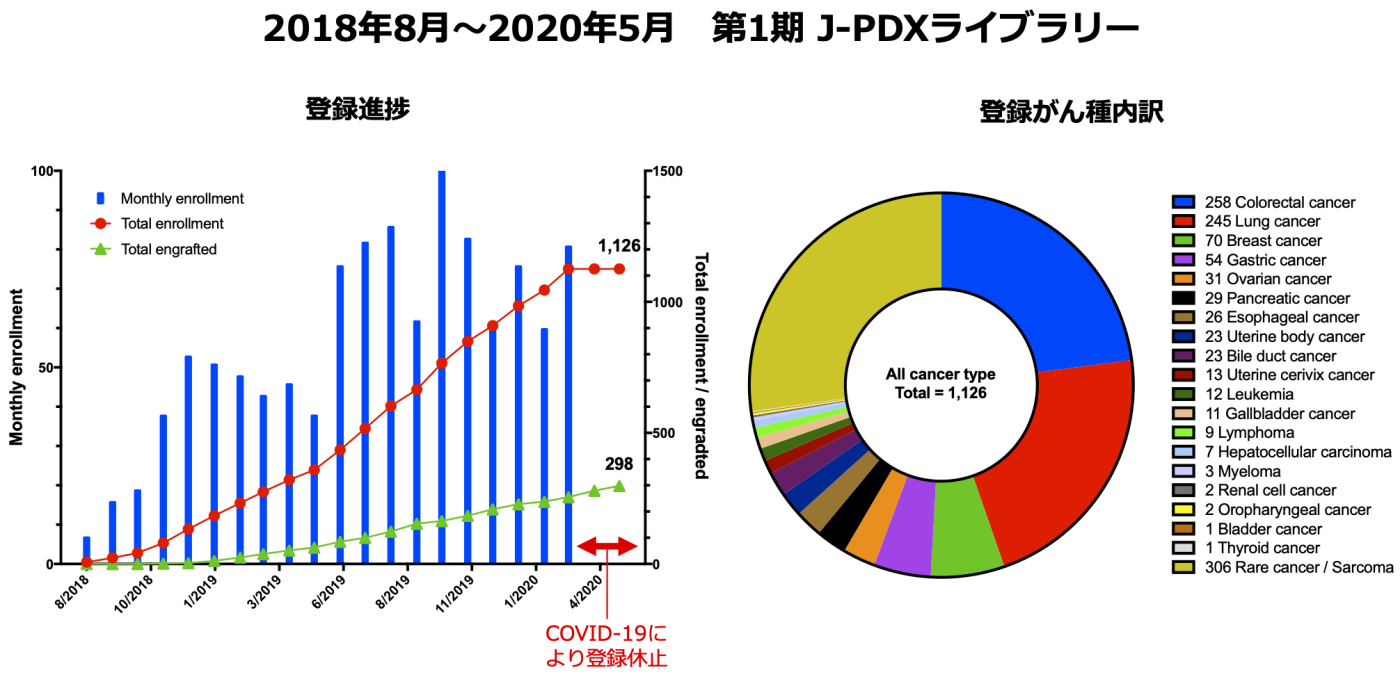
4. 日本人がん患者由来PDXライブラリー(J-PDXライブラリー)
以上の背景より国立がん研究センターは株式会社LSIメディエンス (現メディフォード株式会社✴︎)と共同で、国立研究開発法人日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)の支援のもと「がん医療推進のための日本人がん患者由来PDXライブラリー整備事業」として2018年よりJ-PDXライブラリーの構築を開始いたしました。J-PDXライブラリーは、日本人の特性を加味した効率的な新薬開発を目指して、日本人のがん患者さん由来のPDXを産業活用するための基盤を整備し、さらに高度な研究・医療への応用展開を加速させるものです。患者さんの腫瘍およびPDXの解析情報(病理組織所見、遺伝子異常、遺伝子発現等)を、臨床情報と併せて一元管理し、抗がん薬の効果や作用機序をマウスとヒトで相互比較、検討することで、ゲノム医療・創薬の実践への貢献を目指します。
✴︎2023年11月1日よりメディフォード株式会社に事業承継いたしました。
5. J-PDXライブラリーにおける品質管理
PDXの作成過程では、腫瘍組織中に含まれるリンパ球の増殖によりリンパ腫置換を起こす場合や、マウス腫瘍に置換されてしまうことがあります。リンパ腫置換はJ-PDXライブラリーでは12%で発生しており、大腸がんや胃がんなどの消化器系腫瘍で発生頻度が高くなっています。リンパ腫置換やマウス腫瘍置換の除外を目的として、J-PDXライブラリーでは各継代時にFFPEブロックを作成し、ヘマトキシリン・エオジン(H&E)染色の他にヒトCD45染色、ヒトミトコンドリア(COX-IV)染色を実施しています。リンパ腫置換となった検体では腫瘍全体がヒトCD45染色陽性となります。また、マウス腫瘍置換された場合にはヒトミトコンドリア染色が陰性となり、この場合にはマウスミトコンドリア染色を行いマウス組織であることを確認する場合もあります。また、継代過程でのコンタミネーションや取り違えの除外を目的として、ショートタンデムリピート解析(STR解析)を実施しています。患者さんの正常DNAや腫瘍DNAと、PDXの各継代時点でのSTR解析を実施することで、J-PDXライブラリーの品質管理を行なっています。
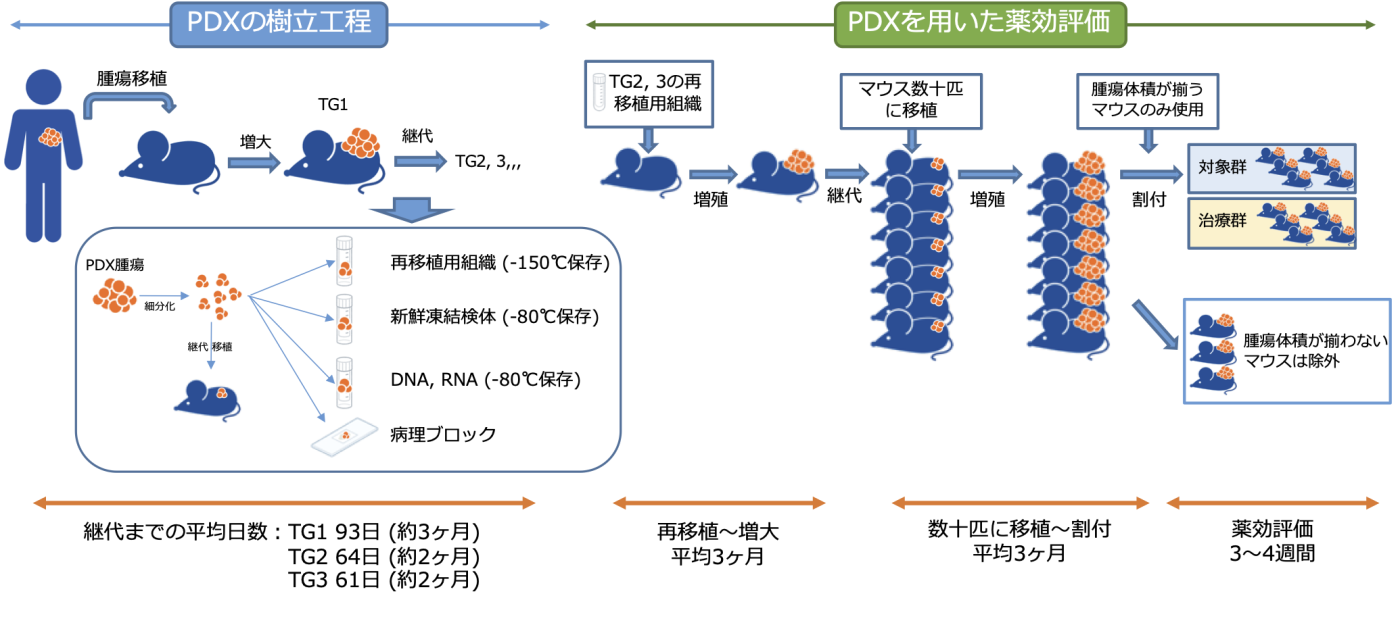
6. J-PDXライブラリーにおけるPDXの作成と薬効評価までの流れ
PDXの作成方法は、患者さんからご提供いただいた腫瘍組織を免疫不全マウスへ移植するところから始まります。免疫不全マウスにも様々な種類があり、免疫不全の度合い(マウスの免疫がどれだけ抑えられているか)によりNOGマウス、NSGマウス、SCIDマウス、SCID-Beigeマウスなどの種類があります。J-PDXライブラリーでは主にNOGマウス(NOD/Shi-scid,IL-2RγKO)を使用しています。患者さんの腫瘍を移植して初めて腫瘍ができたマウスをTG1(1継代目、Trans Generation 1)と命名しています。大きくなった腫瘍は細かく分割し次のマウスへ継代(TG2となります)するとともに、残りの腫瘍は後々移植するための保管(再移植用組織)、遺伝子や蛋白を調べるための保管(新鮮凍結検体)、病理解析を行うための保管(病理ブロック)に供されます。TG1の腫瘍が増大した段階で「生着」、TG3の腫瘍が保管できた段階で「樹立」と評価します。
*継代数の数え方は施設やグループによって異なります。1継代目をF0、2継代目をF1、と表記しているグループもあります。
抗がん薬の薬効評価を行う場合には、TG2やTG3の保管してある腫瘍をマウスへ移植し、増やした段階でさらに複数のマウスへ移植し、このうち一部のマウスを使用して抗がん薬の投与実験を行います。PDXモデルでは腫瘍の不均一性が高いため、腫瘍の増殖スピードがマウス(腫瘍)ごとに大きく異なるため、このような方法が必要となります。このため、細胞株を用いたマウスモデルでの実験に比べると、期間と費用が必要となります。
7. J-PDXライブラリーの特徴
1 患者さんの背景
J-PDXに登録いただいた患者さんの背景を以下の表に示します。全体で年齢中央値は61歳で、5歳から91歳までの患者さんがご登録いただきました。ステージIII, IV、再発期の患者さんが60%前後と多くの患者さんが進行再発期の状態でした。何らかのがん治療を受けられた患者さんが9割を占め、抗がん剤治療を受けた後の方が30%でした。抗がん剤治療を受けた患者さんでは半数以上が二つ以上の抗がん剤治療を受けた後であり、細胞障害性抗がん剤やチロシンキナーゼ阻害剤、免疫チェックポイント阻害剤など多様な治療を受けておられ、6%の患者さんでは治験での治療を受けておられました。全体の3割で生検検体をご提供いただき、検体を受領したのち平均1.25日で迅速に免疫不全マウスへ移植に至っていました。PDXが生着した検体では、ステージが進行再発期、抗がん剤治療歴がある、検体の採取から移植までの日数が短いほど生着しやすい傾向が認められました。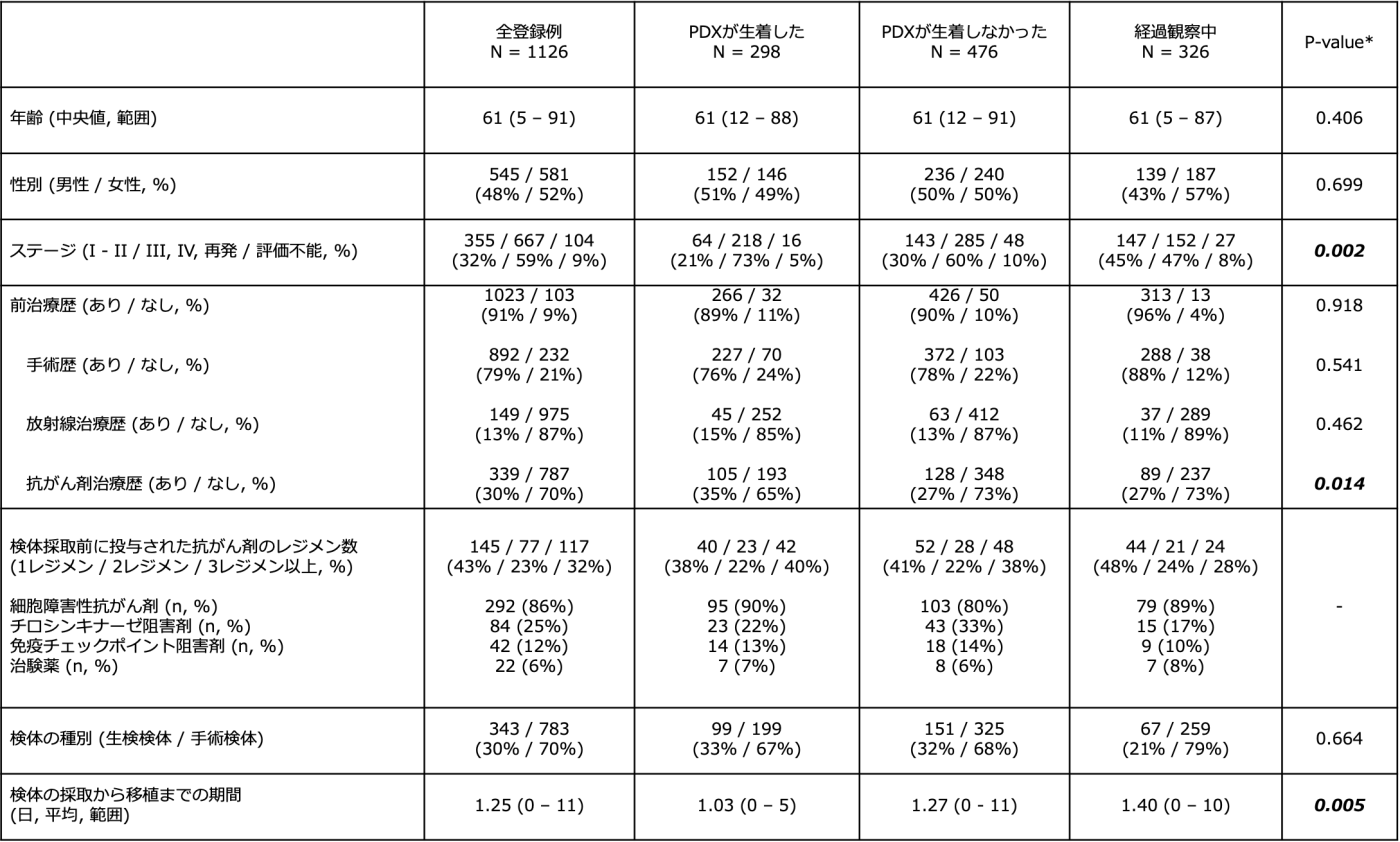
2 がん種ごとの生着率
がん種ごとの生着率を以下の表に示します。全体の生着率は27.1%であり、がん種ごとに生着率が異なることがわかります。また、PDXの作成過程ではマウス由来の腫瘍に置き換わってしまう(マウス腫瘍置換)、リンパ球の増殖によってリンパ腫に置き換わってしまう(リンパ腫置換)という現象によってPDXの生着が妨げられることがあります。J-PDXライブラリーでは大腸がんや肺がん、胃がんなどのがん種においてリンパ腫の発生が多く認められました。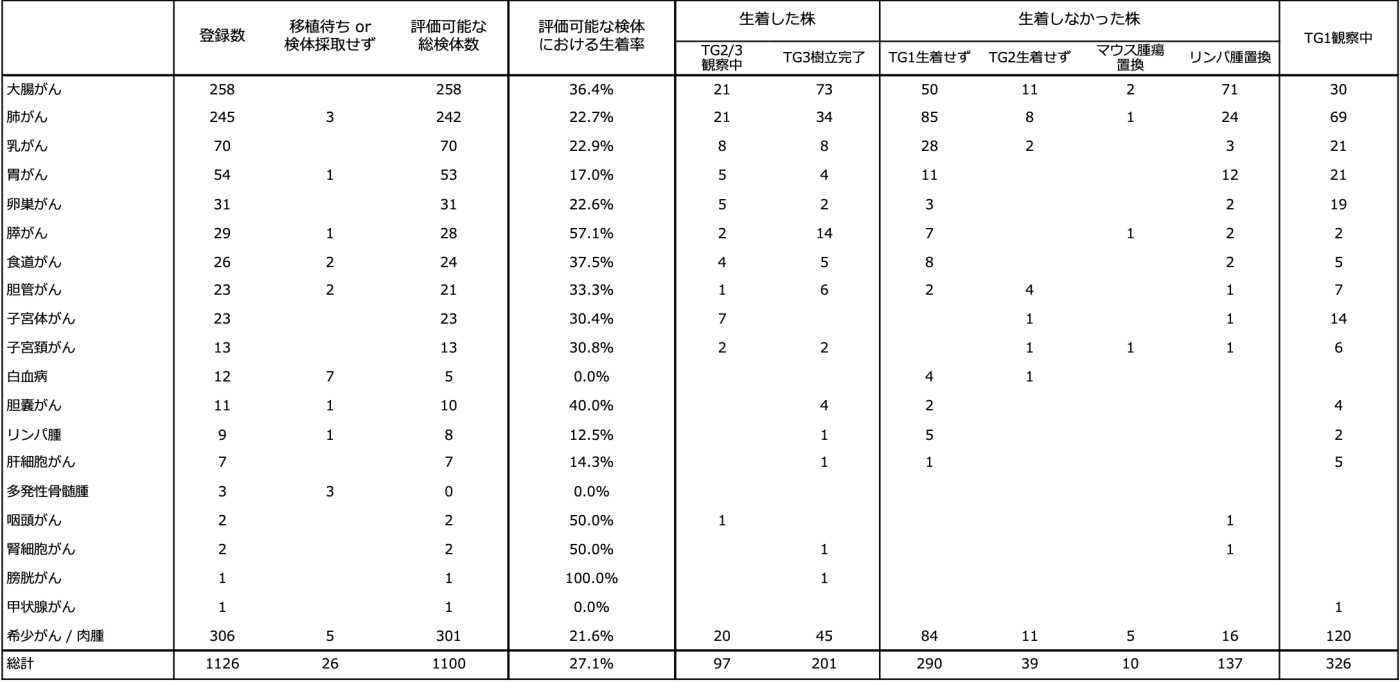
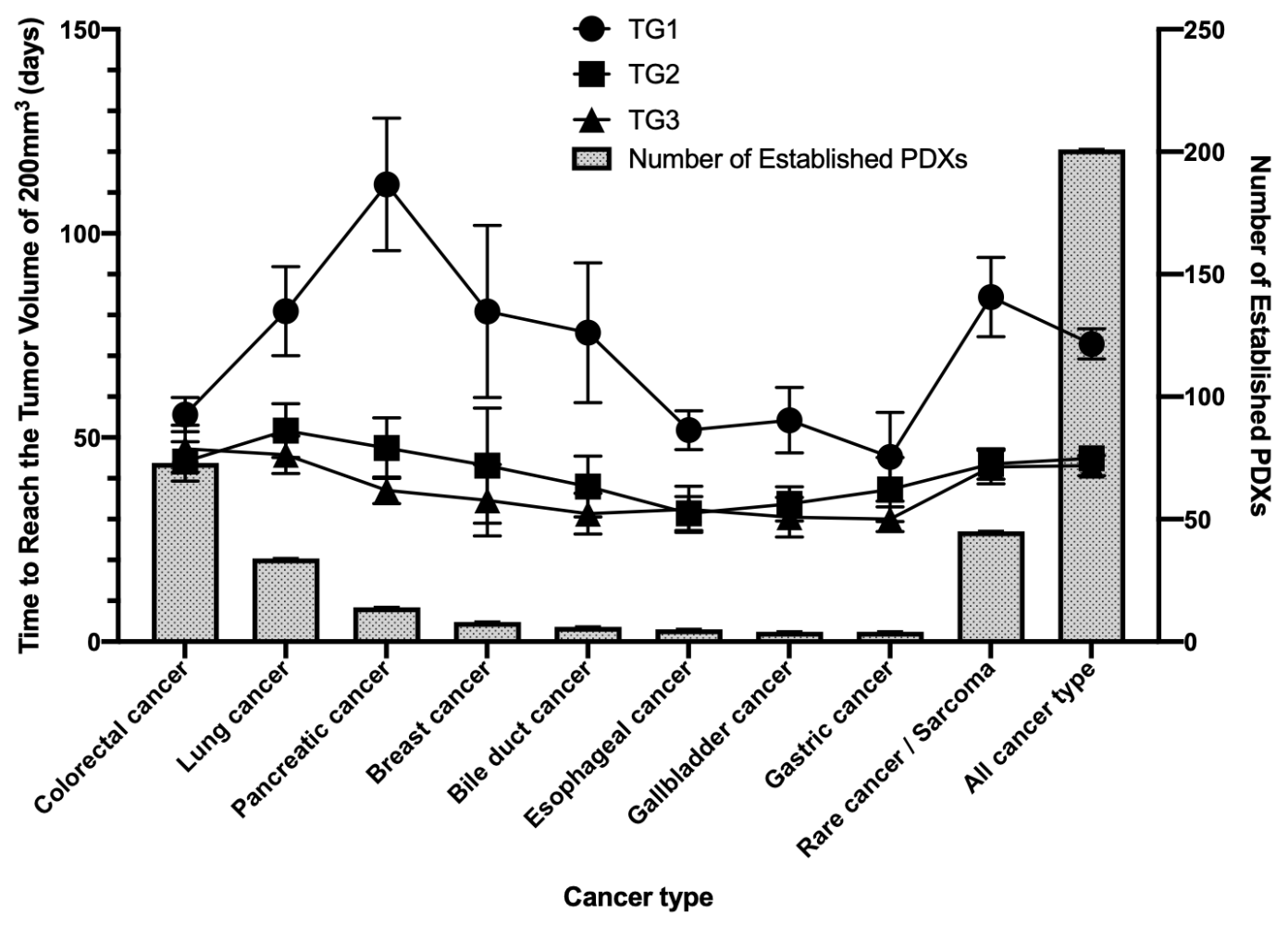
3 がん種ごとの増殖速度の違い
がん種ごとの増大速度の違いを評価するため、それぞれのがん種で樹立したPDXにおける腫瘍体積が200 mm3になるまでの期間を比較しました。以下の図の通り、TG1の腫瘍ではがん種ごとに増大速度が大きく異なり、大腸がんや胃がんでは50日前後であるのに対し、膵がんでは110日前後でした。一方TG2, TG3ではいずれのがん種でも40~50日前後となっており、継代が進むごとに腫瘍の増殖速度が上がることが確認されました。
4 PDXの生着に影響を与える因子
次にPDXが生着するか否かに影響を与える因子を探索しました。単変量解析では検体採取から移植までの時間が短く、ステージが進んでいる(進行再発期)、化学療法歴がある、そして検体採取からの生存期間が短いほど生着しやすい傾向が認められました。多変量解析ではステージが進んでいる、検体採取からの生存期間が短いという二つの因子が生着に影響を与える因子であることがわかりました。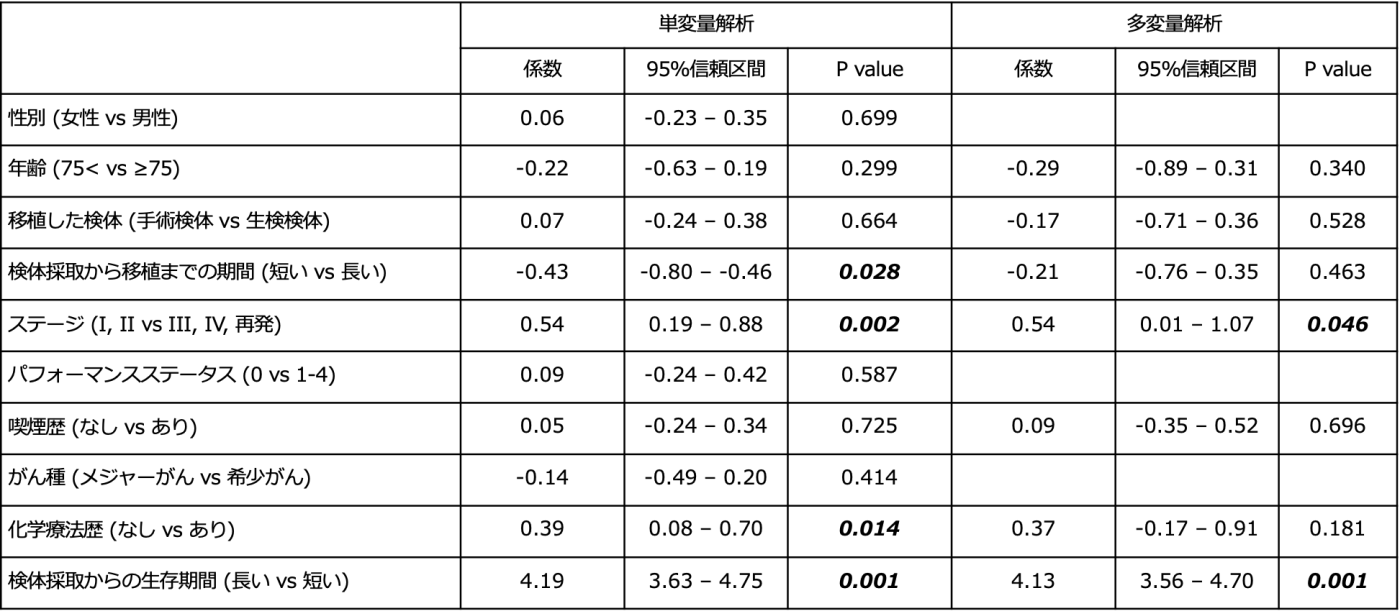
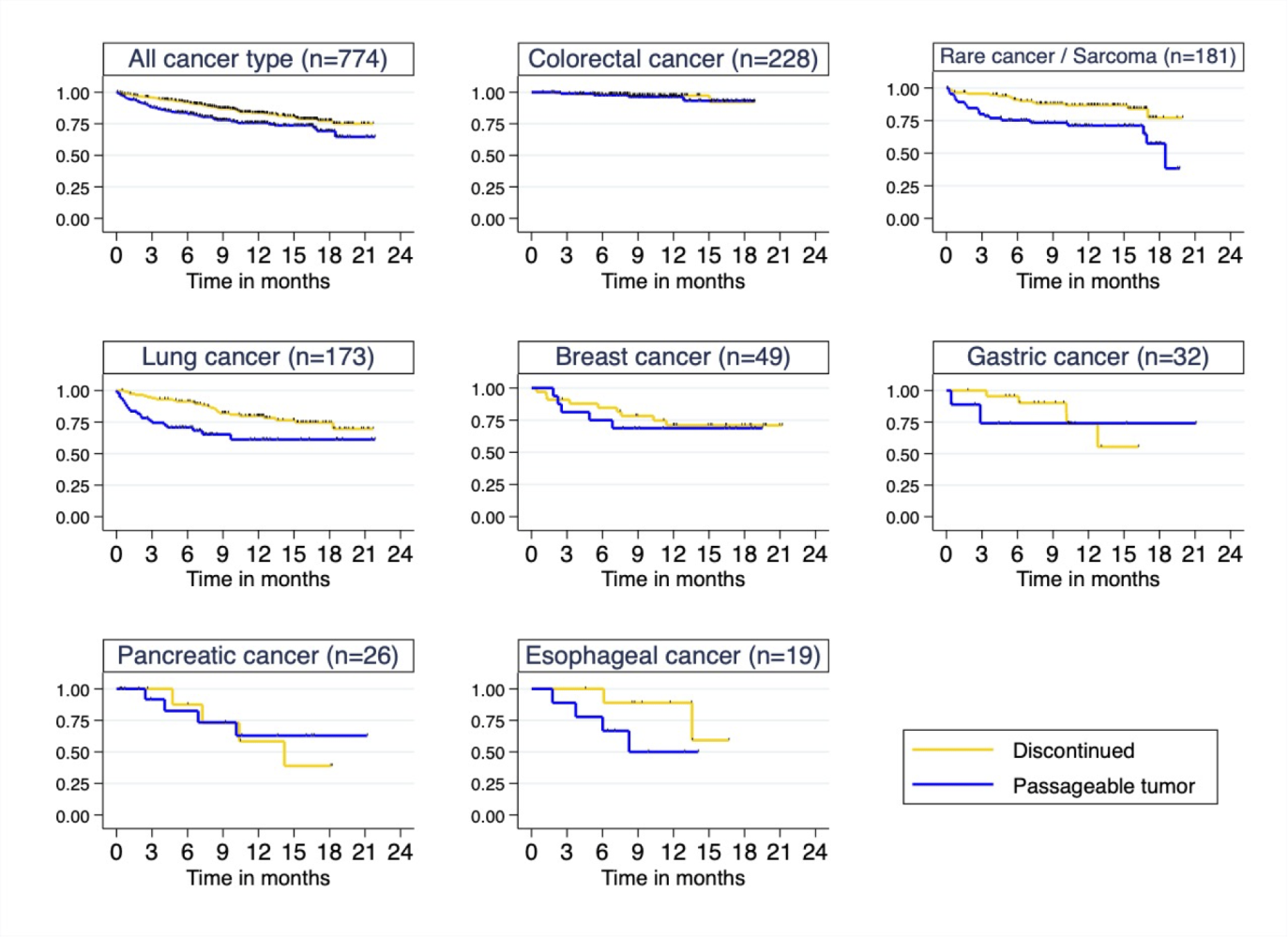
5 検体の採取からの生存期間について
8. J-PDXライブラリーの活用と抗がん薬の開発研究への利活用
- 「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」
以上のように、国立がん研究センターでは日本における抗がん薬の開発を加速させるためにJ-PDXライブラリーを構築し、研究開発へ利活用して参ります。
2021年5月、国立がん研究センターとエーザイ株式会社は国立研究開発法人日本医療研究開発機構(AMED)の医療研究開発革新基盤創成事業(CiCLE)の支援のもと、「希少がんならびに難治性がんに対する抗がん剤治療開発を加速させる創薬研究手法に関する研究」を開始致しました。
(2021年5月14日プレスリリース:https://www.ncc.go.jp/jp/information/pr_release/2021/0514/index.html)
希少がんは患者さんの数が非常に少ないため、製薬企業単独では開発が困難であり、製造販売承認に至る抗がん薬は限られています。また、患者さんの数が多いメジャーがんにおいても、標準治療が確立されていない難治性がんなどは研究開発の難易度が高く、新薬創製の障壁となっています。希少がんや難治性がんの患者さんにいち早く有効な治療法をお届けするためには、薬剤の効果を予め確認する非臨床研究での治療効果予測を高精度かつ効率的に証明し、続く臨床試験への移行をシームレスに行うこと、さらに実際の治療効果や副作用、薬剤耐性の作用機序を解明することが重要です。このため、本研究開発プロジェクトでは、臨床での有効性を高精度に予測可能なJ-PDXライブラリーとがんゲノムデータを用いてその実現を目指します。
- 製薬企業・アカデミアとの共同研究による創薬開発への利活用
J-PDXライブラリーは公的資金の支援も受け構築したプラットフォームであり、抗がん薬の創薬開発を目的とした製薬企業やアカデミアの先生方のご利用が可能です。ご利用にあたっては用途や利用場所などに応じて契約や実費相当の費用負担をお願いする場合もございます。詳しくはお問い合わせいただければ幸いです。
- PDXを用いた薬剤スクリーニング
開発中の抗がん薬を、がん種やステージ、遺伝子変異などの条件から選択したPDXで薬効を評価することが可能です。また抗がん薬の濃度を変えたり、他の薬剤と併用した場合の効果をみるなど、ヒトにおける第一相試験や第二相試験にあたる評価をPDXモデルで実施することができます。これにより、効果が期待されるがん種の探索や、バイオマーカー、耐性メカニズムの研究に活用することが期待されます。現在国立がん研究センターでは複数の製薬企業と共同のもとPDXでの薬剤スクリーニングを進めております。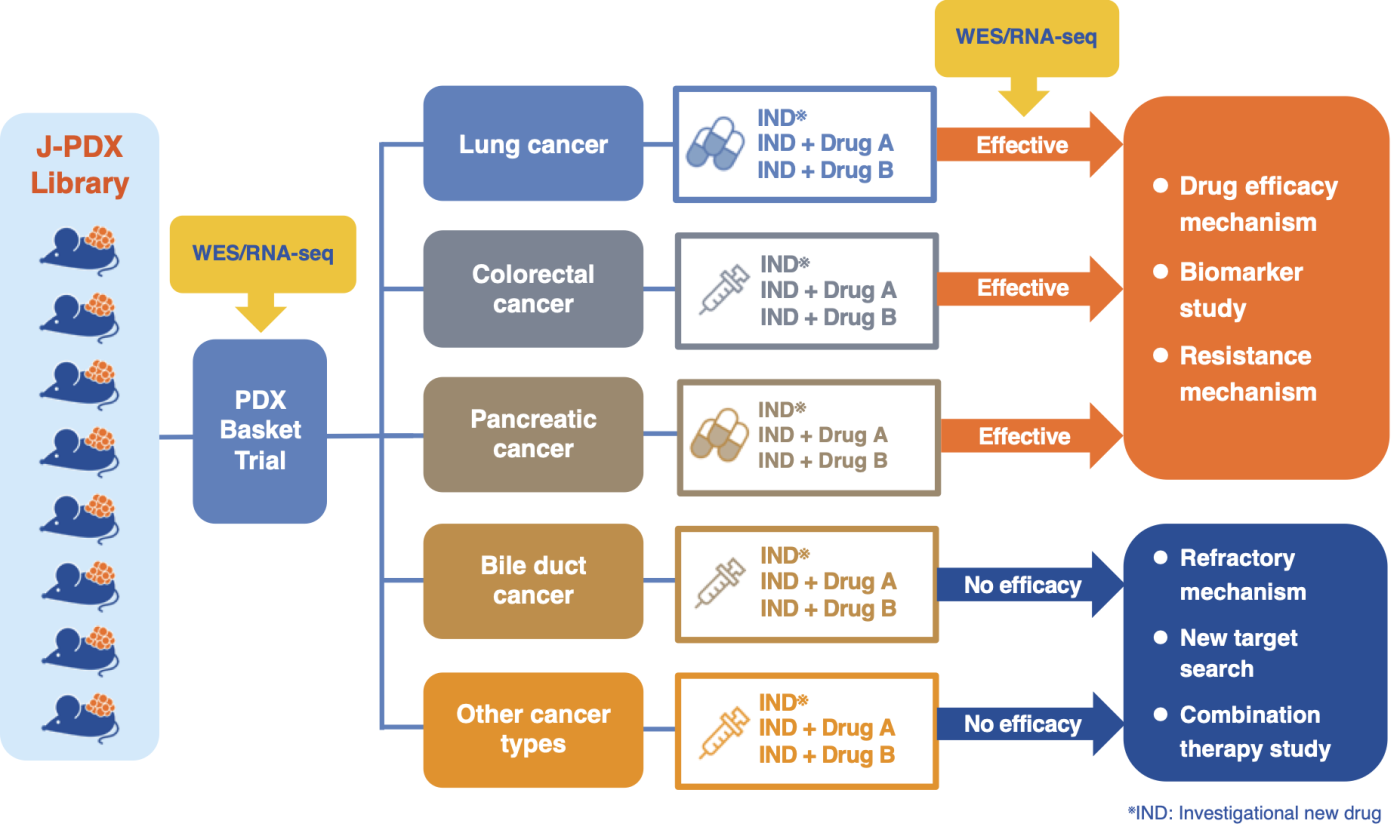
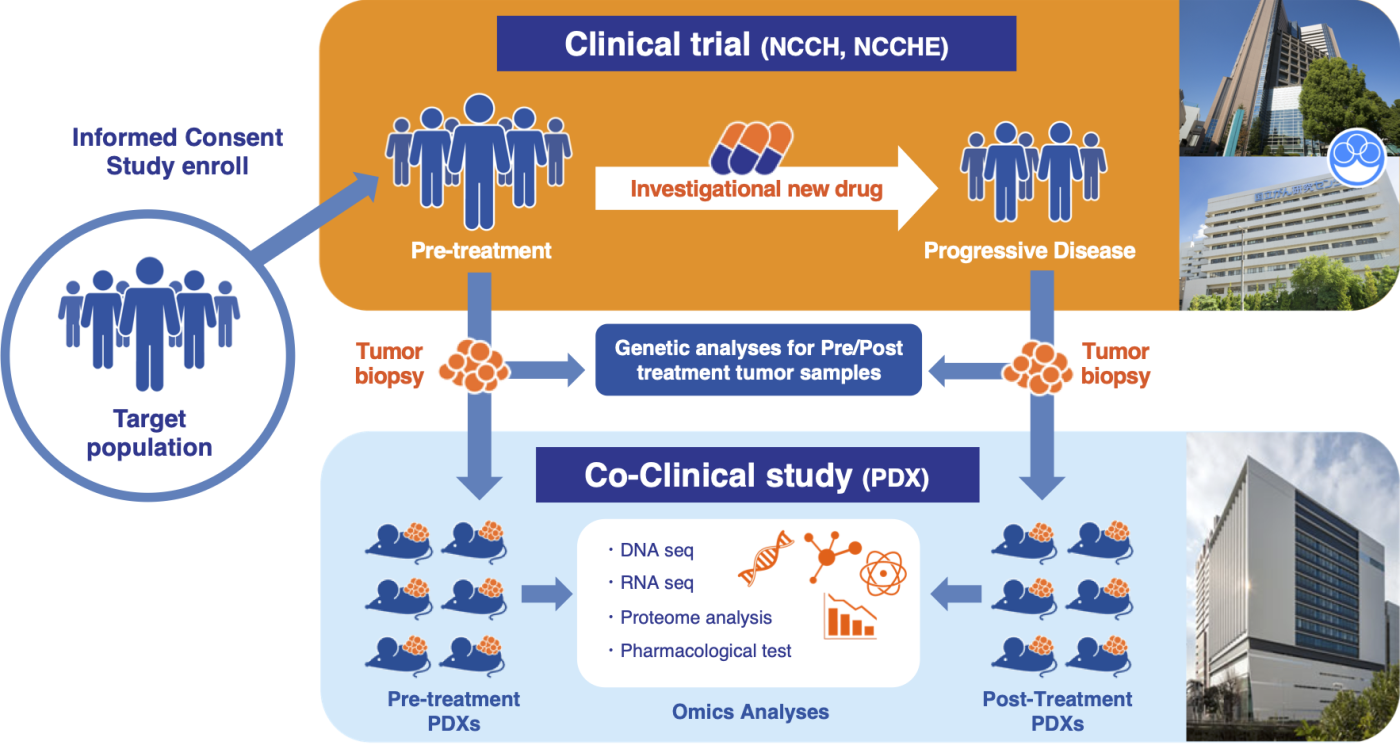
- 患者さんの臨床試験に付随したPDXでの薬効評価の推進(Co-clinical Study)
9. J-PDXのご利用について
J-PDXライブラリーで樹立されたPDX株は、メディフォード株式会社で平行してGLPグレードで維持管理が行われております。製薬企業やアカデミアの先生方でJ-PDXの利用をご希望の場合、一部の臨床情報と薬効評価をご希望の場合にはメディフォード株式会社へお問い合わせください(https://www.mediford.com)。詳細な臨床情報を含めた国立がん研究センターとの共同研究をご希望の場合には、当分野へご連絡をお願いいたします。
文責:大藤千里、柳下薫寛

