トップページ > 研究組織一覧 > 分野・独立ユニットグループ > がん治療学研究分野 > 研究成果の概要 > エピゲノム異常が引き起こす「代謝の急所」:SWI/SNF欠損がんにおけるグルタチオン代謝脆弱性の標的化
エピゲノム異常が引き起こす「代謝の急所」:SWI/SNF欠損がんにおけるグルタチオン代謝脆弱性の標的化
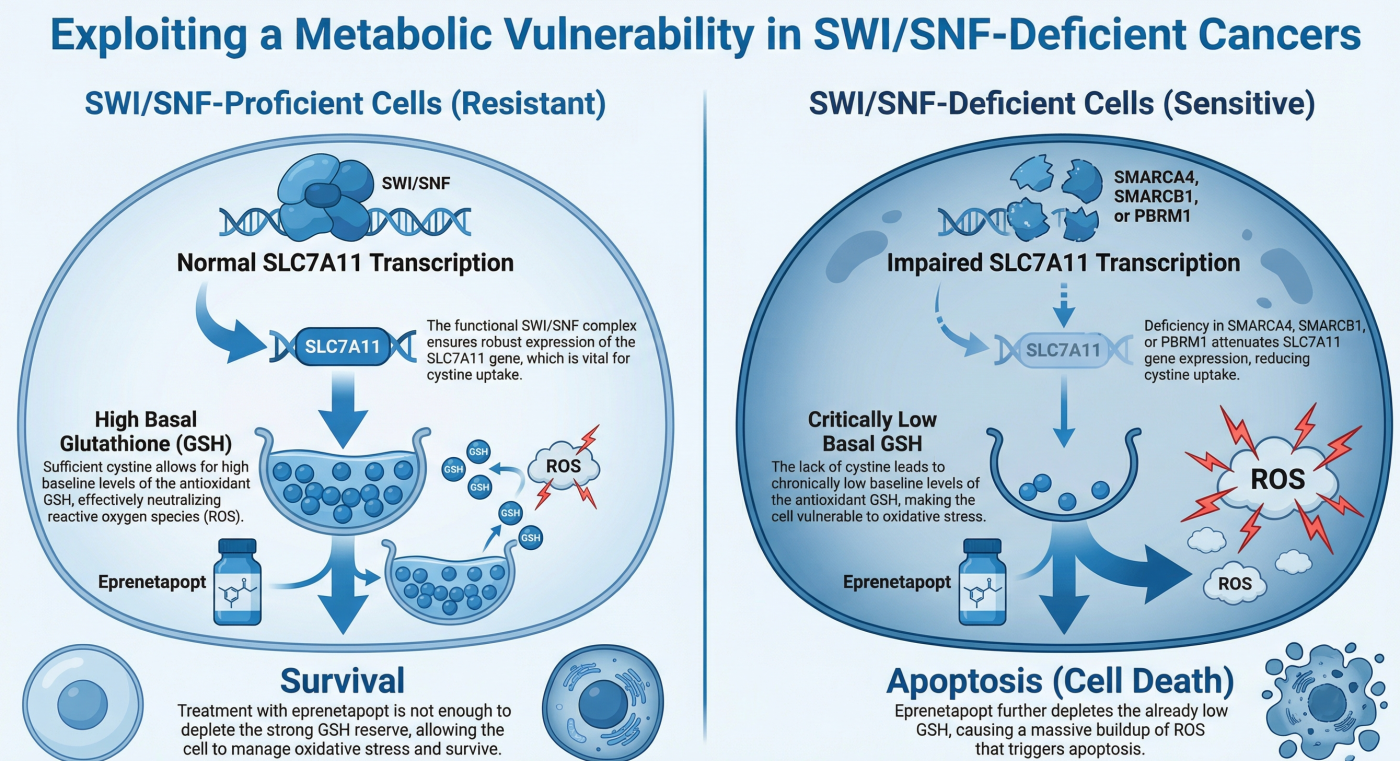
1. 発見の端緒:ARID1A欠損がんはなぜ「酸化ストレス」に弱いのか?
がん細胞は増殖に伴い高い酸化ストレス(活性酸素種:ROS)にさらされていますが、抗酸化物質であるグルタチオン(GSH)を大量に合成することで生存を維持しています。 私たちは、卵巣明細胞がんや胃がんなどで高頻度に変異が見られるARID1A遺伝子(SWI/SNF複合体因子)に着目し、その欠損ががん細胞の代謝にどのような影響を与えるかを解析しました。
その結果、ARID1A欠損がんは、正常細胞やARID1A野生型がんに比べて「基礎的なグルタチオンレベルが著しく低い」という意外な脆弱性(アキレス腱)を持っていることを発見しました 。
2. 分子メカニズム:エピゲノム制御による代謝リプログラミング
なぜ、ARID1Aがなくなるとグルタチオンが減るのか? そのメカニズムを詳細に解析した結果、アミノ酸トランスポーターSLC7A11(xCT)の発現制御不全が原因であることを突き止めました(Cancer Cell. 2019, Biochem Biophys Res Commun. 2020)。
- 正常時: ARID1Aを含むSWI/SNF複合体は、SLC7A11遺伝子のプロモーター領域のクロマチン構造を開き、転写因子NRF2の結合を促進することで、SLC7A11の発現を高く維持しています。
- ARID1A欠損時: クロマチンリモデリングが不全となり、SLC7A11の転写が低下します。SLC7A11はグルタチオンの原料であるシスチン(Cystine)を細胞内に取り込む役割を持つため、その減少は細胞内のシステイン枯渇を招き、結果としてグルタチオン合成量が低下します。
3. 治療戦略:GCLC阻害による合成致死の誘導
ARID1A欠損がんは、グルタチオンレベルがギリギリの状態で生存しているため、グルタチオン合成経路をさらに阻害されると、酸化ストレスに耐えられずに死滅します。 私たちは、グルタチオン合成の律速酵素であるGCLC(Glutamate-Cysteine Ligase Catalytic subunit)を標的とすることで、ARID1A欠損がん細胞を選択的に死滅させられることを実証しました。
- in vitro / in vivoでの効果: GSH阻害剤(APR-246)やGCLC阻害剤(BSO)は、ARID1A欠損がん細胞株およびマウス移植モデル(卵巣がん、胃がん)において、強力な抗腫瘍効果を示しました 。
- 正常細胞への安全性: 正常細胞はSLC7A11が高発現しておりグルタチオンの予備能が高いため、GCLC阻害に対して耐性を示し、副作用の少ない治療になる可能性があります。
4. 適応拡大:SWI/SNF欠損がん全体へ
さらに最新の研究では、この代謝脆弱性がARID1A欠損がんだけでなく、他のSWI/SNF複合体因子(SMARCA4, SMARCB1, PBRM1)が欠損したがんにも共通する普遍的な特徴であることを明らかにしました(Scientific Reports, 2024)。
- 対象となるがん種:
- ARID1A欠損:卵巣明細胞がん、子宮体がん、胃がん
- SMARCA4欠損:非小細胞肺がん
- SMARCB1欠損:悪性ラブドイド腫瘍、類上皮肉腫
- PBRM1欠損:腎細胞がん
これらの難治性がんに対し、GCLC阻害剤やグルタチオン枯渇薬が広範に有効である可能性が示されました 。
5. 今後の展望
本研究成果に基づき、現在以下の取り組みを進めています。
- 新規GCLC阻害剤の創製: 製薬企業との共同研究により、臨床応用可能な特異的GCLC阻害剤の開発を行っています。
- 臨床試験への橋渡し: 既存のGSH関連薬剤(APR-246等)を用いた臨床試験の可能性を模索しています。
私たちは、「代謝」という観点から、遺伝子変異を持つ難治性がんに対する新しい精密医療(Precision Medicine)の確立を目指しています。

