トップページ > 研究組織一覧 > 分野・独立ユニットグループ > がん治療学研究分野 > 研究成果の概要 > パラログ同時阻害による次世代の合成致死戦略:cBAF欠損がん(肉腫・肺がん)への展開
パラログ同時阻害による次世代の合成致死戦略:cBAF欠損がん(肉腫・肺がん)への展開
1. コンセプト:なぜ「パラログ同時阻害」なのか?
従来の合成致死標的探索は、主に「1対1」の遺伝子関係(ある遺伝子の欠損に対して、別の1つの遺伝子を阻害する)に基づいて行われてきました。しかし、ヒトの細胞には機能が類似した「パラログ(類似遺伝子)」が存在し、片方の機能を阻害しても、もう片方が補完してしまうため、十分な治療効果が得られないケースが多く存在します。
私たちは、「パラログペアを同時に阻害することで初めて致死性(合成致死)が誘導される」という新しい仮説を立て、ヒストンアセチル化酵素であるCBP (CREBBP) と p300 (EP300) のペアに着目しました。CBPとp300は構造と機能が酷似しており、がん細胞の生存において互いに補完しあっています 。
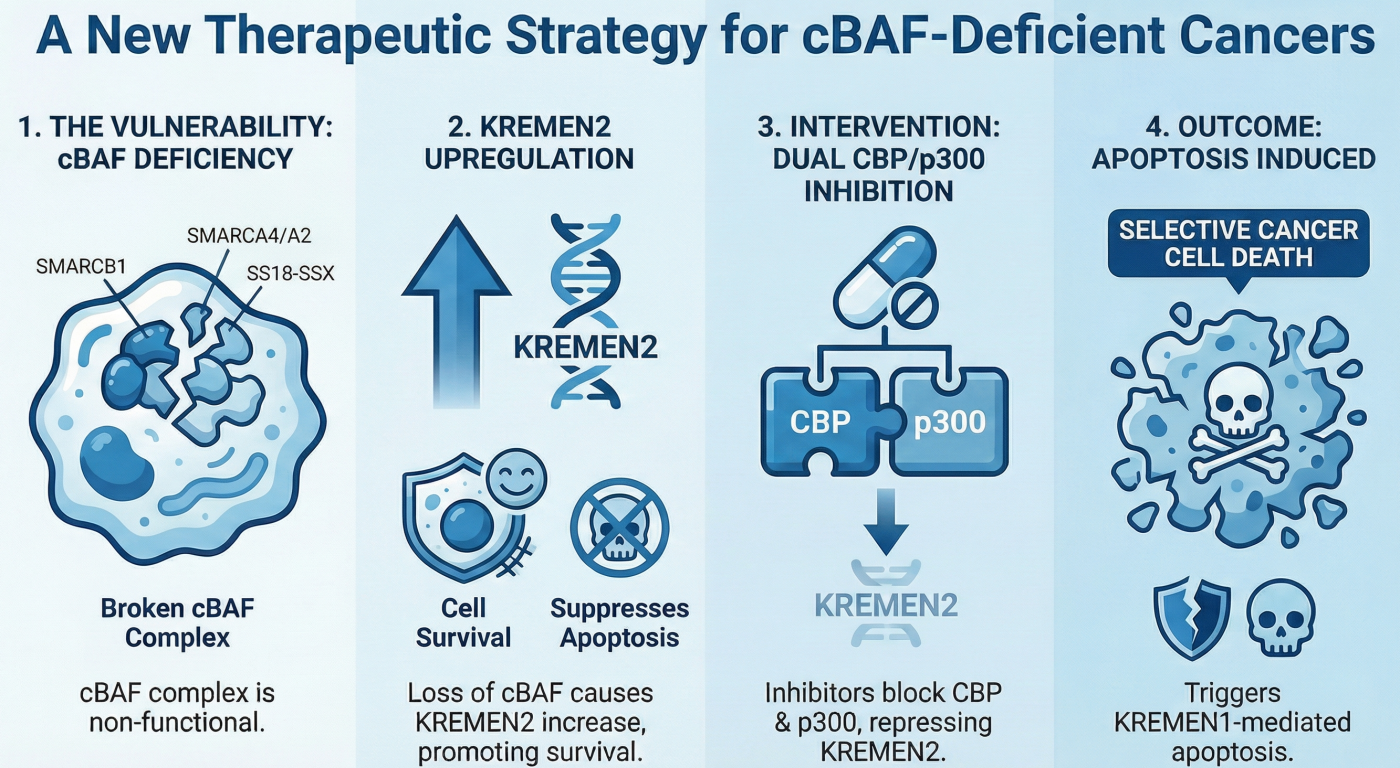
2. 標的となるがん:cBAF複合体欠損がん
私たちの研究により、CBP/p300同時阻害が極めて有効な(合成致死を示す)がんのタイプが明らかになりました。それは、SWI/SNFクロマチンリモデリング複合体の中でも「cBAF (canonical BAF) 複合体」の構成因子が欠損しているがんです。
A. SMARCB1欠損がん(ラブドイド腫瘍、類上皮肉腫)
小児の悪性ラブドイド腫瘍や、若年成人に好発する類上皮肉腫は、ほぼ100%の症例でSMARCB1遺伝子の欠損が見られます。私たちは、SMARCB1欠損がん細胞において、CBPとp300を同時に阻害することで劇的な細胞死が誘導されることを発見しました(Nature Communications, 2024)。
B. SMARCA4/SMARCA2欠損がん(非小細胞肺がん)
非小細胞肺がんの約10%では、SMARCA4遺伝子の変異に加え、SMARCA2の発現消失が見られます。これらのがんは既存の分子標的薬(EGFR阻害剤など)の対象とならず、予後不良です。私たちは、このタイプのがんもCBP/p300同時阻害に対して高い感受性を示すことを明らかにしました(Cancer Res Commun, 2025)。
C. SS18-SSX融合がん(滑膜肉腫)
滑膜肉腫の原因となるSS18-SSX融合遺伝子は、cBAF複合体の機能を阻害することが知られています。このがんに対しても、CBP/p300同時阻害が有効であることを実証しました(Cancer Res Commun, 2025)。
3. メカニズム:エピゲノム異常と「KREMEN2」の脱抑制
なぜ、これらのがん細胞だけがCBP/p300阻害で死ぬのか? その鍵は、細胞死(アポトーシス)を制御する遺伝子KREMEN2の異常な発現上昇にありました。
- 正常な状態(SWI/SNF正常細胞): cBAF複合体はKREMEN2遺伝子のプロモーター領域に結合し、その発現を強力に抑制しています 。
- がんの状態(cBAF欠損細胞): SMARCB1などが欠損すると、cBAFによる抑制が外れ(脱抑制)、代わりにCBP/p300がプロモーター領域に集積します。これによりヒストンH3K27がアセチル化され、KREMEN2が異常に高発現します 。高発現したKREMEN2タンパク質は、細胞死誘導因子であるKREMEN1と結合してその機能を阻害し、がん細胞を死から守っています 。
- 治療時の反応(CBP/p300同時阻害): CBP/p300阻害剤を投与すると、KREMEN2の転写が停止します。KREMEN2がなくなると、抑制されていたKREMEN1が解放(単量体化)され、アポトーシス(細胞死)のスイッチがオンになります。
4. 創薬開発:新規CBP/p300二重阻害剤「CP-C27」
私たちは、CBPとp300の両方を強力かつ選択的に阻害する低分子化合物「CP-C27」を見出しました。 動物実験(マウス移植モデル)において、CP-C27はSMARCB1欠損腫瘍、SMARCA4/A2欠損肺がん、滑膜肉腫の増殖を顕著に抑制し、腫瘍の縮小をもたらしました。一方で、SWI/SNF正常がんや正常組織への影響は軽微であり、高い安全性(治療ウィンドウ)が示唆されています。
5. 今後の展望
本研究は、「エピゲノム制御因子のパラログ同時阻害」が、治療法のなかった難治性がんに対する画期的な治療戦略になることを示しました。 現在、製薬企業と連携し、このメカニズムに基づいた新規薬剤の臨床応用を目指した開発を進めています。対象となる患者さんは、希少がん(肉腫)から肺がんなどの主要ながんまで多岐にわたり、がんゲノム医療の新たな選択肢となることが期待されます。

