トップページ > 研究組織一覧 > 分野・独立ユニットグループ > がん治療学研究分野 > 研究プロジェクト > CBP欠損がんを対象とした合成致死治療法の開発
CBP欠損がんを対象とした合成致死治療法の開発
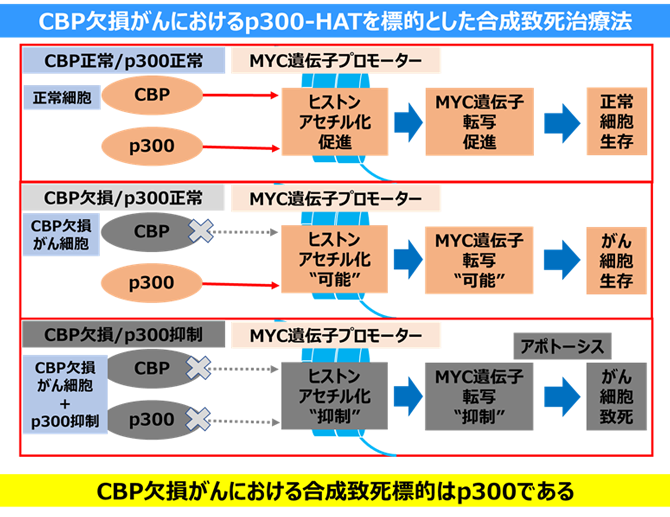
私たちは、肺がんやリンパ腫などの様々ながんで高頻度に機能喪失型の遺伝子異常があるCBP(CREBBP)遺伝子に着目しました。CBPは、ヒストンアセチル化酵素であり、ヒストンをアセチル化しクロマチン構造を緩ませる働きによって、転写やDNA修復などを促進する機能があります。CBP変異がんを対象とした治療標的を探索するために、網羅的siRNAスクリーニングによるCBPとの合成致死遺伝子を探索した結果、CBPの合成致死遺伝子としてp300を同定しました。おもしろいことに、p300もCBPと類似の機能をもつヒストンアセチル化酵素でした。CRISPR/Cas9システムによるゲノム編集技術を用いて作成したCBPノックアウト細胞において、p300を抑制すると細胞増殖に重要な遺伝子であるMYCの発現が抑制されることがわかりました。さらに、CBPとp300はどちらもMYCの遺伝子のプロモーター領域のヒストンをアセチル化するために必要であることが分かりました。そして、CBPノックアウト細胞において、p300を抑制すると、MYC遺伝子のプロモーター領域のヒストンのアセチル化が消失し、さらに転写も抑制されることを明らかにしました。また、CBP機能喪失変異型の肺がん・血液がん細胞株は、siRNAでp300遺伝子の発現を抑制するだけではなく、p300阻害剤を用いることで選択的に合成致死となることが分かりました。しかし、CBP正常型の細胞ではp300を抑制しても致死性を示さないことから、p300阻害薬の副作用への影響は少ないことが示唆されました。したがって、CBP欠損がんにおいてp300阻害薬を用いた合成致死治療法は有望であると考えられました。
CBP欠損がん患者において、がん細胞以外の正常な細胞ではCBPとp300は両方機能しています。そのため、p300阻害薬を用いた治療を行った場合、正常細胞においてCBPは機能できることからMYC遺伝子を発現させることができます。そのため副作用の可能性が低いことが予想されます。一方で、CBPが欠損したがん細胞では、p300阻害薬を用いた治療によって、CBPとp300の両方が機能できなくなることで、MYC遺伝子が発現できなってしまいます。そのためCBP欠損がん細胞は選択的に致死となることが考えられます。つまり、CBP欠損がんを持つ患者さんに対してp300阻害薬を用いた新しい分子標的治療が有効かもしれません。現在、その治療を実現すべく製薬企業と共同研究でp300阻害剤の開発を検討しています。
参考文献
Ogiwara H, Sasaki M, Mitachi T, Oike T, Higuchi S, Tominaga Y, Kohno T.
Targeting p300 Addiction in CBP-Deficient Cancers Causes Synthetic Lethality by Apoptotic Cell Death due to Abrogation of MYC Expression.
Cancer Discov. 2016 6:430-445.
https://www.ncbi.nlm.nih.gov/pubmed/26603525
がん研究センタープレスリリース
2015年12月09日
肺小細胞がんや悪性リンパ腫など合成致死に基づく新しいがん治療標的を発見
https://www.ncc.go.jp/jp/information/pr_release/2015/1209/index.html

