トップページ > 研究組織一覧 > 分野・独立ユニットグループ > 独立ユニットグループ > がん細胞内トラフィック研究ユニット
がん細胞内トラフィック研究ユニット
研究室の紹介
私達と共同研究者のグループは、白血病・消化器がん・肺腺がん ・骨髄腫の原因の一つであるドライバー遺伝子産物の異常な細胞内局在 (mis-localization), そこから発信される無限細胞増殖シグナルの分子メカニズムの解明に取り組んでいます。
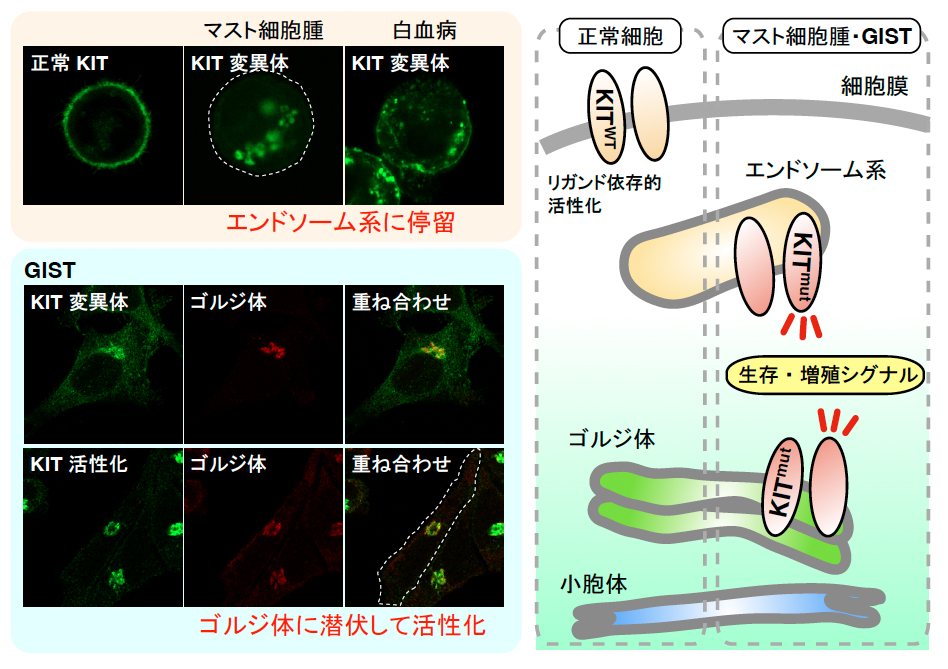
本研究グループは、マスト細胞腫や消化管間質細胞腫 (gastrointestinal stromal tumor: GIST) の主な原因であり、分子標的薬のターゲットとして重要な 「受容体型チロシンキナーゼKITの変異体」 が、予想外に、エンドソーム系やゴルジ体等のオルガネラに異常局在し、そこをシグナルの場とすることを見出しました (Nat. Commun. 2014; Oncogene, 2017; Cancer Lett. 2018)。さらに、実臨床で問題となる標的薬抵抗型KIT変異体についても同様であることを報告しました。また、白血病やメラノーマのKIT変異体についてもゴルジ体でのシグナル伝達を示唆する結果を得ています (CC&S, 2019)。正常細胞の野生型KITが主に細胞膜で機能するので、これまで、がんの変異型KITも細胞膜で増殖指令を発信していると考えられてきましたが、実はそうではなく、オルガネラがシグナルのプラットホームとなることが強く示唆されます (下図)。この発見は、以下の新たな疑問と重要な課題を生じさせています。
- 他のがん (白血病, 肺腺がん, 骨髄腫等) のレセプターチロシンキナーゼ (EGFR, FLT3, MET, PDGFRA/B, FGFR1-4) もオルガネラに停留してシグナル発信するのか?
- チロシンキナーゼ以外の変異シグナル分子 (KRAS, NRAS等) の機能破綻にも局在異常が重要だろうか?
- オルガネラ停留・潜伏の原因となる分子メカニズムはどのようなものか?
- 局在異常のメカニズムの理解に基づいた新規分子標的薬の基盤的開発および概念実証
これまで本グループに蓄積された細胞内トラフィックとリン酸化シグナル研究のノウハウを活かし、上記について、ベーシックな分子生物学・生化学実験と蛍光イメージングに加え (Cell Rep. 2019; Cancer Sci. 2022)、共同研究によって最先端の三次元超解像ライブイメージングを実施し、課題解決を目指しています。また、実臨床で用いられている分子標的薬や、開発中の治療薬について、投与時のターゲット分子の機能阻害と局在変化の相関を見出しており (PLOS ONE, 2017; Cancer Lett. 2018; BJC, 2020)、そのような概念実証研究によって治療薬の理解においても役割を果たしたいと考えております。
当ユニットで連携大学院生, 任意研修生として研究したい方は、小幡 (yuobata@ncc.go.jp) までご連絡くださいませ。