トップページ > 研究所について > OUR RESEARCH FOCUS > サイレント変異から発がん遺伝子RASの弱点発見
KW:肺がん、薬剤耐性、発がん遺伝子、融合遺伝子、EGFRサイレント変異から発がん遺伝子RASの弱点発見

日本で年間7万人以上が肺がんで亡くなられています。日本人肺腺がんの半数にEGFR遺伝子変異があり、このタイプにはEGFR阻害剤が効きますが、1-2年で耐性を獲得して効かなくなることが問題です。これまでEGFR変異肺がんの薬剤耐性について研究をしてきた中で、CRISPRゲノム編集技術を応用してがん細胞が元々持っているDNAを直接編集した細胞モデルを構築することで得られた2つの研究成果を報告させて頂きます。
RAS遺伝子変異による発がんに関わる新たなメカニズムとその弱点を発見し核酸医薬による新規治療を提唱ーNature誌ー
KRAS、NRAS、HRAS遺伝子はRASファミリー遺伝子と呼ばれる最多の発がん遺伝子ファミリーで、全てのがんの約3割で変異が検出されます。これらの遺伝子自体の発見から約40年経ちますが、治療薬開発に成功したのは2021年に承認されたKRAS G12C変異阻害剤のみです。
今回、EGFR肺がんがEGFR阻害剤で治療された後の薬剤耐性機序としてのKRAS変異をCRISPRゲノム編集モデルで調べたところ、KRAS G12C、G12D、A146T変異は予想通り薬剤耐性を示しましたが、KRAS Q61K変異だけはなぜか耐性となりませんでした。このKRAS Q61Kは、肺がん・大腸がんなどの発がん遺伝子変異として確立しているにも関わらず、なぜか薬剤耐性とならない (=発がん性がない)という予想外のデータでした。詳細な解析を進めていくと、KRAS Q61K単独では発がん性がなく、なぜかすぐ隣のコドンG60にアミノ酸を変化させない「サイレント変異G60G」が同時に起こると初めて発がん性を持つことを発見しました。サイレント変異は従来その名の通り「サイレント」、つまり「アミノ酸を変化させない=タンパク質も変わらない=生体における機能も変わらない」として臨床的に無視され、次世代シークエンサーで検出されても報告すらされない類の変異です。そのようなサイレント変異が発がんに必須という驚くべき事実でした。
さらに解析を進め、実はKRAS Q61Kだけでなく、RASファミリー遺伝子KRAS、NRAS、HRASのQ61周辺にはがんにとって致命的な弱点があることを発見しました。DNAの遺伝情報がmRNAに転写される際に、余分なイントロンを切り離してエクソンのみをつなげるスプライシングが起こりますが、発がん変異KRAS Q61Kが生じると異常なスプライシングによってがんは自滅してしまうことがわかりました。この弱点をがんはサイレント変異とスプライシング制御因子ESEによって巧妙に回避する仕組みを解明しました。それを逆手にとって、がん細胞だけでスプライシング異常を誘導して自滅させる新しい治療法の効果を細胞実験とマウス実験から示しました。RAS Q61変異のあらゆるがん種に対する本治療法の実用化と、他の遺伝子変異を持つがんへの応用が期待されます。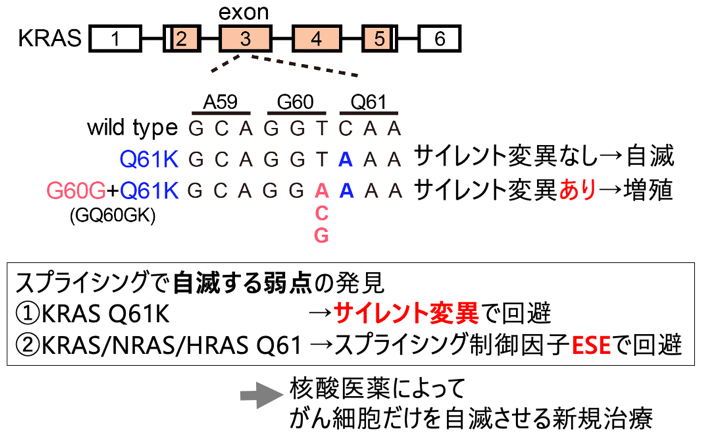
薬剤耐性の原因となっている融合遺伝子の見分け方と克服法を提唱ーNature Communications誌ー
EGFR変異のある肺がん504例で生じている融合遺伝子を包括的に調べました。遺伝子解析で検出される多くの融合遺伝子候補のうち、実際に薬剤耐性の原因となっているのは一部であり、その見分け方と克服するための有効な併用療法を細胞実験と臨床データから提唱しました。融合遺伝子によって薬剤耐性となった肺がんへの治療応用が期待されます。
プレスリリース・NEWS
研究所 分子病理分野 小林 祥久が第11回 後藤喜代子・ポールブルダリ科学賞 特別賞、第8回 日本核酸医薬学会 奨励賞を受賞しました(2023年7月24日)
研究所 分子病理分野 小林 祥久が令和5年度 科学技術分野の文部科学大臣表彰 若手科学者賞を受賞しました(2023年4月7日)
研究所 分子病理分野 小林 祥久が日本肺癌学会 篠井・河合賞を受賞しました(2022年12月26日)
EGFR変異肺がんの薬剤耐性機序としての融合遺伝子の包括的研究 薬剤耐性の原因となっている融合遺伝子の見分け方と克服法を提唱(2022年10月7日)
RAS遺伝子変異による発がんに関わる新たなメカニズムとその弱点を発見し核酸医薬による新規治療を提唱ーNature誌ー(2022年3月3日)
研究者について
分子病理分野 研究員 小林 祥久
キーワード
肺がん、薬剤耐性、発がん遺伝子、融合遺伝子、EGFR

