トップページ > 研究組織一覧 > 分野・独立ユニットグループ > ゲノム生物学研究分野 > 研究プロジェクト > 個別化がん治療法の研究
個別化がん治療法の研究
2019年6月より、がん遺伝子パネル検査が保険医療として行われるようになりました。保険医療では、当センターとシスメックス社/理研ジェネシス社で開発されたNCCオンコパネル検査も用いられ、遺伝子の変化に基づいて治療法を選択する「がんゲノム医療」の基盤となっています。
国立がん研究センターだより: 保険適応になった NCC オンコパネル検査
国立がん研究センターが開発した日本人のための国産がんプロファイリング検査「OncoGuide NCCオンコパネルシステム」が、コンビネーション医療機器として製造販売承認取得
国立がん研究センターが開発した日本人のための国産がんプロファイリング検査「OncoGuide NCCオンコパネルシステム」保険適用
がん遺伝子パネル検査後の新たな治療選択肢 適応外使用を患者申出療養制度のもと多施設共同研究として実施
2023年9月 プレスリリース:JCA-永山賞(旧 JCA-CHAAO賞)を受賞「NCCオンコパネルの医療実装によるがんゲノム医療の始動」
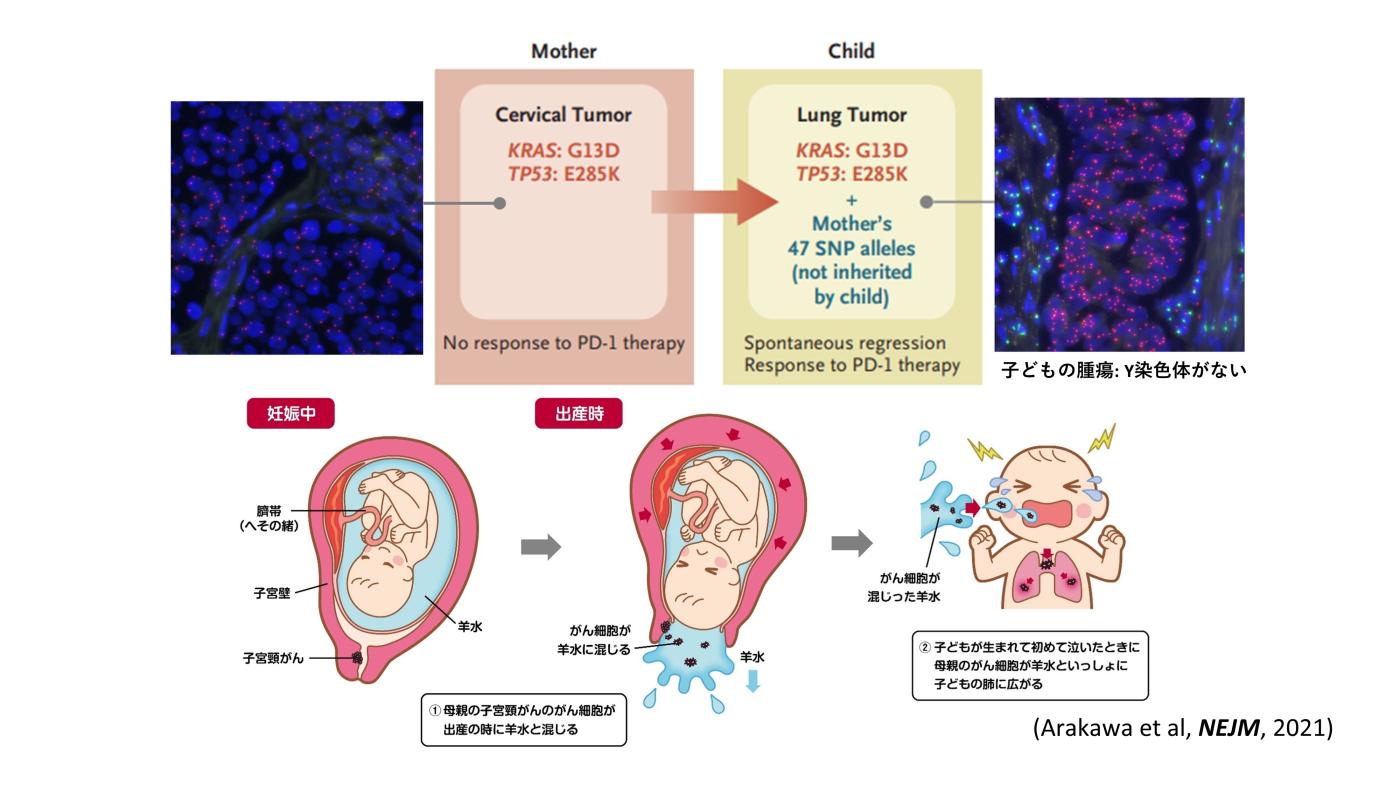
がん遺伝子パネル検査が医療現場に導入されることで、がんの新しい病因の発見、正確な病態の把握が可能となると期待されます。例えば私たちは、母子間でのがん遺伝子パネル検査の結果の類似性に基づいて、母親の子宮頸がんが羊水を介して出産時に子供の肺に移行し、小児肺がんの原因となることを世界で初めて発見しました。
● 2021年1月7日 母親の子宮頸がんが子どもに移行する現象を発見ーNew England Journal of Medicine誌に論文発表ー
(Cancer Discovery誌に解説記事も掲載されています)
一方、がんのゲノム上には、意義不明変異 (VUS: variants of unknown significance) と呼ばれる病的意義の不明な変異や、染色体領域の欠失などがんの発生・進展における役割の不明な遺伝子変化が数多く存在します。私たちは、ゲノム解析やコンピューターサイエンスの手法を用いて、意義の解明に取り組んでいます。
2-1) In silico解析を利用したRET遺伝子上の薬剤耐性変異の意義付け
RET遺伝子融合は、2012年当分野で新しい肺がん治療標的分子として発見され、全国遺伝子診断ネットワーク「LC-SCRUM-Japanに基づいて同定された陽性例を対象としたRET阻害薬の治験が行われています。我々はRET阻害薬バンデタニブが奏効した後に耐性化した肺がんのRET遺伝子上に生じた二次変異について、X線構造解析、スーパーコンピュータ「京」等を用いた分子動力学シミュレーションなどを組み合わせた機能ゲノム解析を行うことで、これまでとは異なる新しい薬剤耐性機構を発見しました。
X線構造解析、スーパーコンピュータ「京」等を用いた分子動力学シミュレーションなど、複合的な解析を行ったところ、この変異は、遠隔的にRETタンパク質の薬剤や基質であるアデノシン3リン酸の結合部位となる領域の3次元構造を変化させる効果を持つことが示されました。このアロステリック効果により、変異タンパク質では、酵素活性の上昇と薬剤結合の低下が生じ、薬剤に耐性となると考えられます。このような分子動力学シミュレーションを用いたin silico手法は、意義の不明な薬剤耐性候補変異の解釈に有用であると期待されます。
Nakaoku T, Kohno T*, et al. Nature Commun, 2018
2018年 2月14日 プレスリリース
様々ながんで見られる変異を集めたGENIEデータベースに登録される7万個以上の遺伝子変異に対して、コンピュータを用いるインシリコ技術によりがんの進化の過程での正の選択やタンパク質の可動性への影響を推定しました。その結果、RET遺伝子の意義不明変異の中に、治療標的となる新たな変異群が存在することを発見しました。この変異は、RET遺伝子のCaイオン結合モチーフ (CaLM, カルモジュリン様モチーフ) に存在し、肺がん、大腸がん、乳がんなど複数のがんで見られました。「富岳」「TSUBAME3.0」など複数のスーパーコンピュータを用いた分子動力学シミュレーションから、このCaLM変異はRETタンパク質とCaイオンの結合を低下し、RETタンパク質の可動性を高めるなど大きな影響を持つことが推定されました。
Tabata J, Nakaoku T et al, Cancer Res, 2022.
2022年9月27日プレスリリース
2-2) 間質性肺炎を合併した肺腺がんの治療ストラテジー
間質性肺炎は肺胞構造の破壊と線維化をもたらす病気で、肺がんのリスクを高める重要な因子です。一般的な肺がんにおいては、発がんの原因となるドライバー遺伝子が多数同定されており、そのがん遺伝子に対する特異的分子標的薬が奏功することが知られています。しかし、間質性肺炎合併肺がんに特徴的ながん遺伝子異常や発がん機構については明らかではありませんでした。このような背景から、研究グループは今回間質性肺炎合併肺腺がんに注目してゲノム網羅的な遺伝子解析を行いました。
間質性肺炎合併肺腺がんには特徴的な肺発がん経路が存在し、他の肺腺がんと異なり、分子標的治療の適応例は少なく、他の抗がん剤などを用いた治療ストラテジーが適していることが明らかになりました。また、肺の形成や働きにかかわる遺伝子群の機能を失わせるような変異が間質性肺炎合併肺腺がんで高頻度に見られ、患者さんの悪性予後と関連することを見出しました。
2018年8月21日 プレスリリース
Honda T et al, JCO Precis Oncol, 2018.
2-3) 肺がん脳転移をドライブする遺伝子変化
肺がんは進行に従い脳転移を起こすことが多く、患者さんの予後を悪くします。私たちは、肺がん患者さんのがん組織に生じているゲノム変化を調べることで、脳転移を生じた肺がんには15番染色体長腕の一部(15q15領域)の欠失が多いことを発見しました。欠失領域にはMYCシグナルを抑制する働きを持つ遺伝子であるMGAが含まれており、15q15欠失を伴う肺がん細胞の増殖は、酸化的リン酸化を標的とする薬剤によって阻害されやすいことが示されました。今後、この知見をもとに、肺がん患者さんの脳転移の予測や治療法の開発にを進めたいと考えています。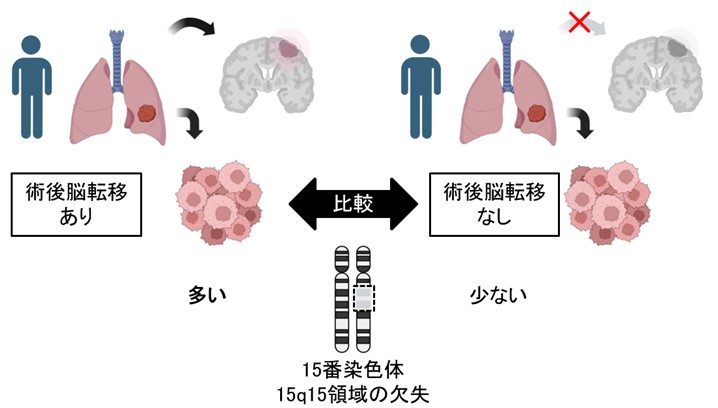
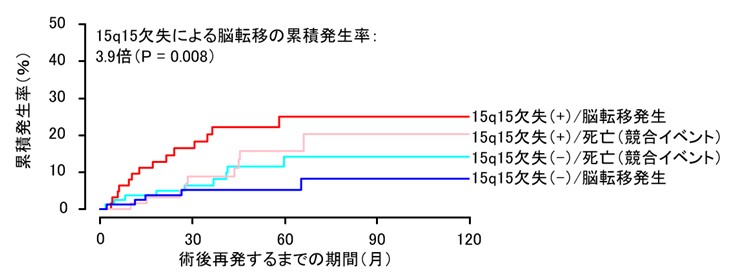
Miyakoshi J et al, Journal of Thoracic Oncology, 2026.
2025年12月18日 プレスリリース
なお、以下の研究については、2019年9月1日より「がん治療学研究分野」に移動しました。
2-4) クロマチン制御因子欠損がんに対する合成致死治療法の開発
Ogiwara H*, Takahashi K, Sasaki M, Kuroda T, Yoshida H, Watanabe R, Maruyama A, Makinoshima H, Chiwaki F, Sasaki H, Kato T, Okamoto A, Kohno T*. Targeting the vulnerability of glutathione metabolism in ARID1A-deficient cancers. Cancer Cell, 2019, 35(2):177-190.e8.
Kuroda T, Ogiwara H*, Sasaki M, Takahashi K, Yoshida H, Kiyokawa T, Sudo K, Tamura K, Kato T, Okamoto A, Kohno T*. Therapeutic preferability of gemcitabine for ARID1A-deficient ovarian clear cell carcinoma. Gynecological Oncol, 2019.
Ogiwara H, Sasaki M, Mitachi T, Oike T, Higuchi S, Tominaga Y, Kohno T. Targeting p300 Addiction in CBP-Deficient Cancers Causes Synthetic Lethality by Apoptotic Cell Death due to Abrogation of MYC Expression. Cancer Discov. 2016 6時43分0-445.
Oike T, Ogiwara H, Tominaga Y, Ito K, Ando O, Tsuta K, Mizukami T, Shimada Y, Isomura H, Komachi M, Furuta K, Watanabe S, Nakano T, Yokota J, Kohno T. A synthetic lethality-based strategy to treat cancers harboring a genetic deficiency in the chromatin remodeling factor BRG1. Cancer Res. 2013 73:5508-5518.
がん研究センタープレスリリース
2019年1月25日
日本人に多い卵巣明細胞がんなどでみられるARID1A遺伝子変異がんを対象に代謝(メタボローム)を標的とした新たながん治療法を発見
2015年12月09日
肺小細胞がんや悪性リンパ腫など合成致死に基づく新しいがん治療標的を発見

