医師主導治験
目次
| 1.施設選定(随時) | 8.治験審査委員会 |
| 2.CRC派遣依頼(随時) | 9.指示決定通知 |
| 3.責任医師調整委員会(毎月第1火曜日) | 10.契約 |
| 4.申請前ヒアリング | 11.付随研究について |
| 5.試験準備(随時開始) | 12.監査・モニタリング |
| 6.申請書類提出 | 13.治験実施中~終了までの手続き |
| 7.書面調査 | 14.その他 |
1.施設選定(随時)
全体的事項については、医療機関情報をご確認ください。その他の施設選定調査に係る問い合わせは、IIT事務局(iit_crc●east.ncc.go.jp(●を@に置き換えください))宛てにメールでお問い合わせください。
治験責任医師認定制度
当院では2013年度より、治験責任医師の認定制度を導入しており、認定者以外は、治験責任医師になることができません。 新たな治験において治験責任医師を依頼する場合には、認定者であることをご確認ください。
治験責任医師認定に関する問い合わせは、CRC派遣依頼担当(crc-haken●east.ncc.go.jp(●を@に置き換えください))宛てにメールでお問い合わせください。
2.CRC派遣依頼(随時)
医師主導治験の実施を検討されている医師の方は、CRC派遣依頼票を臨床研究コーディネーター室長へご提出ください。
CRC派遣依頼票
提出先:crc-haken●east.ncc.go.jp(●を@に置き換えください)
医師主導治験実施には、治験審査委員会への申請の他、各種手続きが必要となります。CRC派遣依頼票は可能な限りお早目にご提出ください。
3.責任医師調整委員会(毎月第1火曜日)
治験責任医師調整委員会(月1回・毎月第1火曜日開催)にて、臨床研究コーディネーター室で受託する試験及びIRB審議時期を決定します。治験責任医師・治験依頼者に対して、当該治験へのCRC派遣決定と担当CRCをお知らせします。
4.申請前ヒアリング
必要に応じて、担当CRCへご相談ください。
5.試験準備(随時開始)
利益相反(COI)
医師主導治験に携わる医師は、利益相反申告が必ず必要となります。COI委員会の審査を受けていただき、審査結果を治験審査委員会に提出します。
詳細については、「利益相反申請サイト」「利益相反管理について(院内限定)」をご確認ください。
各種アカウント申請
- 電子カルテ
電子カルテアカウントの申請は、「電子カルテ閲覧に伴うID申請について」をご確認ください。
- DDworksNX/Trial Site
治験申請手続きは、DDworksNX/Trial Siteシステム(以下「DDTS」という)を利用した電子申請となります。 IRB審議資料および治験審査結果通知書は、DDTSより交付されますので、調整事務局ご担当者はアカウントの申請をお願いします。 また、責任医師保管資料はDDTS上に保管されますので、モニタリングご担当者も申請が必要となります。(課題毎の申請が必要です)
申請には、「電子申請(DDworksNX/Trial Site)」のページをご確認の上、「TS利用申請書2_試験担当者変更追加」の申請書をご利用ください。
新規試験登録はIIT事務局が行いますので、「TS利用申請書1_新規試験登録」の用紙は原則使用しないようご注意ください。また、初回のみ調整事務局ご担当者様の登録はIIT事務局が行います。
各部署 試験準備
6.申請書類提出
IRB申請締め切りの4週間前までにiit_crc●east.ncc.go.jp(●を@に置き換えください)へ、必要書類をご提出ください。施設固有の資料については、施設にて作成します。
注)申請書類における実施医療機関の長は、「国立研究開発法人 国立がん研究センター 理事長」と記載ください。
注)付随研究が実施される場合は、参考資料(ドラフト版でも可)として、付随研究の実施計画書および説明・同意文書(オプトアウトでない場合)をご提供ください。
なお、付随研究の資料は、IRB審議対象ではありません。
<新規申請における必要書類一覧>画像をクリックするとPDFファイル(225KB)が開きます
7.書面調査
新規申請から5~25日後に治験審査委員による書面調査が実施されます。書面調査にて治験審査委員から意見があった場合には、治験責任医師から治験審査委員長宛に回答書を提出します。
8.治験審査委員会
9.指示決定通知
治験審査委員会終了後から1週間程度で、治験審査委員会の結果を踏まえ、理事長からの指示・決定通知書が発行されます。
10.契約
研究費に関して資金提供があり、契約が必要な場合においては、治験事務室までお問合せください。
11.付随研究について
当院で実施する治験の附随研究について、「(1)人を対象とする医学系研究に関する倫理指針(医学系指針)」または「(2)ヒトゲノム・ 遺伝子解析研究に関する倫理指針(ゲノム指針)」の指針を遵守し実施する場合においては、研究倫理審査委員会での審査となります。
(1)(2)の両指針は統合され、2021年3月23日付けで「人を対象とする生命科学・医学系研究に関する倫理指針」が制定されました。
12.監査・モニタリング
監査・モニタリングの実施には、事前のご予約が必要となります。
詳細については、「監査・モニタリング」のページをご確認ください。
モニタリング報告書について
モニタリング報告書は、モニタリングご担当者よりDDTSを介し責任医師及び実施医療機関の長へのご提出をお願いします。
「電子申請(DDworksNX/Trial Site)」のページ内、
「DDworkNX/Trial Siteシステム化業務フロー(PDF:1.8MB)」および
「依頼者様へのお願い ・交付先選択、資料名称、件名等について東病院(PDF:0.4MB)」を必ずご確認の上、ご提出ください。
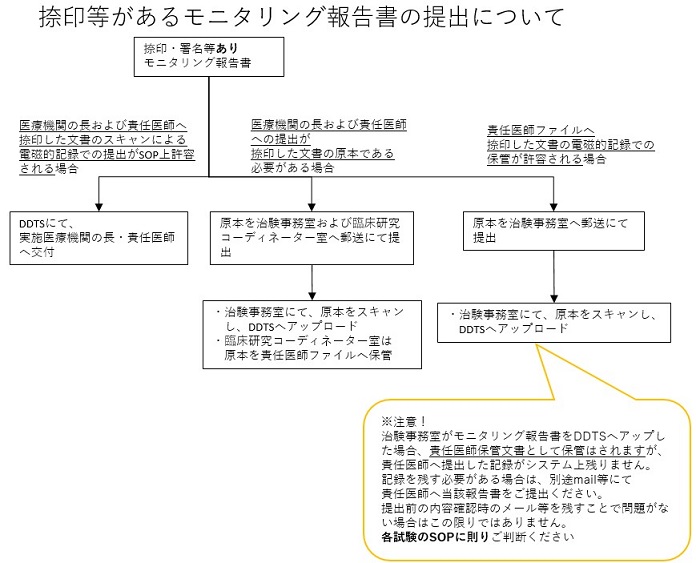
なお、捺印等があるモニタリング報告書の提出については、当院では下記運用となっております。
<捺印等があるモニタリング報告書の提出>
画像をクリックするとPDFファイル(330KB)が開きます
注)モニタリング報告書には、治験課題名の記載が必要です。
ご提出いただくモニタリング報告書に治験課題名の記載が無い場合には、モニタリング報告書カバーレターを添付ください。
モニタリング報告書カバーレター
13.治験実施中~終了までの手続き
変更/安全性情報/逸脱報告/継続審査/終了報告等の各申請については、統一書式を用いて治験責任医師より治験事務室への提出が必要となります。
申請手続きの詳細については、IIT事務局(iit_crc●east.ncc.go.jp(●を@に置き換えください))へお問合せください。
注)変更申請のICFにつきましては、原則IRB申請締め切りの10日前までにご提出ください。
施設固有の資料については、施設にて作成するためお時間を要します。
それ以降にご提出頂きましたものは、次回IRB申請となりますので、ご注意ください。
14.その他
外部機関との連携契約(秘密保持契約等)については、CRC派遣依頼担当(crc_haken●east.ncc.go.jp(●を@に置き換えください))までお問合わせください。