トップページ > がんゲノム医療 > 小児がんの子どもたちの治療薬の架け橋に(小児の患者申出療養)
小児がんの子どもたちの治療薬の架け橋に(小児の患者申出療養)
更新日 : 2025/12
小児・AYAがんに対する遺伝子パネル検査結果等に基づく複数の分子
標的治療に関する患者申出療養について(NCCH2220)
試験概要
- 国立がん研究センター中央病院は、患者申出療養制度を利用して適応外薬または未承認薬の使用を希望する小児・AYA世代のがん患者さんを対象とした医師主導臨床試験を行っています。
- 小児・AYA世代のがん患者さんの薬剤アクセスの向上を目指しており、対象医薬品は全て製薬企業より無償提供を受けることにより、より少ない負担で適応外薬または未承認薬の使用が可能になります。対象となる医薬品を複数準備しています。
試験目的
- 小児・AYA世代のがん患者さんの薬剤へのアクセス改善に貢献することを目指し、将来的に医薬品の適応拡大などに利用可能な情報を集めること
- 各医薬品の安全性(副作用)および有効性を評価すること
立案の背景
- がん遺伝子パネル検査により、治療の手がかりとなる遺伝子異常が見つかることが増えていますが、欧米で有効性が報告された医薬品が日本では適応外・未承認で使用できないケースが多くあります。
- 日本人における有効性および安全性が確認されていない薬を患者さんが個人輸入して使う例もありますが、第三者による監視体制下で行われる試験としてより安全な形で投与し、客観的なデータを収集するためには、臨床試験の形で投与することが重要です。
- 日本では、小児・AYA世代のがんに対しては、特に承認薬や臨床試験の数が欧米に比べて少ないのが現状で、先行する様々な臨床試験においても小児がん患者さんは対象になっていないことが多くあります。
上記のような背景をもとに、日本の小児・AYA世代のがん患者さんが希望する治療を受けられるよう、この臨床試験を立案しました。
試験の詳細
- 再発・難治性の小児・AYA世代のがん患者さんを対象に、患者さんの申出を起点として適応外薬や未承認薬を投与する臨床試験です。
- 使用する医薬品は、国内外で小児を対象とした臨床試験が実施済みで、一定の安全性が確認されている医薬品です。
- 日本で小児に対する投与方法が定められていない薬は、海外の承認情報や治験結果をもとに、安全性に配慮した用法・用量を設定しています。
- 投与を希望する医薬品を用いた治験や臨床試験が存在しない場合や、条件が合わずに治験や臨床試験に参加できない場合であっても、本試験に参加することで希望する医薬品を投与できる可能性があります。
- 本試験にかかる費用は国立研究開発法人日本医療研究開発機構(AMED)の研究費(注意1)により賄われています。経過中の検査料や入院料等などは保険診療の範囲で患者さんのご負担となります。
注意1: 国立研究開発法人日本医療研究開発機構(AMED) 「臨床研究・治験推進研究事業」
「小児・AYA がん患者の薬剤アクセスの改善と薬事承認に利活用可能なデータ収集を目的とした患者申出療養制度に基づく特定臨床研究」
1. 対象(主な適格規準)
以下の1から3のいずれかの条件を満たす方が対象となります。
- 保険適用、または先進医療などの評価療養で実施されたがん遺伝子パネル検査を受けて、何らかの適応外薬もしくは未承認薬の投与が、がん遺伝子パネル検査の結果を検討する専門家による会議(エキスパートパネル)および担当医から推奨されている(注意2)
- 分子標的薬の有効性が示されている病気に対して、日本の成人では薬事承認されている薬はあるが、添付文書に小児の用法用量の記載がない(注意3)
- 分子標的薬の有効性が示されている病気に対して、海外で小児に薬事承認されている薬はあるが、日本で小児の用法用量や効能効果の記載がない(注意4)
注意2: がん遺伝子パネル検査で、Aがんに対して遺伝子異常Bが見つかり、専門家会議(エキスパートパネル)と担当医が検討した結果、医薬品Cの効果が期待できると判断した場合
→本試験に参加することで、医薬品Cを使用することができます。
注意3: 日本で販売されている医薬品Aが「切除不能なBがん」に対し、日本で承認されているが、15歳未満の小児に対しては承認されていない場合
→「切除不能なBがん」の15歳未満の患者さんが本試験に参加することで、医薬品Aを使用することができます。
注意4: 「切除不能なAがん」について、医薬品Bが海外(米国や欧州)では小児に対し承認されているが、日本では成人にも小児にも承認されていない場合
→「切除不能なAがん」の患者さんが本試験に参加することで、医薬品Bを使用することができます。
そのほかに以下の条件があります。
- がん組織の検査により、小児またはAYA世代の固形腫瘍と診断されていること。
- 標準的な治療法が存在しない、または標準治療が無効であること。
- 手術で切除することができないこと。
- 試験参加時点で0歳から29歳であること。
注意:対象年齢は医薬品によって変わることがあります。 - CTやMRI、骨髄検査などで腫瘍が確認できること。
- 条件を満たさないなどの理由により、治験や先進医療に参加できないこと。
- 検査の値が規準を満たすこと。
2. 参加施設(実施医療機関)
- 国立がん研究センター中央病院
- 北海道大学病院
- 名古屋大学医学部附属病院
- 岡山大学病院
- 九州大学病院
3. 医薬品リスト
2025年12月1日現在
| 分類 | 一般名 | 販売名 | 製造販売業者 | 承認状況 | |
|---|---|---|---|---|---|
| 1 | BCR/ABL 阻害薬 | イマチニブメシル酸塩 | グリベック®錠100mg | ノバルティス ファーマ 株式会社 | 適応外薬 |
| 2 | マルチキナーゼ阻害薬 | パゾパニブ塩酸塩 | ヴォトリエント®錠200mg | ノバルティス ファーマ 株式会社 | 適応外薬 |
| 3 | JAK阻害剤 | ルキソリチニブリン酸塩 | ジャカビ®錠5mg ジャカビ®錠10mg | ノバルティス ファーマ 株式会社 | 適応外薬 |
| 4 | MEK阻害剤 | トラメチニブ ジメチルスルホキシド付加物 | メキニスト®錠0.5mg メキニスト®錠2mg メキニスト®小児用ドライシロップ4.7mg | ノバルティス ファーマ 株式会社 | 適応外薬 |
| 5 | 抗PD-L1 ヒト化モノクローナル抗体 | アテゾリズマブ (遺伝子組換え) | テセントリク®点滴静注840mg テセントリク®点滴静注1200mg | 中外製薬 株式会社 | 適応外薬 |
| 6 | マルチキナーゼ 阻害剤 | カボザンチニブ リンゴ酸塩 | カボメティクス®錠20mg | 武田薬品工業 株式会社 | 適応外薬 |
| 7 | EZH01月02日 阻害剤 | バレメトスタットトシル酸塩 | エザルミア®錠50mg エザルミア®錠100mg | 第一三共 株式会社 | 適応外薬 |
| 8 | チロシン キナーゼ阻害剤 | クリゾチニブ | ザーコリ®カプセル200mg ザーコリ®カプセル250mg | ファイザー 株式会社 | 適応外薬 |
| 9 | ドパミンD2 受容体拮抗薬 | ドルダビプロン塩酸塩 | OP-10 (開発番号) | 大原薬品工業 株式会社 | 未承認薬 |
| 10 | ODC阻害剤 | エフロルニチン塩酸塩 | IWILFIN™ | USWM, LLC | 未承認薬 |
医薬品はすべて企業からの無償提供
2025年12月現在、全てのコホートで登録中です
試験実施体制
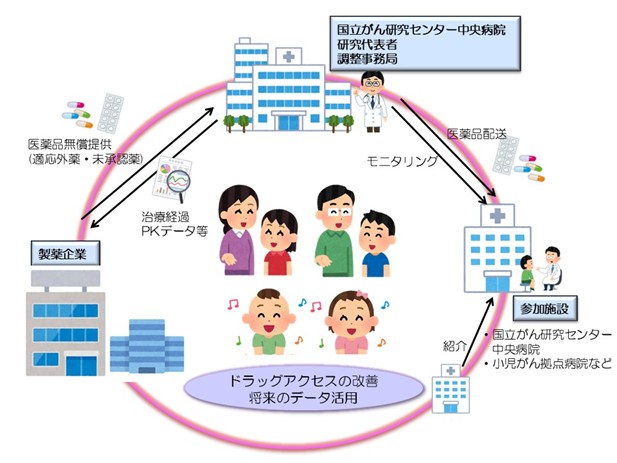
- 国立がん研究センター中央病院が全体の調整事務局となり、がんゲノム医療中核拠点病院および小児がん拠点病院等にて実施しています。
- 本試験の詳細は、臨床研究実施計画・研究概要公開システムをご確認ください(登録ID番号:jRCTs031230544)。なお、本試験は厚生労働省のページでは「遺伝子パネル検査結果等に基づく分子標的治療」(申出に係る療養の名称)と表記されています。
(https://www.mhlw.go.jp/topics/bukyoku/isei/kanja/kikan02.html(外部サイトにリンクします)) - 医薬品リストのPDF版はこちら(患者申出療養 医薬品リスト(PDF: 299KB))をご覧ください。
保険外併用療養費制度、患者申出療養とは
わが国の公的医療保険のもとでは、原則として、保険適用の療養と、保険適用がされていない療養を同時に併用することは許されていません。ただし、例外として、厚生労働大臣から、治験や先進医療といった評価療養、患者申出療養という制度の下で行うことが許された保険適用がなされていない療養については、例外的に保険診療と同時に併用することができます(保険外併用療養費制度といいます)。その保険適用外の療養にかかる費用は、患者さんから徴収することが可能となっています。詳しくは厚生労働省のホームページ(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iryouhoken/sensiniryo/index_00007.html(外部サイトにリンクします))をご確認ください。
先に述べた患者申出療養とは、困難な病気と闘う患者の思いに応えるため、先進的な医療について、患者さんの申出を起点とし、安全性・有効性等を確認しつつ、身近な医療機関で迅速に受けられるようにするものです。患者さんの申出をもとに、臨床研究中核病院が臨床試験を立案し、患者さんの希望する療養を臨床試験として実施する制度です。
制度に関する詳細は、厚生労働省のページ(https://www.mhlw.go.jp/moushideryouyou/(外部サイトにリンクします))をご確認ください。
注意点について
- 本試験で使用する医薬品は、国内または海外で小児に使用された実績があり、一定の安全性は確認されていますが、これまでに報告されていない副作用が出る可能性もあります。患者さんにより安全に治療を受けていただくため、本試験に参加する患者さんの体調などの条件には、一定の制限を設けています。
- 治療は、医薬品ごとに決められた用法・用量に従って実施します。
原則として単剤での治療を行います。 - 治療スケジュールや副作用の詳細については、医薬品ごとに異なります。
- 本治療に参加いただく前に、適切に治療を受けられるかを確認するための診察と検査を行います。
- 本治療に参加いただくにあたり、治療開始から約1か月間は入院、または入院に準じた環境で治療を受けていただきます。
- その後も1から2週間ごとに定期的な外来での診察や検査を受けていただく必要があります。
- 治療の効果を確認するため、治療開始から約2か月後に造影CTまたはMRI検査を行います。
その後も定期的な診察・検査を受けていただきます。 - 治療の進行中、必要に応じて追加の精密検査を行う場合があります。
担当医よりその都度ご説明しますので、ご理解とご協力をお願いします。