トップページ > 取り組み > 新薬の治験と臨床試験について > 新薬の治験と臨床試験について(依頼企業向け)
新薬の治験と臨床試験について(依頼企業向け)
- 当院来訪時のお願い(新型コロナウイルス感染症対策)
- 治験依頼企業相談窓口
- 治験参加に関する相談について
・先端医療科における固形がんを対象とした新薬早期開発試験(第I相試験)に関する
お問い合わせ(医療関係者向け)
注:上記のお問い合わせ先については各ページ中に掲載されております。
- 新治験費用算定・請求について (20240207)
- 新規申請の流れ
- 電子申請手続きについて(DDworksNX/Trial Site)
- 治験審査委員会の日程
- 変更手続きについて
- 安全性情報について
- 各種手続き要領
- 受託研究費等算定・請求要領
- 直接閲覧について NEW!
- 監査について
- 院内ネットワーク環境について
- CRC派遣依頼について
- 委嘱契約等について
- 各種申請書式・雛形(ダウンロード) NEW!
- 治験SOP(ダウンロード) NEW!
- 治験審査委員会 委員名(ダウンロード)
- 治験審査委員会 会議記録の概要(ダウンロード)
- 国立がん研究センター中央病院で実施している治験
- 治験実施状況(前年度までの実施状況を掲載)
- 臨床検査科 NEW!
- 放射線技術部(画像診断機器管理)
- 治験実施医療機関情報
- 治験薬管理体制(治験薬管理室について)
- 治験における病理検体の作製および依頼について
- 治験プロセス確認・原資料特定リスト NEW!
- お問い合わせ先
治験事務室 Eメール:chiken_CT●ml.res.ncc.go.jp(●を@に置き換えてください)
当院来訪時のお願い(新型コロナウイルス感染症対策)
当院への出入り業者の方々には、以下のとおりご対応をお願いいたします。
- 来訪時、管理棟警備員配置箇所(PDF:143KB)へ必ずお立ち寄りください。
- 警備員配置箇所において、「入館手続き」「体温測定」「入館証の受け取り」の後、病院棟や診療棟への入館の流れを徹底してください。
- 入館証の受け取りに伴い、直接閲覧等の終了後のご退出時も同様に警備員配置箇所へお立ち寄りいただき、「退出手続き」を実施してください。
病院棟や診療棟へのご訪問時に、入館証をお持ちでない場合には、お引き取りいただくことになりますので、ご注意ください。
当院の新型コロナウイルス感染症対策について「新型コロナウイルス感染症等の病院内伝播を防ぐために以下のご協力をお願いいたします」もあわせてご確認ください。
治験依頼企業相談窓口
当院に治験や製造販売後臨床試験を依頼される際に、以下のような対応を行っております。
施設選定のための情報提供
- 施設選定調査には、Eメール等でも対応させていただきます。
治験責任医師決定支援
- 特定のがん種を対象とする治験は、直接、診療科長にご相談ください。
- 実施診療科等についてご不明なことがありましたら、研究実施管理部長へご相談ください。
その他、治験および製造販売後臨床試験の実施に関する相談
お問い合せ先:先端医療科(または研究実施管理部長)
治験依頼企業相談窓口担当 電話番号:03-3547-5201 内線番号:2405
Eメール:chiken_CT●ml.res.ncc.go.jp(●を@に置き換えてください)
新規申請の流れ
受託研究の取扱いについては、国立研究開発法人国立がん研究センター受託研究取扱規程、および使用する書式については「「新たな『治験の依頼等に係る統一書式』」の一部改正について」(令和4年11月30日医政研発1130第1号,薬生薬審発1130第5号,薬生機審発1130第1号 厚生労働省医政局研究開発振興課長,医薬・生活衛生局医薬品審査管理課長,医薬・生活衛生局医療機器審査管理課長 連名通知)に基づき実施しております。
受託研究の依頼等に係る手続きは、治験事務室が執り行います。
お問合せ先:治験事務室 電話番号:03-3547-5201 内線番号:2405
Eメール:chiken_CT●ml.res.ncc.go.jp(●を@に置き換えてください)
治験計画立案時
治験の実施にかかる契約の前または実施中に、責任医師、分担医師、協力者として予定されている者等に対し、下記業務が発生する場合、あらかじめ契約等の手続が必要となります。
治験責任医師等予定による業務の内容
- PMDAの対面助言への同行等
- 治験計画に関する研究会等への参加(実施中の海外渡航を伴う研究会等への参加を含む)
新規申請手続きについて
<企業治験・製造販売後臨床試験の場合>
<製造販売後調査の場合>
費用に関する面談(製造販売後調査は除く)
新規申請(治験・製造販売後臨床試験)を予定されている場合は、申請予定日の1カ月前を目処に、治験依頼者(またはCRO)と治験事務室の間で研究費等費用に関する面談を行っております。なお、お申し込みにあたってはCRCの決定の有無は問いません。費用算定の根拠となる資料のご提供が可能な場合(FIX版である必要はありません)は、お申し込みいただけます。
面談のお申し込みは、治験事務室費用面談担当宛に下記の内容をご連絡ください。
- 依頼者名
- 担当モニター名
- 連絡先
- 責任医師名(予定)
- 契約希望月
- 面談希望日(第3希望日まで)
(毎回 16時から(1時間程度)行っております) - 提出資料:
・治験開始前業務契約書(案)(WORD:44KB)
・治験費用エクセルプロトコル(シート名:表紙・スケジュール・医師モニタリング・付帯情報)(ZIP:209KB)
注:パスワードが必要です。パスワードのご希望は下記のEメールにご連絡ください。
希望日に合わせて日程を調整のうえ、お返事いたします。
なお、ご希望日に添えない場合もございますので、あらかじめご了承ください。
お申込先:治験事務室 費用面談担当 Eメール:cost_ncch●ml.res.ncc.go.jp(●を@に置き換えてください)
当日は試験についての概要をご説明いただき、試験の実施および研究費等費用算出についての打合せを行います。
時間:16時から(1時間程度)
場所:WEBで実施
参加者:臨床研究コーディネーター室長(CRC統括)、治験事務室長、治験事務室担当、薬剤部
提出資料:治験実施計画書の説明資料、治験スケジュール(投与、観察、検査等、脚注を含む(治験実施計画書から抜粋))が判る資料
(治験実施計画書の抜粋で差し支えありません)
注:資料は事前に電子媒体の資料を下記のEメールにご提出ください。
- 治験依頼書(案)
注:治験審査委員会の会議の記録の概要に用いる公開用治験課題名を確認させていただきます。 - 治験の費用負担に関する事前確認事項(案)(WORD:40KB)
- 治験費用関連エクセルプロトコル(Visitスケジュール(案)含む)
新規申請
電磁的記録利用システムDDworksNX/Trial Site(以下「DDTS」という)を利用した申請手続きとなります。
申請書類の提出期限(委員会開催日の4週間前)までに各手続要領に基づき治験の依頼等に係る統一書式を用いて必要な資料をDDTSにてご提出ください。
新規契約に関する書類の提出については、新規申請時に併せて下記の資料を治験事務室新規契約担当者にご郵送等ください。
- 契約書(案)
覚書(案)(必要時) - 費用にかかる書類
治験費用関連エクセルプロトコル(治験経費算出表(合意後の確定版)含む)
治験の費用負担に関する事前確認事項(該当する場合)(依頼者様押印不要)
<新規申請手続きの流れ>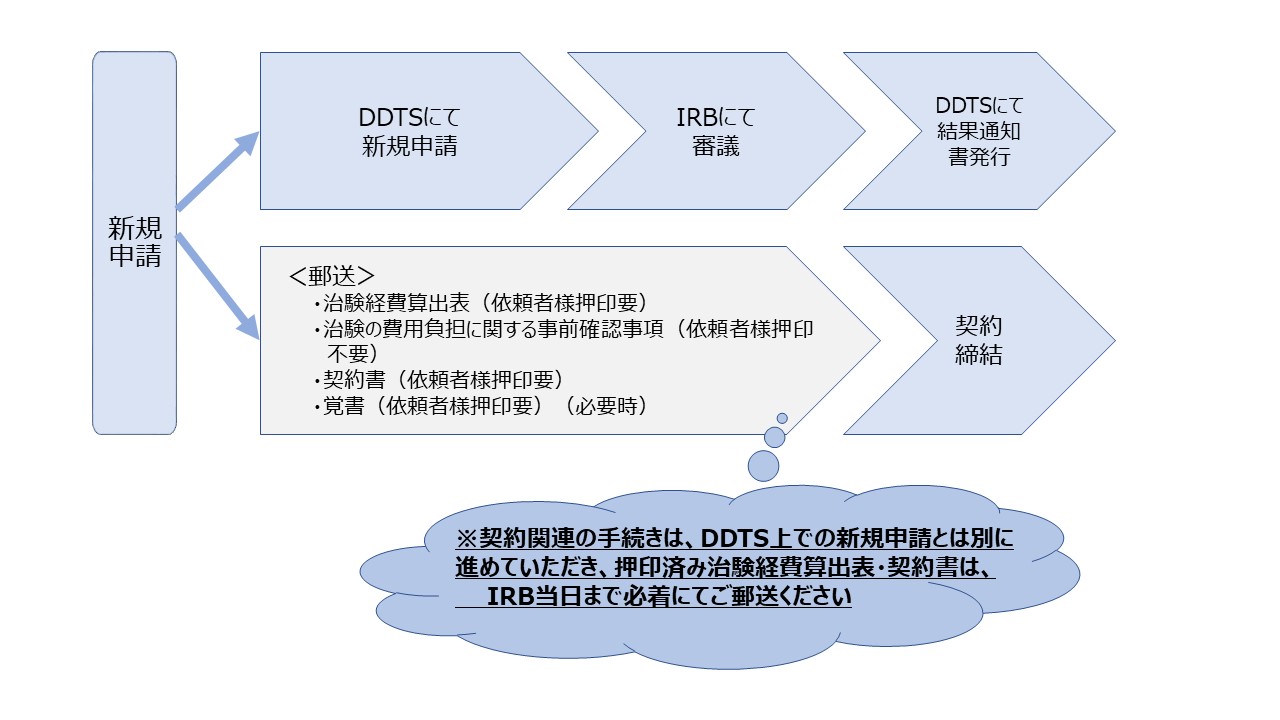
新規審査については、通常翌月の治験審査委員会で審査予定となります。

なお、ご不明な点は、治験事務室にお問い合せください。
お問い合せ先:
DDTS利用の新規申請に関する場合は、治験事務室 新規申請担当 Eメール:chiken_CT●ml.res.ncc.go.jp(●を@に置き換えてください)
費用・契約に関する場合は、治験事務室 新規契約担当 Eメール:cost_ncch●ml.res.ncc.go.jp(●を@に置き換えてください)
郵送宛先:郵便番号104-0045 東京都中央区築地5-1-1 国立研究開発法人国立がん研究センター中央病院 治験事務室 新規契約担当宛て
契約
IRBの承認後、5営業日以内で契約を締結いたします。契約は2者契約となりますので、契約書は2通作成し、当センターが1通所持いたします。
契約後
治験・製造販売後臨床試験については、関連書類を手続要領(PDF:184KB)に従って各部署へご提出ください。
電子申請手続きについて(DDworksNX/Trial Site)
当センターでは、治験関連文書を原則電子保管とすることを目的として、DDTSを導入いたしました。
DDTSアカウント発行申請
当院におけるDDTSアカウント発行の申請は、以下のとおり課題ごとにメールにて申請書をご提出ください。
申請書作成の際は、各FORMの記入例を参考に作成をお願いします。
新規申請の場合には、早めにご提出いただきますようお願いします。
課題担当者変更の場合は、削除申請が必要となりますので、お手続きをお願いします。
申請書式
- TS利用申請書1_新規試験登録(EXCEL:32KB)
ダウンロードファイル名:【FORM1_newlyregi】 - TS利用申請書2_試験担当者変更追加(EXCEL:40KB)
ダウンロードファイル名:【FORM2_user-deladd】 - TS利用申請書3_利用者情報変更(EXCEL:20KB)
ダウンロードファイル名:【FORM3_userinfoCHG】
送信先等
- Eメール:T_ddts_shinsei●ml.res.ncc.go.jp(●を@に置き換えてください)
- 添付のファイル名:冒頭部分【FORM1_】【FORM2_】【FORM3_】を残し、末尾部分【newlyregi】【user-deladd】【userinfoCHG】を適宜修正の上送付してください。
- 本文中:既に課題番号が付与されている試験の場合には、【課題番号T●●●●】を本文中に必ず記載してください。
アカウント情報受領後システム利用開始までの流れ
DDTSシステム利用開始までの流れは、「アカウント情報受領後、システム利用開始までの流れ(PDF:551KB)」をご参照ください。
通常、DDTSアカウント発行申請後、マスタ反映までに3営業日程度を要しますこと、ご了承ください。
利用が確認できないアカウントの削除について
2年間ご利用が確認できないアカウントについては、当該アカウントを削除させていただきますこと、ご了承ください。
治験審査委員会の日程
治験審査委員会(IRB)
原則として月2回 第2水曜日、第4水曜日開催
(開催日欄の(注)の箇所は、原則である月の第2水曜日、第4水曜日から日程を変更して開催されます)
2025年度 治験審査委員会開催予定日
以下の申請締め切り日が土曜日・日曜日、国民の祝日・休日に重なる場合には、その前の平日が締め切り日になります。予めご留意ください。
| 開催日 | 新規申請〆切 | 開催場所 | 当該委員会の委員名簿 |
|---|---|---|---|
| 2025年4月9日 | 2025年3月12日 | 柏 | 第1回(PDF:488KB) |
| 2025年4月23日 | 2025年3月26日 | 築地 | 第2回(PDF:248KB) |
| 2025年5月7日(注) | 2025年4月9日 | 柏 | 第3回(PDF:381KB) |
| 2025年5月21日(注) | 2025年4月23日 | 築地 | 第4回(PDF:96KB) |
| 2025年6月11日 | 2025年5月14日 | 柏 | 第5回(PDF:238KB) |
| 2025年6月25日 | 2025年5月28日 | 築地 | 第6回(PDF:88KB) |
| 2025年7月9日 | 2025年6月11日 | 柏 | 第7回(PDF:244KB) |
| 2025年7月23日 | 2025年6月25日 | 築地 | 第8回(PDF:75KB) |
| 2025年8月6日(注) | 2025年7月9日 | 柏 | 第9回(PDF:115KB) |
| 2025年8月20日(注) | 2025年7月23日 | 築地 | 第10回(PDF:75KB) |
| 2025年9月3日(注) | 2025年8月6日 | 柏 | 第11回(PDF:115KB) |
| 2025年9月17日(注) | 2025年8月20日 | 築地 | 第12回(PDF:75KB) |
| 2025年10月6日(注) | 2025年9月8日 | 柏 | 第13回(PDF:180KB) |
| 2025年10月29日 (注) | 2025年10月1日 | 築地 | 第14回(PDF:71KB) |
| 2025年11月12日 | 2025年10月15日 | 柏 | 第15回(PDF:116KB) |
| 2025年11月26日 | 2025年10月29日 | 築地 | 第16回(PDF:76KB) |
| 2025年12月10日 | 2025年11月12日 | 柏 | 第17回(PDF:137KB) |
| 2025年12月24日 | 2025年11月26日 | 築地 | |
| 2026年1月14日 | 2025年12月15日 | 柏 | |
| 2026年1月28日 | 2026年12月26日 | 築地 | |
| 2026年2月10日(注) | 2026年1月13日 | 柏 | |
| 2026年2月25日 | 2026年1月28日 | 築地 | |
| 2026年3月11日 | 2026年2月11日 | 柏 | |
| 2026年3月24日(注) | 2026年2月24日 | 築地 |
- 2024年度 治験審査委員会開催日並びに委員名簿
- 2023年度 治験審査委員会開催日並びに委員名簿
- 2022年度 治験審査委員会開催日並びに委員名簿
- 2021年度 治験審査委員会開催日並びに委員名簿
- 2020年度 治験審査委員会開催日並びに委員名簿
- 2019年度 治験審査委員会開催日並びに委員名簿
- 平成30年度 治験審査委員会開催日並びに委員名簿
- 平成29年度 治験審査委員会開催日並びに委員名簿
- 平成28年度 治験審査委員会開催日並びに委員名簿
- 平成27年度 治験審査委員会開催日並びに委員名簿
- 平成26年度 治験審査委員会開催日並びに委員名簿
- 平成25年度 治験審査委員会開催日並びに委員名簿
変更申請手続きについて
変更内容により、変更関連書類一覧表を確認の上、ご対応ください。変更内容により、審査区分(委員会審査・迅速審査・審査不要)が異なります。
注:変更申請に係る書類(統一書式等)については、DDTSで交付ください。
注:契約・覚書に係る書類(レター、症例追加、期間延長等)については郵送ください。
<変更申請手続きの流れ>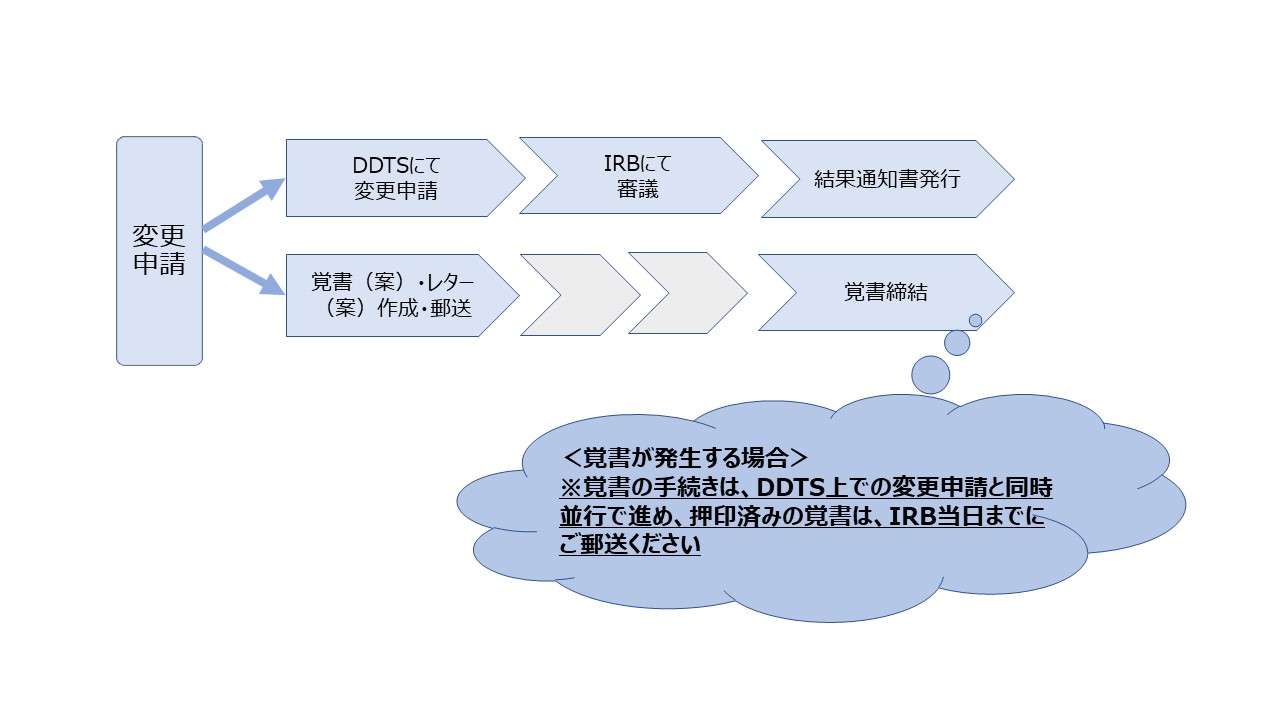
治験実施計画書に係る変更は変更審査のほか、契約や費用内容の変更にもかかわります。ご不明な点等は治験事務室にお問い合わせください。
お問い合せ先:治験事務室 変更担当 Eメール:chiken_CT●ml.res.ncc.go.jp(●を@に置き換えてください)
郵送宛先:郵便番号104-0045 東京都中央区築地5-1-1 国立研究開発法人国立がん研究センター中央病院 治験事務室 変更担当宛て
変更関係提出書類一覧
<治験>| 項番 |
変更内容 |
提出方法 |
書類(書式) |
|---|---|---|---|
|
1 |
治験実施計画書の改訂 |
DDTS |
書式10、改訂後の治験実施計画書、変更対比表 治験費用の負担に関する説明書(コホート追加等がある場合)等 |
|
2 |
治験実施計画書分冊(別紙)の改訂 |
DDTS |
原則、1に準ずるが、以下のA,B場合は審査を必須としていないため、DDTSにて交付(資料保管)のみ |
|
3 |
治験薬概要書の改訂 |
DDTS |
書式10、改訂後の治験薬概要書、変更対比表 等 |
|
4 |
説明・同意文書の改訂 |
DDTS |
書式10、改訂後の説明・同意文書、変更対比表等 |
|
5 |
症例報告書の変更 |
DDTS |
書式10、・初回申請時に審査を行った場合は変更の度(レイアウト変更の場合は提出不要) |
|
6 |
治験分担医師の追加・削除 |
DDTS |
書式2、書式10 |
|
7 |
治験協力者の追加・削除 |
DDTS |
書式2 |
|
8 |
治験責任医師の変更 |
DDTS |
書式1、書式2、書式10 |
|
郵送 |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載))、契約変更の覚書(要押印) |
||
|
9 |
契約者(CRO)代表者名または住所の変更 |
DDTS |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載)) |
|
10 |
契約内容(課題名、契約者、CRO、被験薬名 等) |
郵送 |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載))、契約変更の覚書(要押印) |
|
11 |
契約期間の延長 |
郵送 |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載))、受託研究費積算書(要押印)、ポイント算出表、契約変更の覚書(要押印) ・詳細は「受託研究費算定要領 契約期間の延長及び症例追加の費用算定について」を参照 |
|
12 |
症例数の追加 |
郵送 |
受託研究費積算書(要押印)、ポイント算出表 ・詳細は「受託研究費算定要領 契約期間の延長及び症例追加の費用算定について」を参照 |
<製造販売後調査>
| 項番 |
変更内容 |
提出 |
書類(書式) |
|---|---|---|---|
|
1 |
実施要綱の改訂 |
DDTS |
書式10、改訂後の実施要綱、変更対比表 等 ・契約内容の変更にも該当する場合は必要に応じて「5」「6」についても対応ください |
|
2 |
分担医師の追加・削除 |
DDTS |
書式2、書式10 |
|
郵送 |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載))、契約変更の覚書(要押印) |
||
|
3 |
責任医師の変更 |
DDTS |
書式1、書式2、書式10 |
|
郵送 |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載))、契約変更の覚書(要押印) |
||
|
4 |
契約代表者名または住所の変更 |
DDTS |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載)) |
|
5 |
契約内容(課題名、契約者、契約期間延長 等) |
郵送 |
レター(理事長宛、自由書式(整理番号、課題名、内容、理由を記載))、契約変更の覚書(要押印) |
|
6 |
報告書数の追加 |
郵送 |
受託研究費積算書(要押印)、契約変更の覚書(要押印) |
安全性情報について
安全性情報などを報告する場合
下記提出資料をDDTSにてご提出ください(実施医療機関の長宛てに提出された文書は責任医師保管文書と共有します)。
なお、IRB開催日のおおよそ2週間前までに提出されたものについて、直近のIRBにて審議されます。
提出書類
- 安全性情報などに関する報告書(書式16)
- 添付資料
注:医薬品の年次報告の添付資料については、「統一書式に関する記載上の注意事項(企業治験・製造販売後臨床試験)」の書式16(安全性情報等に関する報告書)3をご確認ください。
重篤な有害事象について
当院で発生しました重篤な有害事象に関しては、治験責任医師から書式12、13、14、15、19、20を用いて、治験依頼者様および治験事務室へ提出されます。
各種手続き要領
院内ネットワーク環境について
CRC派遣依頼について
当院では新規治験を実施する際、治験責任医師より研究実施管理部長にCRC派遣の依頼がされ、CRCの派遣が決定されます。CRC派遣決定までの流れは以下のようになります。
- 治験責任医師から研究実施管理部長へCRC派遣を依頼します(CRC派遣依頼票(Excel:36KB)を提出)。
注:遅くとも、治験依頼者から治験事務室へ費用に関する面談を申し込む前に提出。 - 研究実施管理部長にてCRC派遣が検討され、担当するCRCが決定されます。
- 研究実施管理部長から治験責任医師・担当CRCへ当該治験へのCRC派遣決定が連絡されます(CRC派遣依頼返信票にて通知)。
- 治験責任医師より治験依頼者へCRC派遣決定と担当CRCをお知らせします。
- CRC派遣依頼に関するお問合せ先
お問合せ先:CRC派遣窓口担当
Eメール:crc_haken_ncch●ml.res.ncc.go.jp(●を@に置き換えてください)
委嘱契約等について
各種申請書式・雛形(ダウンロード)
- 治験に関する書式等 NEW!
- 受託研究(治験以外)に関する書式等
- 委嘱契約に関する書式
- 電子機器(搬入)端末セキュリティ仕様調査・管理表(EXCEL:20KB)
- 説明文書・同意文書共通テンプレート(WORD:484KB)NEW!
- 治験参加証(雛形)(WORD:24KB)
治験SOP(ダウンロード)
治験審査委員会 委員名(ダウンロード)
治験審査委員会 会議記録の概要(ダウンロード)
- 会議記録の概要(委員会名簿を含む)
国立がん研究センター中央病院で実施している治験
治験は新しい薬や新しい治療方法についての効果や安全性を確認して国の承認を得ることを目的に実施される臨床試験です。治験に参加することは、参加した患者さんへの治療のみならず、新薬や新治療方法を誕生させることによって、将来、より多くの患者さんが新しい治療を受けられることにつながると期待されます。
国立がん研究センター中央病院では、国民に新しい薬や新しい治療方法が早く提供されるように、積極的に治験にも取り組んでいます。担当医から治験についての紹介を受けた場合、その参加についてもご検討ください。
臨床検査科
1)臨床検査基準値一覧
臨床検査基準値一覧(PDF:576KB)2025年8月26日改訂版 NEW!
基準範囲(変更・追加・削除)のお知らせ(PDF:220KB)2025年8月21日 NEW!
3)その他
精度管理や監査等に関するお問い合わせは、以下宛先までご連絡ください。
臨床検査科 治験検査室
Eメール:rinshoukensa-chiken●ml.res.ncc.go.jp(●を@に置き換えください)
放射線技術部
治験における病理検体の作製および依頼について
2024年4月12日 改訂版
病理組織標本作製・提出の必要がある治験においては、
- 治験依頼者は、治験審査委員会への新規申請の時期と合わせて、治験責任医師へ病理組織標本提出の目的・手順のご説明をお願いします。
- 治験責任医師は、当該治験に係る治験審査委員会開催までに、病理科への依頼をお願いします。
- 病理組織標本の種別・枚数による依頼方法は以下の通りです
作製プレパラート:1枚から10枚の場合
- 治験責任医師へ依頼ください(メールをご利用ください)。治験責任医師から研究管理実施部長へ確認依頼をします。
- 用意いただくもの(治験責任医師へメールでお送りください)
- プロトコール概要(CRC派遣依頼時に提出済みの場合は不要)
- 病理組織標本作製「手順書」(テンプレート(WORD:133KB)をご使用ください)
- 病理組織標本作製「依頼書」(テンプレート(WORD:24KB)をご使用ください)
- 依頼の内容・標本種別によっては、研究管理実施部長から問い合わせ、または個別相談をお願いする場合があります。
作製プレパラート:11枚以上の場合
- 治験に病理診断科への標本作製を依頼が必要な場合、まずは治験責任医師にご相談ください。
- 治験責任医師および依頼者を交えて、提出の手順や本院の標本が要求事項や合うかについて、病理診断医とオンライン会議により打ち合わせを行います。
- アポイント取得方法
- 治験責任医師から、patho-consult●ml.res.ncc.go.jp(●を@に置き換えください)へ、依頼者(製薬企業)をCCに入れて以下の内容を含むメールをお送りください。
- 治験プロトコール概要(書式自由)
- 病理組織標本作製「手順書」(テンプレート(WORD:133KB)をご使用ください)
- 病理組織標本作製「依頼書」(テンプレート(WORD:24KB)をご使用ください)
- 相談者・治験責任医師の希望する日時3つ(合わないときは再調整となります)
- 折り返し、開催日時に合わせたTEAMS招待メールをお送りします。
- 依頼の内容・種別によっては、プレパラート作製対応ができない場合がありますが、通常は手順書などの修正のうえで、病理診断科の承認が得られます。
- 不明な点があれば、patho-consult●ml.res.ncc.go.jp(●を@に置き換えください)へお問い合わせください。
病理組織ブロックの貸し出し、および、提供:不可
- 病理組織ブロックの貸し出しは行いません。ただし、別途治験専用に検体を採取した場合は病理診断科でブロックを作製し、提供します。
治験における病理診断書の提出について
- 病理診断書等の診療記録の写しを提出する治験においては、その旨が治験実施計画書に記載され治験審査委員会の審査を経て治験実施医療機関の長から許可を得ていること及び患者さんへの説明・同意が得られていることが、診療記録の写しを治験依頼者に提出する際に必要になります。治験依頼者は、その内容が治験実施計画書に記載され、説明同意文書においても説明されていることを、申請前に確認いただくようお願いします。
